响应面法优化金银花多酚氧化酶提取工艺
2014-01-18周燕燕刘云宏朱文学郝英超
罗 磊,周燕燕,刘云宏,朱文学,郝英超,杨 彬
(河南科技大学食品与生物工程学院,河南 洛阳 471000)
响应面法优化金银花多酚氧化酶提取工艺
罗 磊,周燕燕,刘云宏,朱文学,郝英超,杨 彬
(河南科技大学食品与生物工程学院,河南 洛阳 471000)
以金银花为原料,采用匀浆浸提法提取多酚氧化酶,利用单因素试验和响应面优化法对料液比、提取pH值、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)添加量和浸提时间等工艺条件进行分析与优化。结果表明:匀浆浸提工艺参数对金银花多酚氧化酶提取有显著影响,影响显著顺序为缓冲液pH值>料液比>浸提时间>PVP添加量。金银花多酚氧化酶匀浆浸提优化工艺参数:料液比1∶6.29(m/V)、缓冲液pH 8.03、PVP添加量1 g/100 mL、浸提时间1.71 h,在此条件下获得酶比活力为667.564 U/mg,所得多酚氧化酶提取回归模型显著(R2=0.9425),拟合性好,可用于预测多酚氧化酶的提取效果。
金银花;多酚氧化酶;提取;响应面优化
金银花为植物忍冬(Lonicera japonica Thunb.)的花蕾,具有清热解毒、疏利咽喉、消暑除烦的功效,近代药理实验和临床应用证实金银花对多种致病菌有较强的抑菌效果[1],并具有抗衰老、防癌变、轻身健体的良好功效,广泛用于食品、饮料和保健品生产[2],是一种天然的“药食同源”原料[3]。金银花采收后需及时干燥,而不恰当的干燥往往造成金银花外观颜色劣变和药用品质的损失,前期研究结果证实,造成这一损失的主要原因是多酚氧化酶(polyphenol oxidase,PPO)引发的酶促褐变[4-7],目前关于金银花PPO的提取未见报道。
常见的PPO提取方法有丙酮法和匀浆浸提法,施春华[8]、肖厚荣[9]等利用丙酮法从不同品种烟草中分离PPO,Vicente等[10]则利用丙酮法提取鳄梨中的PPO。丙酮沉淀法所得酶液体积小、浓度高,提取效果好,但工艺复杂,丙酮有一定毒性。匀浆浸提法操作简便,提取条件温和,所得酶液活性较高,可直接用于进一步研究。胡婉峰等[11]通过使用匀浆浸提法获得活性较好的莲藕PPO。为得到高比活性的金银花PPO,本实验对其匀浆浸提工艺进行研究,为金银花酶促褐变机理及绿原酸等酚类物质代谢途径研究奠定一定的依据和基础。
1 材料与方法
1.1 材料与试剂
金银花,购自河南孟津县金银花生产基地,品种为金丰一号。
聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、磷酸氢二钠、磷酸二氢钠、硫酸铵、邻苯二酚、考马斯亮蓝G-250、牛血清白蛋白、乙醇、磷酸,均为分析纯。
1.2 仪器与设备
722N型分光光度计、PHS-3C型精密pH计 上海精密科学仪器有限公司;KDC-160HR高速冷冻离心机科大创新股份有限公司中佳分公司。
1.3 方法
1.3.1 金银花PPO提取与纯化[12]
采用磷酸盐缓冲溶液(phosphate buffered saline,PBS)匀浆浸提金银花PPO,硫酸铵沉淀法对其进行纯化。
挑选金银花10 g,加入pH 7的PBS溶液80 mL(内含PVP 1.6 g),匀浆4 min,8层纱布过滤,4℃浸提1 h;于4℃、9 000 r/min离心15 min,收集上清液即为粗PPO液;采用硫酸铵分级沉淀除去粗酶液中的其他杂质蛋白,盐析后所得酶液置于4℃在蒸馏水中透析24 h,即为纯化的PPO液。
1.3.2 酶活力测定[13]
使用磷酸盐缓冲溶液配制邻苯二酚为反应底物,室温条件下,将0.4 mL酶液与2 mL底物溶液混合均匀后倒入1 cm比色皿中,420 nm波长处测定吸光度,从酶液加入后开始计时,每10 s记录一次吸光度,以底物溶液为空白组,通过最初直线段的斜率计算酶活力。一个酶活力单位(U)定义为:在测定条件下,单位时间内引起吸光度改变0.001所需的酶量。

式中:Vr为加样缓冲液总体积/mL;Vs为取样比色体积/mL;m为取样质量/g。
1.3.3 蛋白质质量浓度测定
采用Bradford考马斯亮蓝法测定蛋白质含量[14],用牛血清白蛋白制作蛋白质标准曲线,标准曲线方程为y=3.825 x+0.0421,R2=0.9 992(式中:y为吸光度,x为蛋白质质量浓度/(mg/mL)),根据方程计算出样品中蛋白质质量浓度。
1.3.4 金银花PPO酶比活力的测定[15-16]
酶比活力是单位蛋白质所具有的酶活力,一般用U/mg来表示,见式(2)。

1.3.5 金银花PPO提取单因素试验
以提取金银花PPO的料液比、缓冲液pH值、浸提时间、PVP添加量为试验因素,以金银花PPO酶比活力为指标,分别做单因素试验,分析各因素对金银花PPO酶比活力的影响规律。
1.3.6 金银花PPO提取工艺的响应面试验
根据单因素试验结果,使用Box-Behnken中心试验设计,分析料液比、提取pH值、PVP用量以及浸提时间对PPO酶比活力的影响。
2 结果与分析
2.1 料液比对金银花PPO酶比活力的影响
以固定缓冲液pH7、PVP 1 g/100 mL、浸提时间2 h,考察不同料液比(1∶5、1∶6、1∶7、1∶8、1∶9、1∶10)对金银花PPO酶比活力的影响,结果见图1。

图1 料液比对金银花PPO酶比活力的影响Fig.1 Effect of solid-to-liquid ratio on the PPO specific activity
由图1可知,当料液比大于1∶7时,PPO酶比活力随料液比的增加而明显上升,当料液比小于1∶7后,PPO酶比活力有所降低后基本保持不变。料液比过低致使原料打浆困难PPO不能完全溶入提取液中,提取不彻底造成PPO酶比活力偏低,随着料液比的增加,PPO越来越多地溶入提取液中,比活力随之增加[17],当料液比达到一定时,随着料液比的继续增加,PPO的溶出量达到一定值,提取液量的增加造成PPO量减小,酶比活力降低。
2.2 缓冲液pH值对金银花PPO酶比活力的影响

图2 缓冲液pH值对金银花PPO酶比活力的影响Fig.2 Effect of extraction buffer pH on the PPO specific activity
以固定料液比1∶7、PVP 1 g/100 mL、浸提时间2 h,考察不同pH值(4、5、6、7、8、9、10)缓冲液对金银花PPO比活力的影响,结果见图2。采用不同pH值的磷酸盐缓冲液提取金银花PPO,所得PPO酶比活力不同,当缓冲液pH值为7时,存在一个明显的峰值,pH值小于7时,随着缓冲液pH值的增加,PPO酶比活力上升,pH值大于7时,随着缓冲液pH值的增加,PPO酶比活力下降。这可能是酸性和碱性环境对酶的构相稳定性均有较大的影响,不适宜的pH值会引起酶蛋白的聚集、变性等,造成酶活力的降低;由于PPO是含Cu元素膜结合蛋白,在pH值较低的酸性环境中,Cu2+被解离出来,当在pH值过高的碱性环境中时,Cu2+解离形成氧化铜,或转化成Cu(OH)2沉淀,从酶中脱离出来,均会降低酶比活性[18]。
2.3 PVP添加量对金银花PPO酶比活力的影响
以固定料液比1∶7、缓冲液pH 7、浸提时间2 h,考察不同PVP添加量(1、1.5、2、2.5、3、3.5、4 g/100 mL)对金银花多酚氧化酶比活力的影响,结果如图3。

图3 PVP添加量对金银花PPO酶比活力的影响Fig.3 Effect of added PVP concentration on the PPO specific activity
由图3可知,当PVP添加量为1.5 g/100 mL时,PPO酶比活力达到最大值,PVP添加量小于1.5 g/100 mL时,随着添加量的增加PPO酶比活力逐渐升高,PVP添加量大于1.5 g/100 mL时,随着添加量的增加PPO酶比活力逐渐降低。这可能是金银花PPO提取过程中,原料自身所含的酚类物质能与PPO发生结合,沉淀蛋白质从而影响PPO酶活性。PVP是一种多酚吸附剂,能够在酶提取过程中保护酶蛋白的构象和活力不受酚类的影响。当PVP添加量过低时,不能有效的吸附酚类物质,使PPO活性较低,PVP添加量过高时,在吸附酚类物质的同时,PVP中的一个肽链结构能与PPO中的Cu2+产生螯合作用,影响PPO活性;PVP含量过高,使提取液过于黏稠,不利于PPO的提取[19]。
2.4 浸提时间对金银花PPO酶比活力的影响
以固定料液比1∶7、缓冲液pH7、PVP 1 g/100 mL,考察不同浸提时间(0、1、2、3、4、5、6 h)对金银花PPO酶比活力的影响,结果如图4。
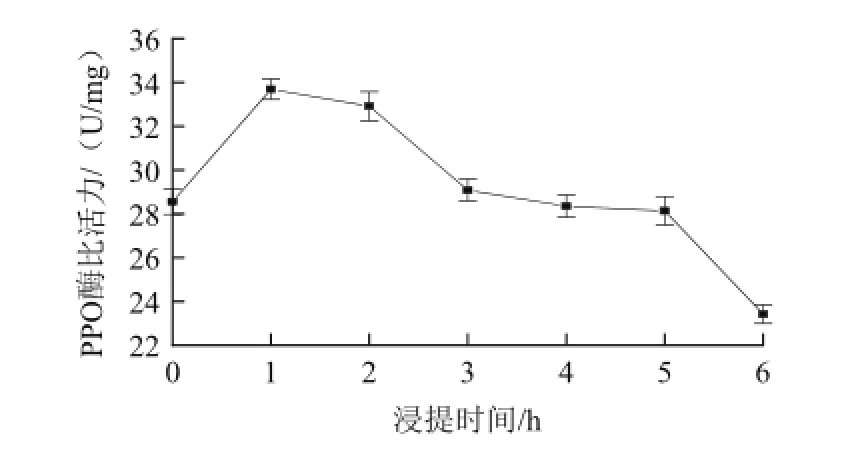
图4 浸提时间对金银花PPO酶比活力的影响Fig.4 Effect of extraction time on the PPO specific activity
由图4可知,随着浸提时间的增长,PPO的酶比活力先增加,当达到一定时间后开始逐渐降低,当浸提1 h时,PPO的提取率最高。这可能是在PPO提取的过程中,随着时间的增长,越来越多的酶被浸提到缓冲液中,提取液的酶活性也相应的提高,随着时间的延长,由于酶蛋白在溶液状态下构象不稳定,以及金银花酚类等其他物质溶出,均容易造成酶活性的降低[20-21]。
2.5 金银花PPO提取工艺的响应面优化
2.5.1 回归模型的建立
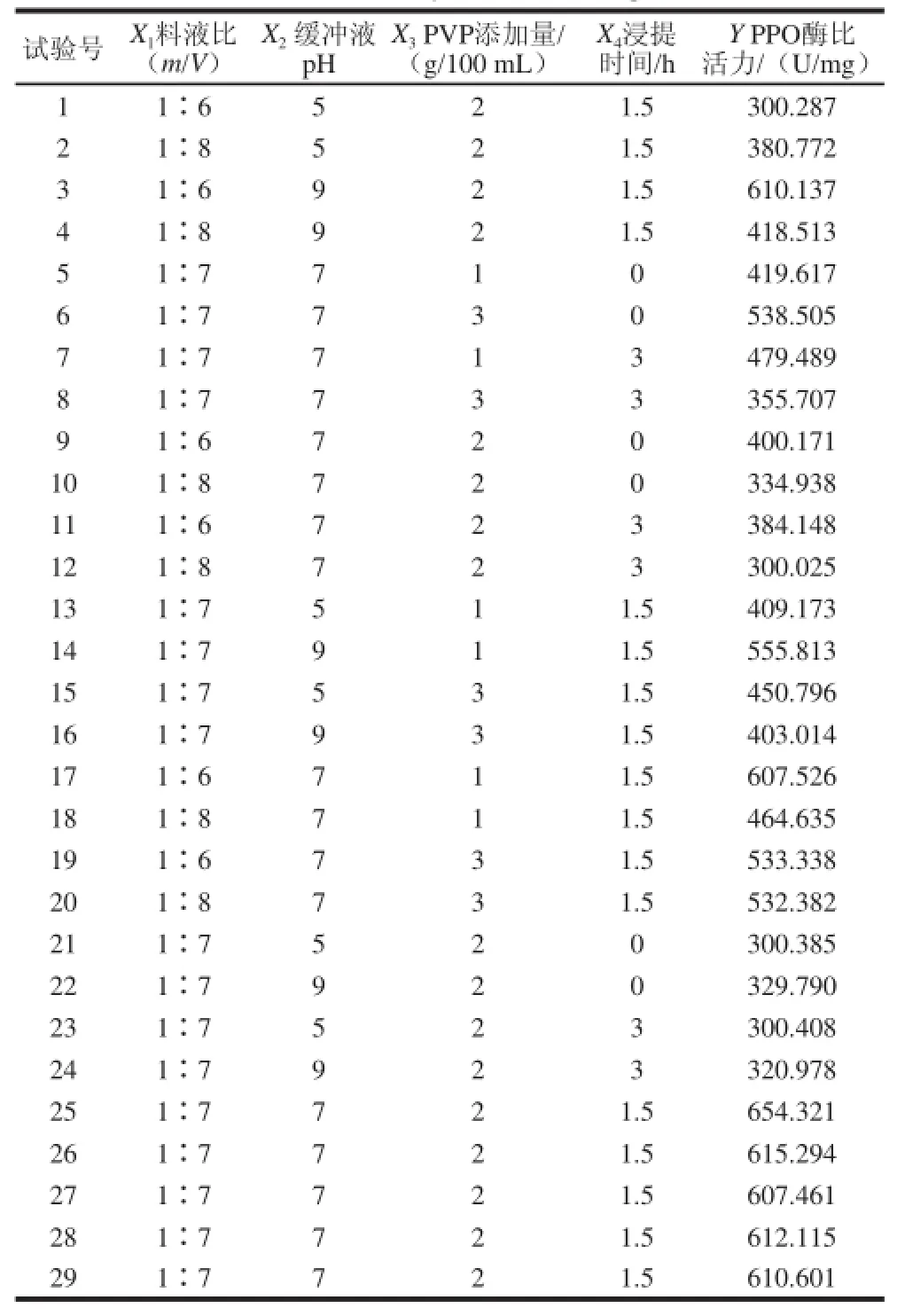
表1 Box-Behnken试验设计方案与结果Table 1 Box-Behnken experimental design and results
响应曲面设计方案及结果见表1。每个试验组合重复试验3次,取其平均值作为PPO酶比活力结果,采用Design-Expert 8.05软件分析试验结果。
对表1试验结果进行多元回归拟合,得金银花PPO酶比活力对料液比(X1)、缓冲液pH值(X2)、PVP添加量(X3)和浸提时间(X4)的二次多项式回归模型为:
Y=-6 414.146 73+1 170.322 54X1+779.509 02X2+25.535 8 9X3+330.021 6 1X4-34.013 6 2X1X2+35.483 58X1X3-3.148 33X1X4-24.302 75X2X3-0.736 25X2X4-40.445 00X3X4-73.726 21X12-33.644 25X22-13.335 84X32-77.362 27X42。
对回归模型进行方差分析和系数显著性检验,结果如表2。

表2 回归模型的方差分析及回归系数的显著性检验Table 2 Analysis of variance for the established regression model
由回归模型方差分析的结果(表2)可以看出,模型显著性极高,方程不失拟;R2=0.942 5,表明所建立的回归二次模型成立,可用此模型来分析和预测匀浆浸提法提取金银花PPO提取工艺条件。从回归模型系数显著性检验结果可知,X2、X1X2、X3X4、X12、X22、X42对提取金银花PPO酶比活力影响极显著,X1、X2X3对提取金银花PPO酶比活力影响显著,对提取金银花PP O酶比活力影响不显著。对金银花PPO酶比活力影响的主次因素依次为缓冲液pH值>料液比>浸提时间>PVP添加量。
2.5.2 模型双因素交互作用效应分析
将回归方程中的任意2个因素固定在零水平,对余下的2个因素按照所得的二元二次回归方程进行编程运算[22],经软件分析得到交互因素的响应面和等高线图。由图5并结合表2的显著性分析可知,模型中因素X1X2和因素X3X4之间的交互作用较显著。X1X2交互作用显著可能是因料液比影响PPO的质量浓度,缓冲液pH值的变化会影响PPO的酶活性,两者相互作用改变PPO酶比活力;X3X4交互作用显著的原因可能为PVP对酶液中酚类物质的吸附作用随着浸提时间的变化而变化,进一步影响PPO的酶比活性。
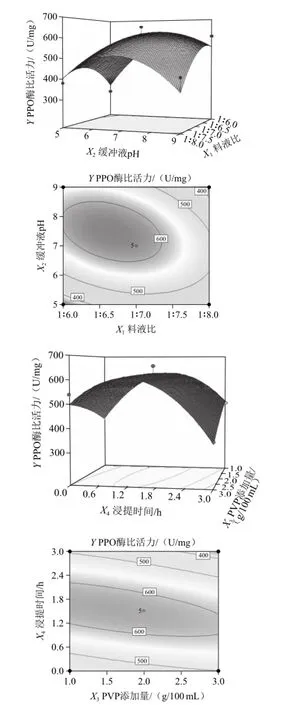
图5 料液比与缓冲液pH值及PVP添加量与浸提时间交互作用的响应面和等高线图Fig.5 Response surface and contour plots showing the effects of X1X2and X3X4on the PPO specific activity
对回归方程进行分析计算,得到金银花PPO最佳提取工艺条件为料液比1∶6.29、缓冲液pH 8.03、PVP添加量1 g/100 mL、浸提时间1.71 h,在此条件下获得PPO酶比活力667.564 U/mg。
2.5.3 验证实验
为检验响应面优化法对金银花PPO提取效果的可靠性,在优化提取条件下进行PPO的提取,参考实际操作,采用料液比1∶6.3、缓冲液pH 8、PVP添加量1 g/100 mL、浸提时间1.7 h为最佳提取条件,进行3次平行验证实验,所得金银花PPO的平均酶比活力为654.998 U/mg,与理论值偏差较小,重复性好,没有显著差异,说明运用响应面法优化得到的模型参数准确可靠。
3 结 论
在单因素试验的基础上,采用Box-Behnken设计,建立了金银花PPO提取工艺参数的二次多项式数学模型,经检验该模型合理可靠,能较准确的预测金银花PPO的酶比活力,反映了提取效果的优劣。匀浆浸提法对金银花PPO酶比活力影响的主次因素依次为缓冲液pH值>料液比>浸提时间>PVP添加量,料液比与缓冲液pH值的交互作用,及PVP添加量与浸提时间的交互作用对PPO酶比活力影响显著。最佳提取条件为料液比1∶6.29(m/V)、缓冲液pH 8.03、PVP添加量1 g/100 mL、浸提时间1.71 h,在此条件下获得酶比活力为667.564 U/mg。利用响应面分析方法获得金银花多酚氧化酶提取的最优工艺参数,将为干燥过程中金银花酶促褐变机理及绿原酸等酚类物质代谢途径研究提供参考。
[1] 武晓红, 田智勇, 王焕. 金银花的研究新进展[J]. 时珍国医国药, 2005, 16(12): 111-112.
[2] 马雪梅, 吴朝封. 河南省金银花产业发展现状及思路[J]. 湖北农业科学, 2012, 51(6): 1185-1188.
[3] 石钺, 石任兵, 陆蕴如, 等. 我国药用金银花资源、化学成分及药理研究进展[J]. 中国药学杂志, 1999, 34(11): 724.
[4] 李会军. 金银花的活性成分与质量评价研究[D]. 南京: 中国药科大学, 2003.
[5] 侯爽爽. 金银花热风干燥过程中颜色劣变机理及抑制研究[D]. 洛阳: 河南科技大学, 2011.
[6] LEA A G H. Flavor, color and stability in fruit products: the effects of polyphenols[M]//HEMINGWAY R W, LAKS P E. Plant polyphenols: synthesis properties, significance. New York: Plenum Press, 1992: 827-848.
[7] 侯爽爽, 罗磊.金银花热风干燥过程中颜色的劣变机理[J]. 农产品加工: 学刊, 2010(10): 63-65.
[8] 施春华. 烟草多酚氧化酶的分离纯化, 光谱性质, 反应机理和应用研究[D]. 合肥: 中国科学技术大学, 2002.
[9] 肖厚荣. 烟草多酚氧化酶同功酶的分离纯化、表征、酶学性质和应用研究[D]. 合肥: 中国科学技术大学, 2004.
[10] GÓMEZ-LÓPEZ V M. Some biochemical properties of polyphenol oxidase from two varieties of avocado[J]. Food Chemistry, 2002, 9(7): 163-169.
[11] 胡婉峰, 赵洪雷, 万琼红. 莲藕多酚氧化酶的纯化方法研究[J]. 食品科学, 2009, 30(1): 173-176.
[12] LIU Nana, LIU Wei, WANG Daijie, et al. Puri cation and partial characterization of polyphenol oxidase from the ower buds of Lonicera japonica Thunb.[J]. Food Chemistry, 2013, 138: 478-483.
[13] HE Silian, LIU Huixia, ZHOU Shaoji, et al. A preliminary study on poly phenol oxidase extraction from sugarcane juice[C]// South China University of Technology (SCUT). Biennial World Conference on Recent Development in Sugar Technologies. Guangzhou: SCUT, 2009: 183-186.
[14] 李凤英, 崔蕊静, 李春华. 葡萄籽蛋白质的提取工艺研究[J]. 中国油脂, 2005, 30(4): 36-39.
[15] 黄涛. 桑叶多酚氧化酶分离纯化及其酶学性质的研究[D]. 南宁: 广西大学, 2008.
[16] MISHRA B B, GAUTAM S, SHARMA A. Puri cation and characterization of polyphenol oxidase (PPO) from eggplant[J]. Food Chemistry, 2012, 134: 1855-1861.
[17] SUN Xiaohong, ZHU Kexue, ZHOU Huiming. Optimization of a novel backward extraction of defatted wheat germ protein from reverse micelles[J]. Innovative Food Science and Emerging Technologies, 2009, 10: 328-333.
[18] 王磊. 马铃薯酶促褐变机理研究[D]. 南昌: 南昌大学, 2012.
[19] TEREFE N S, YANG Yahong, KNOERZER K, et al. High pressure and thermal inactivation kinetics of polyphenol oxidase and peroxidase in strawberry puree[J]. Innovative Food Science and Emerging Technologies, 2010, 11: 52-60.
[20] GAO Zhaojian, HAN Xiaohong, XIAO Xingguo. Puri cation and characterisation of polyphenol oxidase from red swiss chard[J]. Food Chemistry, 2009, 117: 342-348.
[21] 贺寅, 王强, 钟葵. 响应面优化酶法提取龙眼多糖工艺[J]. 食品科学, 2012, 33(2): 79-83.
[22] 周丽卿, 杜双奎, 赵佳, 等. 响应面法优化鹰嘴豆蛋白提取工艺[J].食品科学, 2012, 33(8): 66-70.
Optimization of Extraction Process for Polyphenoloxidase from Honeysuckle (Lonicera japonica Thunb.) Flowers Using Response Surface Methodology
LUO Lei, ZHOU Y an-yan, LIU Yun-hong, ZHU Wen-xue, HAO Ying-chao, YANG Bin
(College of Food and Biological Engineering, Henan University of Science and Technology, Luoyang 471000, China)
This study was aimed to optimize the extraction process for polyphenoloxidase (PPO) from honeysuckle (Lonicera japonica Thunb.) flowers using response surface methodology. The results showed that four operating parameters including buffer pH, material-to-liquid ratio, extraction time and polyvinylpyrrolidone(PVP) concentration had notable effects on the extraction of PPO from honeysuckle flowers and their effects could be ranked in decreasing order of importance as follows: buffer pH > material-to-liquid ratio > extraction time > PVP concentration. The optimal extraction parameters were determined as pH 8.03 and 1:6.29 (m/V) of material-to-liquid, 1 g/100 mL PVP added to the extraction solvent and extraction for 1.71 h , resulting in a PPO specific activity of 667.564 U/mg. The established regression model describing PPO extraction from honeysuckle flowers as a function of the four extraction parameters was highly significant (R2=0.9425). The predicted and experimental results were found to be in good agreement. Thus, the model can be applicabl e for the prediction of PPO extraction from honeysuckle flowers.
honeysuckle; polyphenoloxidase (PPO); extraction; response surface optimization
TS201
A
1002-6630(2014)03-0117-05
10.7506/spkx1002-6630-201403024
2013-08-03
国家自然科学基金联合基金项目(U1304330)
罗磊(1976—),男,副教授,博士,研究方向为天然活性物质。E-mail:13623896431@139.com
