等离子体诱变凝结芽孢杆菌提高木糖利用能力高产L-乳酸
2014-01-17郑兆娟欧阳嘉
蔡 聪,姜 婷,郑兆娟,欧阳嘉,*
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.南京林业大学 江苏省生物质绿色燃料与化学品重点实验室, 江苏 南京 210037)
等离子体诱变凝结芽孢杆菌提高木糖利用能力高产L-乳酸
蔡 聪1,2,姜 婷2,郑兆娟2,欧阳嘉1,2,*
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.南京林业大学 江苏省生物质绿色燃料与化学品重点实验室, 江苏 南京 210037)
为进一步提高凝结芽孢杆菌发酵木糖生产L-乳酸的产量和转化率,以实验室保存的一株能利用木糖产L-乳酸的野生型凝结芽孢杆菌菌株NL01为出发菌株,通过等离子体诱变育种技术和平板菌落初筛、摇瓶复筛,最终得到一株木糖耐受力强、L-乳酸产量高、遗传特性稳 定的正向突变菌株NL-CC-17。该突变菌株是目前已报道的木糖耐受力最高的菌株。当以100 g/L的木糖为底物,50℃发酵72 h后,L-乳酸产量达到82.30 g/L,糖酸转化率为92.37%,L-乳酸产量较出发菌株提高21.51%,糖酸转化率提高了16.00%。通过初步优化发酵条件,确定该菌株最佳发酵温度为50℃,实验范围内最佳发酵pH值为5.5。
常温常压等离子体;凝结芽孢杆菌;诱变;L-乳酸;木糖
乳酸是一种广泛应用于食品、医药、化工等行业的多用途有机酸[1-3]。目前,乳酸的传统生产工艺主要采用以淀粉质原料为底物发酵生产,这不仅消耗了粮食资源,而且提高了乳酸生产成本[4]。目前,利用丰富且廉价的木质纤维素资源生产乳酸已成为国内外研究的重点[5-6]。木质纤维素经过高温酸解以及酶解处理,可以转变成以木糖和葡萄糖为 主的混合糖液。对于以葡萄糖为底物发酵生产L-乳酸的过程已有大量报道[7-9],而有关发酵木糖生产L-乳酸的报道相对较少。Taniguchi等[10]利用Enterococcus casseliflavus以木糖为底物发酵生产乳酸,产量为38 g/L,糖酸转化率76%;Ilmén等[11]在重组树干毕赤酵母菌中表达乳酸菌的L-乳酸脱氢酶,构建的基因工程菌可利用100 g/L木糖生产58 g/L乳酸,糖乳酸转化率为53%;杨英歌等[12]通过氮离子注入方法选育出一株米根霉利用木糖发酵生产L-乳酸产量为74.37 g/L,糖酸转化率约74.37%,糖酸转化率相对较低。总体来说,木糖发酵生产乳酸研究发展至今仍然存在糖耐受浓度低、乳酸产量低、糖酸转化率低等问题,不利于生物质资源的全利用[13]。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变是清华大学自主研发的一种新型诱变育种技术。与常规诱变技术相比,ARTP具有射流温度低、产生的等离子体均匀、无需真空装置、操作简单、与生物大分子和细胞作用明显等优点。前期实验结果表明,ARTP诱变技术对遗传物质的损伤机制多样,能够快速地突变细菌、真菌、酵母等微生物,获得多种突变型[14-16]。
本实验室前期已筛选出一株能利用木糖产L-乳酸的野生型凝结芽孢杆菌菌株NL01,其最大的特点是所产L-乳酸的光学纯度很高。为了进一步提高该菌株的木糖耐受能力以及L-乳酸产量和糖酸转化率,本研究通过等离子体诱变和高糖高酸平板筛选突变菌株,并对正向突变菌株的发酵特性进行研究,以期为今后利用生物质资源生产L-乳酸的研究提供参考。
1 材料与方法
1.1 菌株
凝结芽孢杆菌(Bacillus coagulans)NL01,诱变原始菌株,由南京林业大学生物化工研究所保存提供。
1.2 培养基
种子培养基:木糖20 g/L、酵母膏2 g/L、玉米浆干粉2.5 g/L、氯化铵1 g/L、无水硫酸镁0.2 g/L、碳酸钙20 g/L,pH 7.2。发酵培养基:木糖100 g/L、酵母膏2.5 g/L、玉米浆干粉5 g/L、氯化铵1 g/L、无水硫酸镁0.5 g/L、碳酸钙70 g/L,pH 7.2。高糖高酸筛选培养基:木糖100 g/L、乳酸10 g/L、酵母膏2.5 g/L、玉米浆干粉5 g/L、氯化铵1 g/L、无水硫酸镁0.5 g/L、琼脂20 g/L,pH 7.2。
1.3 仪器与设备
FE20 pH计 梅特勒-托利多仪器(上海)有限公司;Agilent 1200型高效液相色谱仪 美国Agilent公司;Aminex HPX-87有机酸离子交换柱 美国Bio-Rad公司。
1.4 离子注入诱变
菌体培养至对数后期,加无菌水稀释至细胞密度OD600nm值略大于1,将稀释好的菌悬液进行诱变,诱变采用的是清华大学研制的ARTP-Ⅱ型育种机。诱变条件为功率100 W、辐照距离2.5 mm、氦气通量10 L/min、辐照时间分别为30、60、90、120、180 s。诱变完成后,用无菌生理盐水适当稀释后涂布LB平板,再将平板倒置于50℃恒温箱中培养2 d左右,挑取单菌落进行后期发酵测定实验。
1.5 菌株的筛选
将出发菌株菌悬液接至LB液体培养基,摇床活化22~24 h后,涂于含不同质量浓度乳酸钙和木糖的培养平板,50℃培养24 h,观察菌体生长情况,得到出发菌株的乳酸和木糖临界抑制质量浓度,由此确定筛选平板。诱变后,从高糖高酸平板上筛选突变菌株。
1.6 分析方法
1.6.1 pH值的测定采用实验室pH计测定溶液pH值。
1.6.2 生物量的测定采用比浊法,紫外分光光度计测菌液OD600nm值。
1.6.3 木糖及L-乳酸的测定采用Agilent 1200型高效液相色谱仪,Aminex HPX-87有机酸离子交换柱,以5 mmol/L硫酸为流动相,流速为0.6 mL/min,柱温55℃,示差折光检测,进样量10 μL。
L-乳酸相对产量:是相对最高产量得到的百分数,以最高真实产量为100%。
1.6.4 糖酸转化率的计算

1.6.5 存活率的计算

2 结果与分析
2.1 出发菌株的生长曲线

图1 凝结芽孢杆菌N L 01的生长曲线Fig.1 Growth curve of B. coagulans NL01
凝结芽孢杆菌NL01在LB液体培养基中,恒温50℃、180 r/min条件下摇床培养的生长曲线如图1所示,菌株大约在生长8 h后进入对数生长期,25 h后结束对数生长期转入稳定期。在实际育种工作中,常选用对数生长期中后期的细菌营养体进行诱变处理,此时的细菌不但菌体浓度合适、生理状态同步,而且对理化因素敏感,有利于诱变处理[17]。故本实验中使用生长了22~24 h的细胞作为诱变用出发菌种。
2.2 出发菌株乳酸和木糖临界抑制质量浓度
出发菌株凝结芽孢杆菌NL01经种子培养基活化后,稀释一定倍数涂布于含不同质量浓度木糖和乳酸钙的培养基平板上,50℃恒温培养1~2 d后,结果如表1所示。
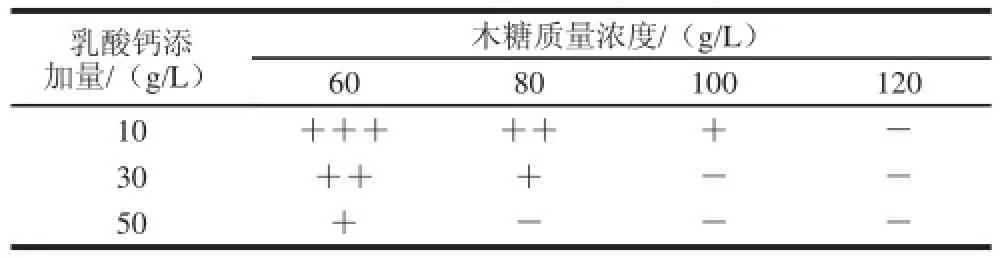
表1 出发菌株乳酸与木糖临界抑制质量浓度Table 1 Critical inhibitory concentration of lactic acid and xylose for strain NL01
由表1可知,出发菌株在含30 g/L乳酸钙和100 g/L木糖的平板上表现出严重抑制现象。后续实验中高糖高酸筛选平板配方中木糖和乳酸钙的质量浓度分别选择100 g/L和30 g/L。
2.3 出发菌株的诱变和筛选
2.3.1 出发菌株的诱变条件确定
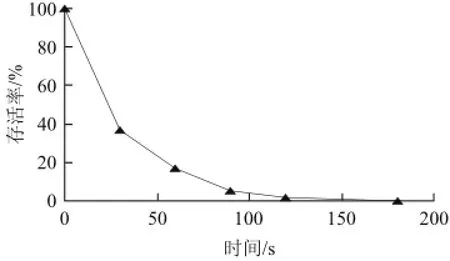
图2 凝结芽孢杆菌NL01离子诱变存活曲线Fig.2 Ion mutagenesis survival curve of B. coagulans NL01
根据诱变理论研究,80%~90%的致死率有利于正突变菌株的产生[18-20],并且此时等离子的注入在离子进入细胞内时,激活了细胞的修复机制和修复所需要的酶[21-23],故本实验选择存活率为17%左右、辐照60 s的菌液平板挑取单菌落进行发酵测定。
2.3.2 诱变突变株的发酵性能及高产菌的筛选
从离子注入诱变后的筛选平板挑取100株长势良好的菌株活化12 h,以木糖为唯一碳源发酵72 h,初始糖质量浓度为100 g/L,发酵72 h,最后通过对比L-乳酸产量及其糖酸转化率,选定了NL-CC-17、NL-CC-25、NL-CC-37、NL-CC-54、NL-CC-89这5株菌又进一步进行发酵能力测试,结果如表2所示,在L-乳酸产量和糖酸转化率对比的基础上,又利用高效液相色谱对其乳酸光学纯度进行了综合对比,最后选定菌株NL-CC-17进行下一步的实验。
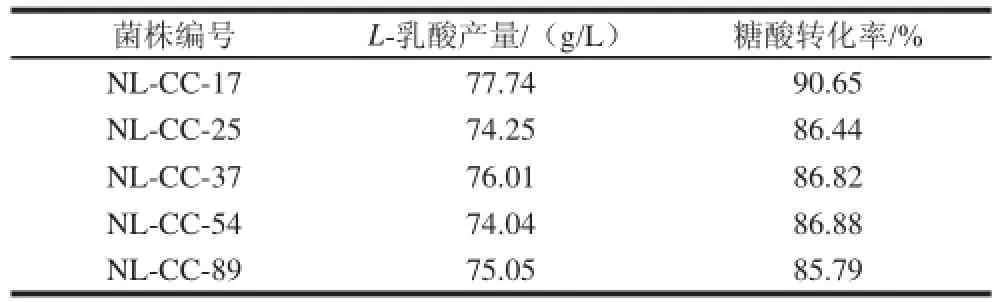
表2 诱变后菌株的木糖发酵能力Table 2 Xylose fermentation capacity for mutant strains
2.3.3 对筛选出的菌种进行遗传稳定性实验
为了鉴定筛选到的高产菌能否稳定地遗传,对菌株NL-CC-17做了遗传稳定性考察。每代实验过程为:高产菌株→种子培养→摇瓶发酵→种子培养→摇瓶发酵,第2次发酵的接种液为上1次发酵72 h的发酵液。发酵72 h后测L-乳酸产量。共传5代,每代均做3个平行,结果见表3。
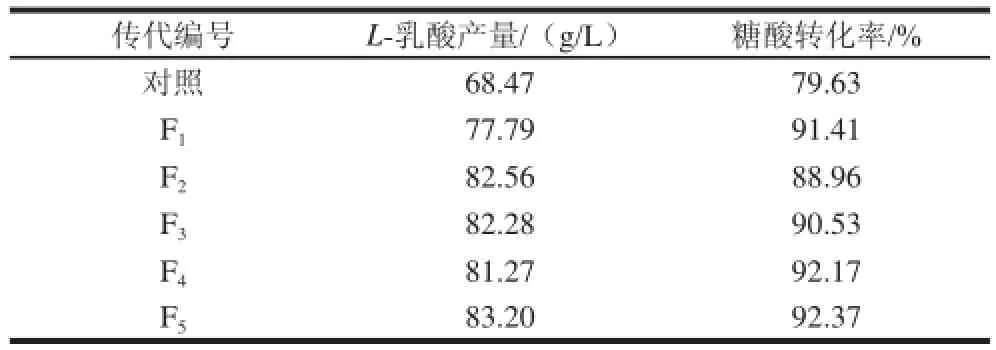
表3 菌株NL-CC-17的发酵稳定性实验Table 3 Fermentation stability of strain NL-CC-17
由表3可知,第一代产酸能力较弱,这是因为第一代菌株的接种液是来自超低温冰箱里保存的种液,活力较差。但是其他几代的乳酸产量基本维持在82 g/L左右。ARTP的诱变机理是采用含有多种化学活性粒子的氦气使DNA等造成遗传物质损伤,微生物启动SOS修复机制进行容错性修复,因此,ARTP多样性的损伤将可能在修复过程中包容于DNA链中并使其稳定的遗传下去[21-23]。基于此,通过等离子体诱变技术获得的凝结芽孢杆菌突变株遗传稳定性较好。与对照相比,突变株最高产量为83.20 g/L,L-乳酸产量较出发菌株提高了21.51%,糖酸转化率提高了16.00%。
2.4 凝结芽孢杆菌木糖发酵性能的研究
2.4.1 木糖质量浓度对菌株NL-CC-17发酵性能的影响

图3 不同木糖质量浓度发酵生产L--乳酸(A)及其残糖(B)随时间的变化Fig.3 Effects of different initial xylose concentrations on L-lactic acid (A) and redidual sugar (B) production
测试诱变筛选后的菌种利用木糖发酵的能力,设置木糖质量浓度分别为60、80、100、120、140、160 g/L,每隔24 h取样,发酵5 d,测定木糖及其L-乳酸的产量并绘制发酵曲线。由图3A、B可知,在木糖质量浓度为100 g/L时,发酵120 h木糖基本被利用完全,L-乳酸产量为81.28 g/L,随着木糖质量浓度的升高,L-乳酸产量降低,发酵受到抑制,分析原因可能为高质量浓度的木糖对菌株细胞的渗透压有影响,从而影响整个代谢过程。
以往文献[24]报道,凝结芽孢杆菌发酵木糖的底物最高耐受质量浓度约为70~80 g/L,与本实验野生型菌株实验结果类似。经过等离子体诱变后,菌株的木糖耐受质量浓度明显提高,可以在100 g/L的底物质量浓度下快速代谢木糖,突变效果良好。突变菌株凝结芽孢杆菌NL-CC-17是目前报道的木糖利用能力最好的菌株。
2.4.2 发酵条件对菌株NL-CC-17的影响
温度和pH值是影响发酵产量的重要条件,凝结芽孢杆菌属于耐热菌,生长温度可达55℃以上,而且其发酵pH值较低。本实验研究了温度在35~60℃、pH值在5.5~7.5范围内的发酵条件对乳酸产量的影响,结果如图4和图5。
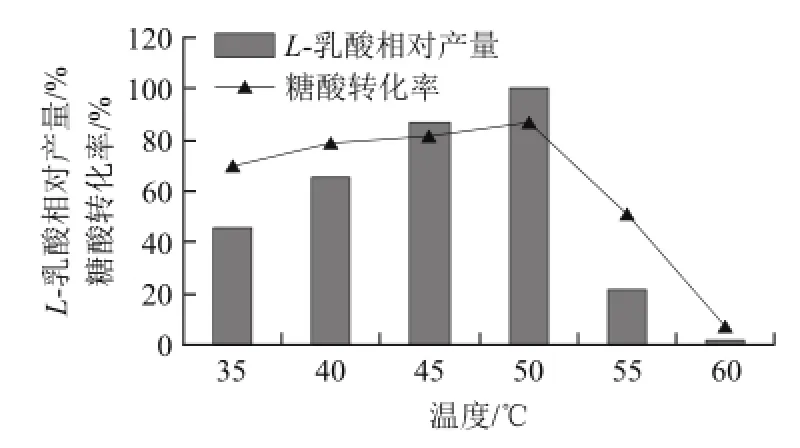
图4 不同温度对L-乳酸发酵的影响Fig.4 Effect of temperature on L--lactic acid production
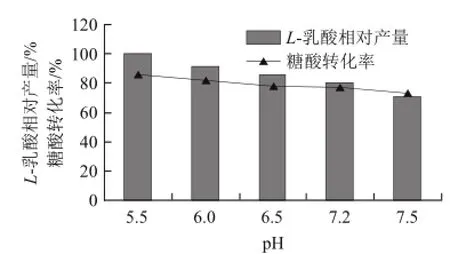
图5 不同起始pHH值对L-乳酸发酵的影响Fig.5 Effect of initial pH on L--lactic acid production
由图4可知,L-乳酸的产量和糖利用率随发酵温度的变化非 常明显,当发酵温度为50℃时,L-乳酸产量和糖利用率均达到最高点,当发酵温度升高到55℃时L-乳酸的产量有明显的降低,只有17.75 g/L。因此,此菌的最适发酵温度为50℃。由图5可知,随着起始pH值的升高,L-乳酸的产量逐步降低,糖酸转化率亦下降,在pH 5.5时L-乳酸产量最高,为73.43 g/L,因此pH 5.5为实验范围内最佳发酵pH值。
3 结 论
本实验针对目前L-乳酸生产菌株在木糖利用上的缺陷,以野生型凝结芽孢杆菌NL01作为出发菌株,采用等离子体诱变育种技术选育出了一株木糖发酵特性优良的L-乳酸高产菌株NL-CC-17,该菌株是目前报道的木糖利用能力最好的菌株。
3.1 凝结芽孢杆菌NL01的木糖临界抑制质量浓度为100 g/L,乳酸钙临界抑制质量浓度为30 g/L。由此确定高糖高酸筛选平板配方中木糖和乳酸钙的质量浓度分别为100 g/L和30 g/L。
3.2 通过等离子体诱变育种技术对凝结芽孢杆菌NL01进行诱变处理,研究了不同注射时间下菌株的存活率,控制离子注入机功率在100 W左右,辐照距离2.5 mm,氦气通量10 L/min,实验结果显示最佳辐照时间为60 s。经木糖发酵测定,L-乳酸产量较出发菌株提高了21.51%,糖酸转化率提高了16.00%。
3.3 通过对木糖发酵实验的初步优化,确定了木糖的最适初始质量浓度为100 g/L,最适发酵温度为50℃,实验范围内最适发酵pH值为5.5。
[1] GAO C, MA C, XU P. Biotechnological routes based on lactic acid production from biomass[J]. Biotechnology Advances, 2011, 29(6): 930-939.
[2] JOHN R P, NAMPOOTHIRI K M, PANDEY A. Fermentative production of lactic acid from biomass: an overview on process developments and future perspectives[J]. Applied Microbiology and Biotechnology, 2007, 74(3): 524-534.
[3] DATTA R, HENRY M. Lactic acid: recent advances in products, processes and technologies: a review[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(7): 1119-1129.
[4] 赵国振, 熊向峰, 陈朝银. 直接乳酸发酵工艺的研究进展[J]. 食品工业科技, 2009, 30(12): 410-413.
[5] PATEL M A, OU M S, HARBRUCKER R, et al. Isolation and characterization of acid-tolerant, thermophilic bacteria for effective fermentation of biomass-derived sugars to lactic acid[J]. Applied and Environmental Microbiology, 2006, 72(5): 3228-3235.
[6] PATEL M, OU M, INGRAM L O, et al. Fermentation of sugar cane bagasse hemicellulose hydrolysate to L(+)-lactic acid by a thermotolerant acidophilic Bacillus sp.[J]. Biotechnol Letters, 2004, 26(11): 865-868.
[7] QIN Jiayang, ZHAO Bo, WANG Xiuwen, et al. Non-sterilized fermentative production of polymer-grade L-lactic acid by a newly isolated thermophilic strain Bacillus sp. 2–6[J]. PLoS ONE, 2009, 4(2): e4359.
[8] WANG Limin, ZHAO Bo, LIU Bo, et al. Efficient production ofL-lactic acid from cassava powder by Lactobacillus rhamnosus[J]. Bioresource Technology, 2010, 101(20): 7895-7901.
[9] OUYANG Jia, MA Rui, ZHENG Zhaojuan, et al. Open fermentative production of L-lactic acid by Bacillus sp. strain NL01 using lignocellulosic hydrolyzates as low-cost raw material[J]. Bioresource Technology, 2013, 135: 475-480.
[10] TANIGUCHI M, TOKUNAGA T, HORIUCHI K, et al. Production of L-lactic acid from a mixture of xylose and glucose by co-cultivation of lactic acid bacteria[J]. Applied Microbiology and Biotechnology, 2004, 66(2): 160-165.
[11] ILMÉN M, KOIVURANTA K, RUOHONEN L, et al. Efficient production of L-lactic acid from xylose by Pichia stipitis[J]. Applied and Environmental Microbiology, 2007, 73(1): 117-123.
[12] 杨英歌, 李文, 柳丹, 等. 氮离子注入选育高效发酵木糖生产L(+)-乳酸的米根霉[J]. 辐射研究与辐射工艺学报, 2007, 25(2): 81-84.
[13] 付晓芬, 江均平, 张杰, 等. 微生物利用木糖发酵L-乳酸代谢途径的研究[J]. 食品工业科技, 2009, 30(8): 359-362.
[14] 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报, 2011, 27(3): 461-467.
[15] WANG L Y, HUANG Z L, LI G, et al. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma[J]. Journal of Applied Microbiology, 2010, 108(3): 851-858.
[16] 金丽华, 方明月, 张翀, 等. 常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J]. 生物工程学报, 2011, 27(3): 461-467.
[17] 赵鑫, 赵良启, 刘春卉, 等. 离子注入L-乳酸产生菌诱变选育研究[J].生物技术, 2004, 14(6): 24-25.
[18] 张晓勇, 陈秀霞. 低能离子诱变育种作用机理及生物学效应研究进展[J]. 广东农业科学, 2008(6): 20-22.
[19] SONG Yun, ZHANG Huaiyu, CHANG Zhijian. Progress of mutation breeding with ion beam implantation[J]. Molecular Plant Breeding, 2004, 2(2): 301-305.
[20] FENG Huiyun, YU Zengliang, CHU P K. Ion implantation of organisms[J]. Materials Science and Engineering, 2006, 54(3/4): 49-120.
[21] 宫春波, 刘鹭, 谢丽源, 等. 离子注入微生物诱变育种研究进展[J].生物技术, 2003, 13(2): 47-49.
[22] YU Long, ZHOU Jian, YU Zengliang. Screening of L-lactic acid producing bacteria by low energy ions implantation and preliminary research of fermentation conditions[J]. 激光生物学报, 2005, 14(3): 184-188.
[23] ZHOU Xiaonan, YE Hui, ZHU Suwen, et al. Screening high-yield bacteria Rhizopus chinensis carrying L-lactic acid by low energy ions implantation[J]. 激光生物学报, 2008, 17(3): 408-411.
[24] WANG Limin, ZHAO Bo, LIU Bo, et al. Efficient production of L-lactic acid from corncob molasses, a waste by-product in xylitol production, by a newly isolated xylose utilizing Bacillus sp. strain[J]. Bioresource Technology, 2010, 101(20): 7908-7915.
Improved Xylose Utilization of Bacillus coagulans by Atmospheric and Room Temperature Plasma Mutation for Production of Lactic Acid
CAI Cong1,2, JIANG Ting2, ZHENG Zhao-juan2, OUYANG Jia1,2,*
(1. College of Forest Resources and Environment, Nanjing Forestry University, Nanjing 210037, China; 2. Jiangsu Key Laboratory of Biomass-based Green Fuels and Chemicals, Nanjing Forestry University, Nanjing 210037, China)
To further enhance the production and yield of converting xylose to L-lactic acid, an atmospheric- and room temperature-plasma (ARTP) mutation system was employed to induce the mutation of Bacillus coag ulans NL01, a wild-type strain for production of L-lactic acid from xylose. A positive mutant, named as NL-CC-17, was obtained through enrichment and screening. Compared with that of previously reported strains, NL-CC-17 had an improved tolerance to xylose. This strain was capable of converting 100 g/L xylose into 82.30 g/L L-lactic acid after being cultured at 50 ℃ for 72 h with a yield of 92.37%. The concentration of L-lactic acid was increased by 21.51% and the yield by 16.00%. After preliminary optimization of fermentation conditions, the optimal fermentation temperature was determined as 50 ℃ and the optimal pH as 5.5.
atmospheric and room temperature plasma (ARTP); Bacillus coagulans; mutation; L-lactic acid; xylose
Q815
A
1002-6630(2014)01-0125-05
10.7506/spkx1002-6630-201401024
2012-11-09
国家自然科学基金项目(31200443);江苏省杰出青年基金项目(BK2012038);国家“863”计划项目(2012AA022301)
蔡聪(1987—),男,硕士研究生,研究方向为发酵工程。E-mail:caicong1987@163.com
*通信作者:欧阳嘉(1972—),女,教授,博士,研究方向为酶与发酵工程。E-mail:hgouyj@njfu.edu.cn
