RNA干扰联合阻断MMS2和REV3基因表达 减轻结肠癌细胞系THC8307/L-OHP对奥沙利铂的耐药性
2014-01-15李元杰
李元杰,张 蕾,隋 御,徐 方*
(宁夏医科大学 1.基础医学院; 2.生育力保持教育部重点实验室, 宁夏 银川 750004)
化疗在中晚期癌症的治疗及预防复发转移中具有十分重要的地位,在临床上,传统的化疗方案被普遍应用于不同种类的癌症治疗中,由于化疗药物缺乏特异性,因而导致临床使用的药物浓度相对较高,往往会对患者机体带来极大的损伤,随着化疗过程的推进,多种药物联合使用,肿瘤细胞的多药耐药(multidrug resistance,MDR)也就随之出现,继而成为制约恶性肿瘤治疗的最大的难题[1]。随着现代医学技术的发展,研究者们期望通过分子生物学手段靶向干预目的基因表达,以此来实现耐药性逆转。国内外研究显示,跨损伤合成途径(translesion DNA Synthesis, TLS)与细胞突变及肿瘤的发生发展密切相关[2],同时与铂类药物耐药的分子机制密切相关[3]。由此,本实验选择了TLS途径的关键基因REV3和MMS2作为目的基因,运用 RNAi 技术下调目的基因在人高分化耐奥沙利铂结肠癌细胞系(THC8307/L-OHP)中的表达,探讨TLS与铂类耐药逆转的关系。
1 材料与方法
1.1 材料
人高分化结肠癌细胞系(THC8307)及人高分化耐奥沙利铂结肠癌细胞系(THC8307/L-OHP)(天津医科大学生命科学中心实验室汤华教授建立并惠赠),携带GFP(绿色荧光蛋白)的实验组质粒pcDNA6.2-GW/EmGFP-miR-REV3, pcDNA6.2-GW/EmGFP-miR-MMS2及阴性质粒pcDNA6.2-GW/EmGFP(上海松正生物公司);注射用奥沙利铂(L-OHP,南京制药厂);LipofectamineTM2000(Invitrogene公司);四甲基偶氮唑蓝 (MTT)(Sigma公司);REV3、MMS2基因引物(上海生工生物工程有限公司);引物序列见表1;MMS2一抗(Abcam 公司)、REV3一抗(Santa Cruz Biotechnology);MMS2二抗(北京中杉金桥生物技术有限公司)、REV3二抗(Jackson公司);四甲基偶氮唑蓝 (MTT)、Annexin V-FITC/PI 凋亡试剂盒、DAPI染色试剂盒(均南京凯基生物科技发展有限公司)。
1.2 方法
1.2.1 细胞培养与分组:THC8307(亲本系)常规培养,THC8307/L-OHP(耐药系)需加入6 μg/mL的奥沙利铂维持其耐药性。取对数生长期的细胞进行转染,按LipofectamineTM2000试剂盒说明书进行操作。实验分3组进行:1)THC8307/L-OHP细胞对照组;2)转染液与阴性对照质粒(pcDNA6.2-GW/EmGFP-miR)混合液;3)REV3和MMS2基因按1∶1混合干扰质粒与转染液混合液。

表1 本研究所用的引物Table 1 Primers used in this study
1.2.2 qRT-PCR:按上述分组处理THC8307/L-OHP细胞后,于 37 ℃,5% CO2条件下培养 24 h 后在荧光倒置显微镜下观察转染情况及细胞形态变化。1 000 r/min离心收集上述各组细胞,PBS洗涤2~3 次后,按总RNA抽提试剂盒说明书操作提取RNA,转录合成cDNA, 随后进行实时荧光定量PCR。MMS2基因PCR的反应条件为:95 ℃ 3 min;93 ℃ 30 s,59 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸 10 min。REV3基因PCR的反应条件为:95 ℃ 3 min,93 ℃ 30 s,60 ℃ 15 s,72 ℃ 1 min,35个循环;72 ℃延伸 10 min。3次实验所得数据通过比较CT 值法(2-△△CT) 进行相对定量分析。
1.2.3 免疫荧光法检测转染后THC8307/L-OHP细胞MMS2蛋白和REV3蛋白表达的变化:细胞转染48 h后,将上述各组细胞爬片于6孔板中,4%多聚甲醛固定细胞10 min,PBS洗3遍,每次5 min,0.5% TritonX-100对细胞透化处理10 min,PBS洗3遍,每次5 min,封闭液封闭30 min,PBS洗3遍,同时加入1∶200兔抗人MMS2抗体和山羊抗人REV3抗体,4 ℃过夜,PBS洗3遍,每次5 min之后加入两基因的荧光二抗(1∶100稀释),37 ℃,孵育1 h,PBS洗3遍,每次5 min,加入0.5μg/mL DAPI染色10 min,PBS洗3遍,在避光条件下,1 h内荧光倒置显微镜拍照分析结果。(REV3基因运用橙红色荧光标记二抗,MMS2基因运用绿色荧光标记二抗)。
1.2.4 MTT法检测转染后THC8307/L-OHP细胞对L-OHP的敏感性:取THC8307及转染24 h后的THC8307/L-OHP各组细胞5×104/mL接种于96孔板中,设终浓度为0.06、0.6、6、60 和600 mg/L药物浓度梯度,100 μL/孔。培养48 h后,按MTT试剂盒操作,在酶联免疫检测仪上测A490值,取5个复孔的平均吸光度(A)值,每组重复3次,根据吸光度报告(A值)计算药物半数抑制率(IC50)、耐药系数(Resistance Index,RI)和相对逆转率。
1.2.5 Rh123单染法检测细胞凋亡:在铺有玻片的6孔板中按4×105个/孔接种THC8307/L-OHP细胞,24 h后按上述分组处理细胞,再培养 24 h 后收获细胞悬液,按试剂盒染色细胞,在荧光倒置显微镜下观察细胞凋亡情况,IPP6.0软件统计分析平均荧光强度。
1.2.6 Annexin V-FITC/PI双染法检测转染后THC8307/L-OHP细胞联合L-OHP的凋亡率:取对数生长期的THC8307/L-OHP细胞,调整浓度至 4×105/ mL,接种于 6 孔板,转染 24 h 后按实验分组设计加入终浓度为60 mg/L L-OHP,置于 37 ℃,5% CO2条件下继续培养16 h后,分别收集各处理组细胞,按操作说明采用AV/PI双染,避光放置10 min,流式细胞仪检测各组细胞凋亡率。
1.3 统计学分析

2 结果
2.1 干扰效能的鉴定
2.1.1MMS2和REV3在细胞中表达的变化:转染含miRNA实验组质粒的THC8307/L-OHP细胞MMS2和REV3的表达量低于空白组和阴性组(P< 0.05)。小RNA干扰片段成功抑制实验组细胞MMS2和REV3基因的表达,而转染试剂对MMS2和REV3基因表达无大影响(图1)。
2.1.2 RNAi基因蛋白水平测定:实验组与两对照组相比,REV3蛋白和MMS2蛋白表达显著降低(P<0.05)(表2),在蛋白水平上证明实验组两基因成功下调(图2)。

表2 各组细胞的平均荧光强度Table2 Mean density of each group(±s, n=3)
*P<0.05 compared with control group.
2.2 下调基因对THC8307/L-OHP细胞耐药性的影响
基因下调组与两对照组比较,RI值明显降低,且相对逆转率明显增高(P<0.05)(表3)。
2.3 基因下调对细胞凋亡的影响
2.3.1 罗丹明123荧光染色:同一视野和曝光率下,各组细胞荧光照片可见空白对照组细胞形态完整,染色均匀;阴性对照组与空白组细胞形态相仿,实验组多为凋亡细胞形态出现残缺,染色不均匀(图3),基因下调组平均荧光强度强于空白组和阴性对照组(P<0.05)(表4)。
2.3.2 流式细胞术分析Annexin V-FITC/PI荧光染色结果:经L-OHP处理16 h后,转染组凋亡率高于空白组和阴性对照组 (图4,表5)。
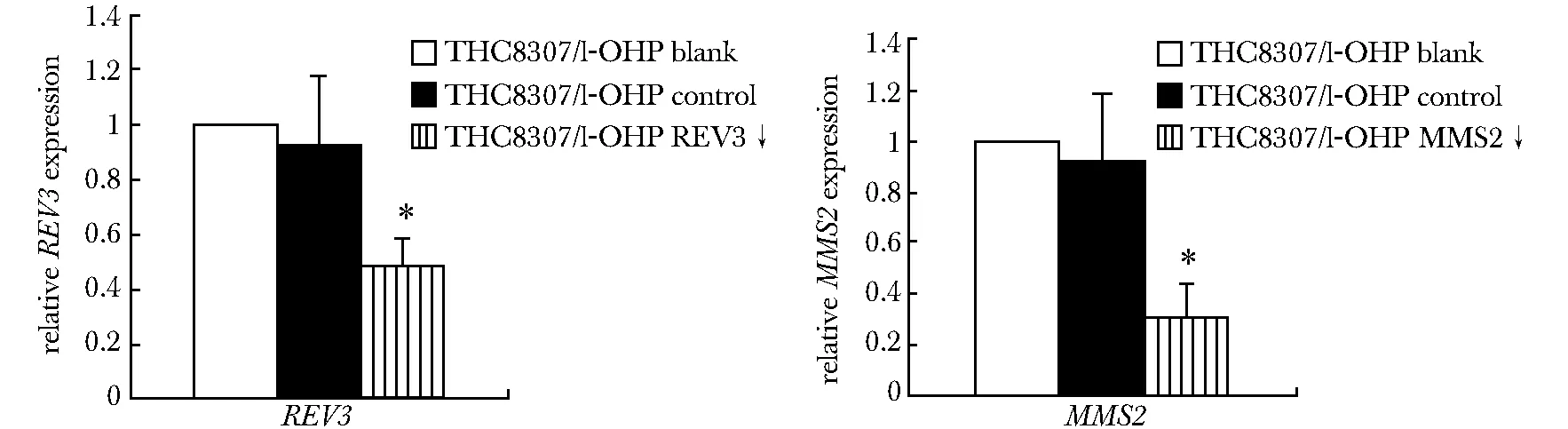
*P<0.05 compared with control groups 图1 实时荧光定量PCR测定基因表达图Fig 1 Gene expression testing by qRT-PCR(±s, n=3)
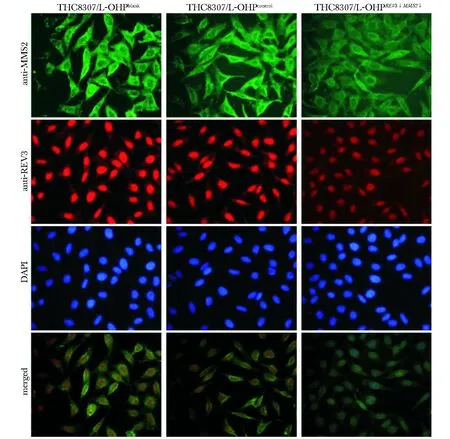
图2 各组细胞的免疫荧光染色Fig 2 Immunofluorescence staining of each group(×400)
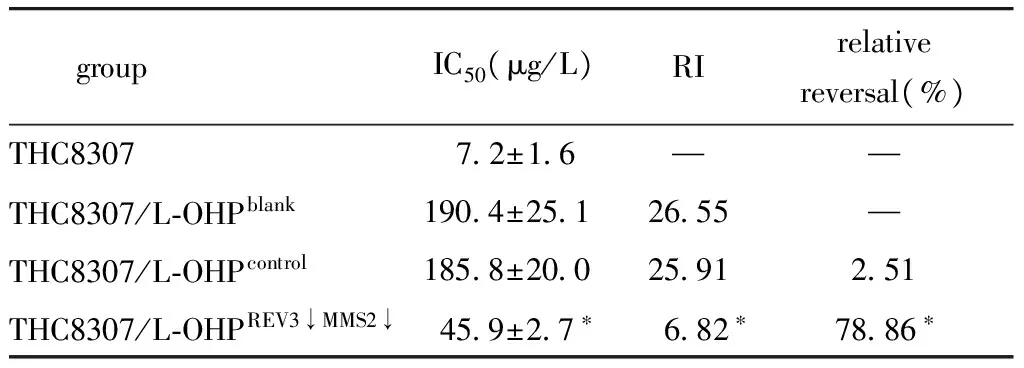
groupIC50(μg/L)RIrelativereversal(%)THC830772±16——THC8307/L⁃OHPblank1904±2512655—THC8307/L⁃OHPcontrol1858±2002591251THC8307/L⁃OHPREV3↓MMS2↓459±27∗682∗7886∗
*P<0.05 compared with control group.

表4 各组细胞的平均荧光强度Table 4 Mean density of each group(±s,%,n=3)
*P<0.05 compared with control group.
3 讨论
结肠癌作为一种多基因遗传病,其发生发展是多基因参与的多步骤复杂过程,针对单一基因的治疗往往无法达到预期疗效,多靶点联合沉默肿瘤相关基因的治疗思路可能更具发展潜力[4]。以往的研究已证实跨损伤DNA合成途径,尤其是DNA pol-ζ,其作为去除DNA交连损伤的关键,成为肿瘤细胞耐药性产生的分子基础[5- 6],也是铂类药物产生耐药性的关键。因此,通过抑制 DNA 聚合酶ζ,或者跨损伤修复途径中的关键基因,将会增加肿瘤细胞对于铂类化疗药物的敏感性[3]。国内外研究学者通过单一阻断REV3基因,或者联合阻断REV3基因与P53基因,证实REV3基因可逆转卵巢癌、肺癌等多种肿瘤耐药细胞的耐药性[7- 8]。本实验前期体外实验也证明单一下调REV3基因的表达,可以反转人结肠癌细胞的耐药性并促进肿瘤细胞凋亡[9],但是同时阻断跨损伤修复途径中无误性修复通路与易误性修复通路中的关键基因是否也能产生此效应,尚未见到报道。
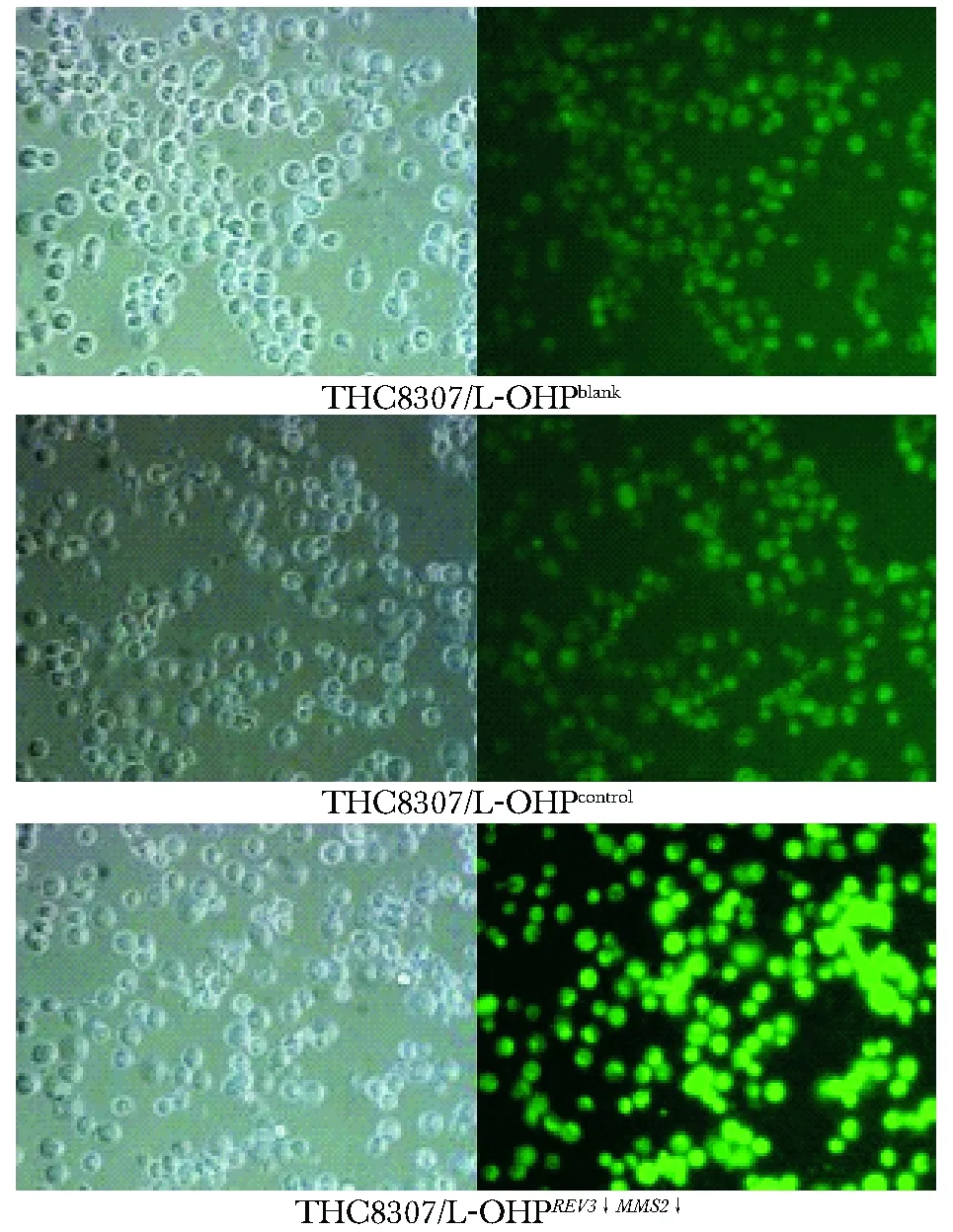
图3 Rh123荧光显微镜图Fig 3 Rh123 testing by fluorescence microscope(×400)
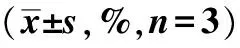
表5 流式细胞术测定细胞凋亡率
*P<0.05 compared with control group.
REV3基因编码跨损伤修复途径易误性通路中DNA聚合酶ζ的催化亚基,MMS2基因是无误性通路的关键基因,本研究运用RNAi技术联合降低了人耐药结肠癌细胞中跨损伤修复的关键基因,采用MTT方法评价其对L-OHP的敏感性变化,与对照组相比,L-OHP对实验组细胞的IC50显著降低,表明联合下调REV3和MMS2基因可以增加THC8307/L-OHP细胞对L-OHP的敏感度。进一步研究发现,在相同L-OHP作用下,REV3和MMS2基因表达受抑制后,可以促进结肠癌耐药细胞的自发凋亡,结果提示由TLS介导的肿瘤细胞耐药过程中可能有凋亡机制的参与,这与TLS与P53凋亡通路密切相关的报道一致[10]。从上述实验结果可以看出,联合阻断REV3和MMS2基因的表达,可以逆转耐药结肠癌细胞的耐药性,在一定程度上恢复了耐药细胞对铂类药物的敏感性,从而进一步证实了TLS与逆转肿瘤细胞对铂类药物敏感性存在一定的因果关系[11]。

图4 流式细胞术检测下调基因对给予L-OHP处理的THC8307/L-OHP细胞凋亡的影响Fig 4 The effect of gene intefering on apoptosis of THC8307/L-OHP cells detected by flow-cytometric
[1] 王小文,吕端. 阻断MDR1基因表达逆转结肠癌LoVo/5-Fu敏感性的研究[J]. 免疫学杂志,2012,28:1099- 1102.
[2] Xiao W, Lechler T, Chow BL,etal. Identification,chromosomal mapping and tissue-specific expression of hREV3 encoding a putative human DNA polymerase zeta[J]. Carcinogenesis,1998,19:945- 949.
[3] 张舒羽,王慧博,卢大儒. 跨损伤DNA合成通路在肿瘤发生中的作用及其与化疗敏感性的关系[J].癌变畸变突变,2009,21:243- 245.
[4] Kim MP, Gallick GE.Gemcitabine resistance in pancreatic cancer: picking the key players [J].Clin Cancer Res,2008,14:1284- 1285.
[5] Shen X, Jun S, O’Neal LE,etal. REV3 and REV1 play major roles in recombination-independent repair of DNA interstrand Cross-links mediated by Monoubiquitinated proliferating cell nuclear antigen (PCNA) [J]. J Biol Chem,2006,281:13869- 13872.
[6] Nojima K,Hochegger H,Saberi A,etal. Multiple repair pathways mediate tolerance to chemotherapeutic cross-linking agents in vertebrate cells [J].Cancer Res,2005,65:11705- 11711.
[7] Lin X, Trang J, Okuda T,etal. DNA polymerase zeta accounts for the reduced cytotoxicity and enhanced mutagenicity of cisplatin in human colon carcinoma cells that have lost DNA mismatch repair [J]. Clin Cancer Res, 2006, 12: 563- 568.
[8] Doles J, Oliver TG, Cameron ER,etal. Suppression of REV3, the catalytic subunit of Polζ, sensitizes drug-resistant lung tumors to chemotherapy[J].Proc Natl Acad Sci, 2010,107:20786- 20791.
[9] 李利坚,隋御,周翔,等.干扰REV3L基因表达逆转结肠癌的耐药性[J]基础医学与临床,2013,33:542- 547.
[10] Knobel PA, Kotov IN, Felley-Bosco E,etal. Inhibition of REV3 expression Induces persistent DNA damage and growth arrest in cancer cells [J]. Neoplasia,2011, 13: 961- 970.
[11] Sharma S, Shah NA, Joiner AM,etal. DNA polymerase ζ is a major determinant of resistance to platinum-based chemotherapeutic agents [J].Mol Pharmacol,2012,81: 778- 787.
