活性氧介导铁过载对正常及辐射损伤小鼠骨髓间充质干细胞的影响
2014-01-15张宇辰李德冠孟爱民孟娟霞赵明峰
张宇辰,李德冠,孟爱民,柴 笑,孟娟霞,赵明峰*
(1.天津医科大学 一中心临床学院 天津市第一中心医院 血液科,天津 300192; 2.中国医学科学院 放射医学研究所 放射医学与分子核医学天津市重点实验室, 天津 300192)
铁是人体必需的微量元素之一,但在体内过度沉积可导致重要脏器(如心脏、肝脏、肾脏及内分泌系统)的结构损害和功能障碍。临床上铁过载分为原发性和继发性两类[1]。铁过载可以介导ROS升高影响骨髓造血干祖细胞功能从而抑制造血,某些继发性铁过载患者(骨髓纤维化、再生障碍性贫血、MDS)在持续祛铁治疗后,出现输血次数减少或脱离输血,病情明显好转[2- 7]。铁过载还可通过抑制骨质成熟及成骨细胞钙结节形成引起骨损害,某些β-地中海贫血的患者在发生铁过载后可出现明显的骨成熟障碍及骨软化症[8]。
间充质干细胞(mesenchymal stem cell,MSCs)作为骨髓造血微环境的重要组成部分,具有干细胞特性及多向分化能力,同时可分泌多种细胞因子支持和调节造血功能。最新体外研究发现,铁过载通过提高MSCs内的ROS水平抑制其增殖、诱导其凋亡,从而降低其造血支持能力[9]。本研究主要目的为探索铁过载对骨髓造血微环境的影响,为今后继发性铁过载患者的治疗提供新的方向及靶点。
1 材料与方法
1.1 主要试剂
右旋糖酐铁注射液(科莫非)(Pharmacocmos公司),胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶(Gibco公司),α-MEM培养基及成脂诱导培养基(Hyclone公司),钙荧光素乙酰氧基甲酯(Calcein-AM)、碱性磷酸酶试剂盒(ALP kit)(Sigma公司),CCK8试剂盒(上海贝博生物技术公司),ROS检测试剂盒(上海碧云天生物技术公司)。成骨基因引物(ALP、OSN、RUNX2)(上海生工生物有限公司)。RNA提取试剂盒、反转录试剂盒及real-time PCR试剂盒(北京百泰科技有限公司)。
1.2 实验动物
C57BL/6纯系SPF级小鼠,雄性,6~8周龄,体质量在18~20 g之间,(北京华阜康生物科技有限公司)。
1.3 铁过载及病态骨髓铁过载模型建立
利用随机区组设计,将40只小鼠分为对照组(control)、铁剂组(Fe)(25 g/L)、照射组(4 Gy)及照射加铁剂组(IR+Fe)(4 Gy照射加25 g/L铁剂注射)。Ctrl组小鼠给予腹腔注射0.9%氯化钠注射液0.2 mL/次,Fe组小鼠给予腹腔注射右旋糖酐铁0.2 mL/次,IR组及IR+Fe组小鼠首先给予4 Gy伽马射线照射,之后IR组小鼠给予腹腔注射0.9%氯化钠注射液0.2 mL/次,IR+Fe组小鼠给予腹腔注射右旋糖酐铁0.2 mL/次,每3天注射1次,共注射4周。
1.4 MSCs的分离及原代培养
脱颈处死小鼠,根据文献[10]从密质骨中分离培养MSCs,细胞汇合80%时,弃去培养液,加入3 mL 0. 25% 胰蛋白酶+0.02% EDTA(37 ℃) 消化,进行下一步实验及指标检测。
1.5 MSCs铁过载鉴定
调整P0代MSCs细胞浓度为1×106/mL,将细胞悬液混匀取100 μL,甩片固定,普鲁士蓝铁染色,观察细胞内铁颗粒。利用不稳定铁(LIP)可以淬灭钙荧光素乙酰氧基甲酯(calcein-acetoxymethylester,calcein-AM) 的原理检测MSCs内的LIP水平。将原代细胞用PBS洗涤2次后重悬细胞于PBS中,加入calcein-AM,使其终浓度为0. 125 μmol /L,37 ℃避光温育15 min,用PBS 洗涤2 次后,采用流式细胞仪检测细胞的平均荧光强度值(mean fluorescence intensity,MFI)。
1.6 MSCs增殖能力检测
群体倍增时间:将MSCs传至P1代,取对数增殖期细胞,以1×105/孔的密度接种于6孔板中,每组设立3个复孔,在37 ℃温箱中培养,当细胞达到80%~90% 汇合时,用胰蛋白酶消化计数。按以下公式计算MSCs 的倍增时间(doubling time,DT):DT=CT×log2/log(X1/X0),其中X0是细胞最初的数量,X1是细胞最终的数量,CT是细胞培养时间。
根据CCK8试剂盒说明书进行检测步骤:将细胞以2.5×104个/孔为最大浓度,半量稀释为4个浓度梯度,种于96孔板中,每孔200 μL细胞溶液,48 h后,每孔加8 μLCCK8试剂,37 ℃孵育3 h后利用分光光度仪检测A值。
1.7 MSCs的成脂诱导及鉴定
将原代MSC以2×104/孔接种于24孔板中,待细胞增殖至板底70%~80%汇合时,更换为成脂诱导完全分化培养基,按照说明书进行诱导,细胞在培养过程中无需传代,15 d后进行油红-O染色鉴定。
1.8 MSCs的成骨诱导及鉴定
1.8.1 MSCs的成骨诱导:将原代以5×104/孔接种于24孔板中,待细胞增殖至板底70%~80%汇合时,更换为成骨细胞诱导剂(10%胎牛血清、8~10 mol/L的地塞米松、50 μmol/L的抗坏血酸磷酸盐、10 μg/mL胰岛素、10 mmol/L β-磷酸甘油、1%的双抗)。每周换液2次,14 d后检测碱性磷酸酶(alkaline phosphatase,ALP)活性并进行ALP染色,按试剂盒说明书操作,进行定量分析。继续诱导2周,茜素红染色检测细胞钙化能力。
1.8.2 MSCs成骨相关基因表达量的检测: 将各组原代MSCs用胰蛋白酶消化,根据试剂盒说明书提取RNA、反转录为cDNA、利用real-timePCR测定成骨相关基因的表达。根据公式:改变倍数=2-ΔΔT,ΔT=实验组(目的基因-管家基因)-对照组(目的基因-管家基因),其中管家基因为β-actin,计算基因的相对表达量。
1.9 ROS的测定
2′,7′-二氯荧光黄双乙酸盐(dichlorofluorescindiacetate,DCFH-DA) 为非荧光脂类可渗透性成分,能被细胞内的ROS 氧化生成非渗透性荧光成分DCF,故DCF 的荧光强度与细胞内ROS水平成正比。检测细胞内ROS:收集1×106个细胞,用PBS洗涤后,重悬细胞于PBS中,加入10 mmol/L的DCFH-DA,使其终浓度为1 μmol/L,在37 ℃避光温育20 min,用PBS洗涤3次,重悬于PBS中,流式细胞仪检测荧光强度。
1.10 统计学分析
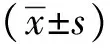
2 结果
2.1 MSCs原代培养的形态
在培养48 h后可见类圆形细胞从骨片中爬出,呈贴壁状态。继续培养24h后可见更多细胞爬出环绕骨片,培养72 h后,可见有集落形成,细胞变长呈梭形。培养7 d后,细胞汇合80%(图1)。
2.2 MSCs铁过载的鉴定
铁剂组、照射加铁剂组细胞内存在大量铁颗粒,对照组及照射组细胞内几乎无铁颗粒(图2)。铁剂组MFI明显低于对照组,照射加铁剂组MFI低于照射组(P<0.05)(图3)。
2.3 铁过载抑制MSCs的增殖
铁剂组倍增时间(1.74±0.36 d)长于对照组(1.03±0.17)d(P<0.05),照射加铁剂组倍增时间(4.92±0.25)d低于照射组(2.80±0.19)d(P<0.05)。此外,不同浓度梯度下各组细胞增殖情况不同,铁剂组与对照组比较,照射加铁剂组与照射组比较增殖能力有所下降(表1)。

A.at 3 day after initial culture(×100); B.at 7 day after initial culture(×40); C.at 7 day after initial culture(×100) 图1 密质骨分离的间充质干细胞形态Fig 1 Morphological features of compact bone-derived mouse mesenchymal stem cells

A.control group; B.iron treated group; C.IR group; D.IR and iron treated group 图2 MSCs细胞甩片铁颗粒染色Fig 2 Microscopic photographs of MSCs stained with Prussian blue(×1 000)

group25×104个/孔125×104个/孔075×104个/孔03725×104个/孔control1225±00281093±00380731±00260428±0047Fe1008±0066∗0793±0047∗0487±0038∗0357±0029IR0795±0037∗0637±0035∗0433±0029∗0374±0076IR+Fe0767±0018∗#0596±0049∗#0428±0031∗0342±0036
*P<0.05 compared with control group;#P<0.05 compared with IR group.
2.4 铁过载对MSCs成脂油红-O染色的影响
成脂诱导14 d后,油红-O染色可发现铁剂组及照射加铁剂组脂滴明显多于对照组及照射组(图4)。
2.5 铁过载抑制MSCs向成骨细胞分化
MSCs成骨诱导14 d时进行ALP染色(图5),铁剂组及照射加铁剂组细胞增殖能力明显低于对照组及照射组;各组ALP活力不同,铁剂组ALP积分低于对照组(P<0.05)(图6)。诱导4周后,进行茜素红染色可发现铁剂组及照射加铁剂组钙结节明显少于对照组和照射组(P<0.05)(图7)。
2.6 铁过载抑制成骨相关基因表达
铁剂组RUNX2表达量与对照组相比降低, 照射加铁剂组与照射组相比表达量下降(P<0.01);铁剂组ALP表达量与对照组相比降低(P<0.01),

*P<0.05 compared with control group; #P<0.05 compared with IR group图3 MSCs细胞内可变铁池的平均荧光强度Fig 3 Calcein fluorescence on the MSCs(±s,n=3)

A.control group; B.iron treated group; C.IR group; D.IR and iron treated group 图4 间充质干细胞成脂诱导油红O染色Fig 4 Oil red-O stainning of BM-MSCs induced adipocytes in each group (×400)

A.control group; B.iron treated group; C.IR group; D.IR and iron treated group 图5 成骨细胞ALP染色照片Fig 5 Microscopic photographs of osteoblast stained with ALP (×400)
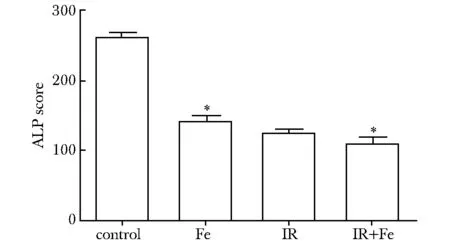
*P<0.05 compared with control group图6 各组成骨诱导细胞内ALP积分Fig 6 ALP score of BM-BSCs induced osteoblasts
照射加铁剂组与照射组相比表达量下降(P>0.05);铁剂组OSN表达量与对照组比较增加(P<0.01)(图8)。
2.7 铁过载引起ROS升高
铁剂组ROS水平高于对照组(P<0.01);照射加铁剂组ROS水平明显高于照射组(P<0.05)(图9)。

A.control group; B.iron treated group; C.IR group; D.IR and iron treated group图7 成骨诱导4周后各组茜素红染色Fig 7 Evaluate mineralized nodule by alizarin red S staining after 4 weeks osteogenesis induction (×100)
3 讨论
铁过载(血色病),主要原因为铁在体内过度沉积引起,导致重要脏器(尤其是心脏、肝脏、垂体、 胰腺和关节)的结构损害和功能障碍。可见于遗传性血色病等遗传因素及红系无效造血、长期输血等继发因素造成的机体内铁吸收过多及代谢障碍。铁过载发生时,过量的铁颗粒主要沉积于造血微环境。MSCs是造血微环境的重要组成部分,它通过与造血细胞直接接触、分泌细胞外基质和细胞因子及向成骨细胞、成软骨细胞及脂肪细胞分化调控造血,其结构和功能的完整性对于保持机体正常造血功能具有重要意义。其中, 成骨细胞是构建造血微环境的重要成分并维持其结构的稳定性[8]。

*P<0.01 compared with control group; #P<0.01 compared with IR group 图8 铁过载抑制成骨基因ALP及RUNX2的表达,并可引起成骨基因OSN表达升高Fig 8 Iron overload inhibited ALP and RUNX2 expression and increased OSN expression(±s,n=3)

*P<0.01 compared with control group; #P<0.05 compared with IR group图9 ROS的平均荧光强度(MFI) Fig 9 Mean fluorescence intensity of ROS
根据密质骨及其骨内膜富含MSCs并可短期获得大量这一特性,在本次实验从密质骨中提取MSCs,并成功建立小鼠骨髓MSCs铁过载模型。铁过载可以通过介导ROS升高而损伤人骨髓及脐带MSCs[9]。在小鼠正常及辐射损伤骨髓MSCs铁过载模型下,铁剂组及照射加铁剂组MSC增殖能力明显下降,同时铁过载可以抑制小鼠骨髓MSCs向成骨细胞分化。其主要机制可能为胞质内聚集的大量自由铁能转运到线粒体,通过Fenton反应Haber-Weiss 途径催化生成大量ROS[11],ROS不仅引起造血干细胞衰老[12]还可以抑制MSCs增殖及成骨分化过程中成骨基因ALP及RUNX2表达及细胞内钙结节的形成[13- 14], ALP是骨质钙化、矿化必需的因子,RUNX2是骨形成蛋白(BMP)信号通路中的关键转录因子。其机制可能是由于ROS下调细胞内FoxO1的表达,FoxO1在氧化还原平衡及骨形成过程中起到重要作用[15]。
综上所述,铁过载可以通过升高细胞ROS水平,抑制小鼠骨髓MSCs增殖、降低其向成骨细胞分化的能力,从而损伤骨髓造血微环境,损伤骨髓造血功能,并间接造成骨损害。
[1] 中华医学会血液学分会. 铁过载诊断与治疗的中国专家共识[J].中华血液学杂志,2011,32: 572- 574.
[2] 柴笑,赵明峰,铁过载在血液系统疾病中的危害和治疗和进展[J].中华内科杂志,2013,52:431- 433.
[3] Zhao MF,Xie F,Li YM,etal. Increased intracellular concentration of reactive oxygen species mediated the deficient hematopoiesis of iron overload bone marrow[J]. Blood(ASH Annual Meeting Abstract),2010,116: 4247a.
[4] 谢芳,赵明峰,李玉明,等. 铁过载诱导活性氧物质生成对骨髓造血功能影响的体外实验研究[J].中华血液学杂志,2011,32: 606- 609.
[5] 谢芳,赵明峰,朱海波,等. 铁过载骨髓造血细胞体外模型的建立及其对造血的影响[J].中国实验血液学杂志,2011,19: 1038- 1042.
[6] 谢芳,赵明峰,朱海波,等. 氧化应激对铁过载造血干祖细胞造血功能的影响[J].中华医学杂志,2011,91: 3284- 3288.
[7] Taoka K,Kumano K,Nakamura F,etal. The effect of iron overload and chelation on erythroid differentiation[J].Int J Hematol,2012,95: 149- 159.
[8] Perisano C, Marzetti E, Spinelli MS,etal. Physiopathology of Bone Modifications in β-Thalassemia[J].Anemia,2012,2012:320737.
[9] Lu WY,Zhao MF, Rajbhandary S,etal. Free iron catalyzes oxidative damage to hematopoietic cells/mesenchymal stem cellsinvitroand suppresses hematopoiesis in iron overload patients[J]. Eur J Haematol, 2013,91:249- 261.
[10] Zhu H,Guo ZK, Jiang XX,etal. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone[J].Nat Protoc,2010,5:550- 560.
[11] Ko E,IJee KY,Hwang DS.Human umbilical cord blood-Derived mesenchymal stem cells undergo cellular senescence in response to oxidative stress[J].Stem Cells Dev,2012,20:1877- 1886.
[12] 张先平,张贵海,陈斌,等. 氧化低密度脂蛋白通过氧化应激诱导小鼠造血干细胞衰老[J].基础医学与临床,2013,33:172- 178.
[13] Kanda Y,Hinata T,Kang SW,etal. Reactive oxygen species mediate adipocyte differentiation in mesenchymal stem cells[J].Life Sci,2011,89:250- 258.
[14] Suh KS, Rhee SY, Jung WW,etal. Chrysanthemum zawadskii extract protects osteoblastic cells from highly reducing sugar-induced oxidative damage[J].Int J Mol Med, 2013, 32:241- 250.
[15] Kim KM, Park SJ, Jung SH,etal. miR- 182 is a negative regulator of osteoblast proliferation, differentiation, and skeletogenesis through targeting FoxO1[J].Bone Miner Res, 2012,27:1669- 1679.
