赤霉素萃余液降解微生物的分离筛选及其降解COD的研究
2014-01-14张金儿刘义雄毛玉华朱江萍叶晓斌涂国全
张金儿,刘义雄,毛玉华,朱江萍,叶晓斌,肖 芳,涂国全
(江西新瑞丰生化有限公司,江西 新干331307)
赤霉素是植物五大激素之一,主要由藤仓赤霉菌及其变种通过液体深层有氧发酵而得。赤霉素萃余液是赤霉素浓缩液经溶媒萃取后的高浓度有机废液,具有显著的“三高”特点:高酸性(pH值≤2.2)、高盐(盐浓度≥10%)、超高有机浓度(≥100 000mg·L-1),一般菌在此废液中难以存活[1]。
利用酵母菌和乳酸菌混合发酵降解赤霉素萃余液中COD的技术路线初步可行[1],但降解效果并不理想。作者在此通过富集培养筛选得到“三耐”(耐酸、耐盐、耐高浓度有机物)的高效降解赤霉素萃余液的不同类型的微生物(菌或菌群),并通过不同类型微生物的科学配伍进行免蒸静止连续发酵,对赤霉素萃余液进行高效降解,拟为抗生素发酵萃余液的处理开辟新途径,具有重要的理论研究和实际应用价值。
1 实验
1.1 材料
赤霉素萃余液,江西新瑞丰生化有限公司;xm#菌,江西农业大学生物工程学院。
1.2 方法
1.2.1 定向富集培养分离筛选流程(图1)
1.2.2 土样采集
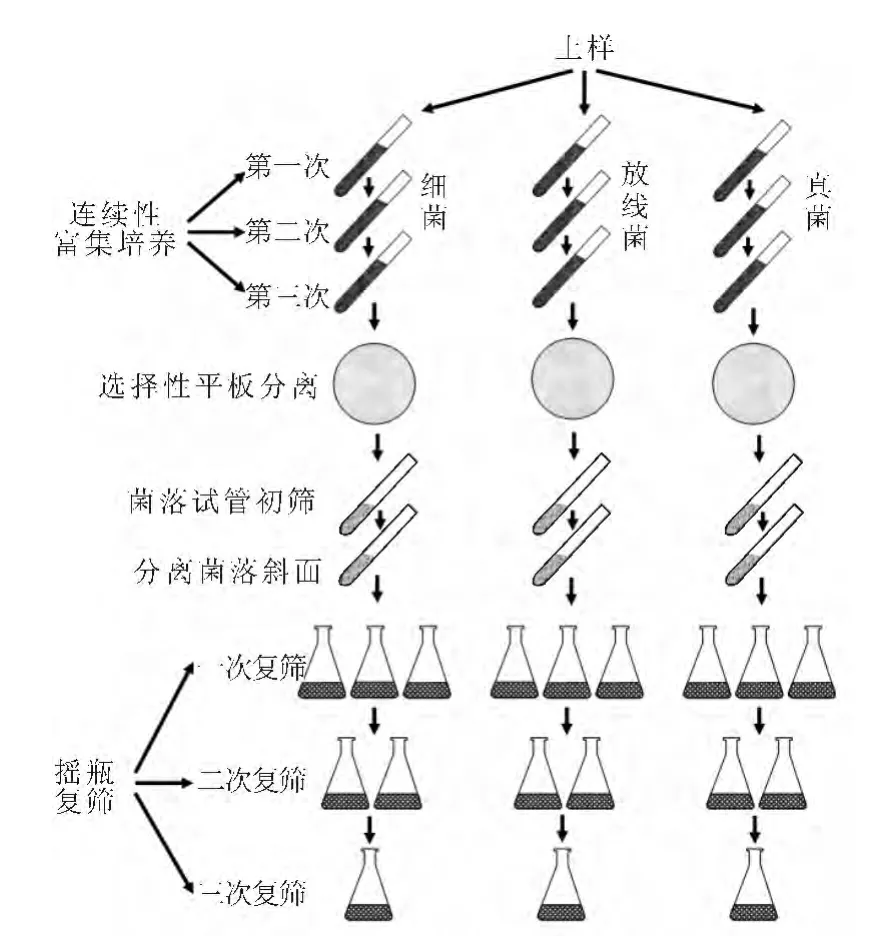
图1 定向富集培养分离筛选流程Fig.1 Process of redirect enrichment,isolation and screening
分别从长期堆放赤霉素发酵液滤渣场地、稻田、环保污泥、小便池及营养丰富的土壤等地深20cm处取土壤500g左右,装于牛皮纸信封或塑料袋中,记录土样来源并编号。将采集的土样于37℃培养烘干,然后用木棒将烘干土样压成粉末,备用。
1.2.3 不同pH值赤霉素萃余液的制备与分装
取赤霉素萃余液3份,缓慢加入6mol·L-1NaOH溶液,分别调pH值为5.0、6.0和7.0,等量分装于若干小试管中。
1.2.4 富集培养
1)第一次富集培养
每次做20个土样。每个土样取1g左右放入上述试管内,用棉塞塞试管口。其中pH值5.0、6.0、7.0各接种3支,分别置于20℃、28℃和37℃温箱中培养4~6d后观察培养液的颜色并检测pH值。以不接种土样为对照。分别对颜色和pH值变化显著的富集管取样涂片进行显微观察,以确定培养液中是否有微生物并初步确定是细菌、放线菌、霉菌还是酵母菌。将颜色和pH值无明显变化的富集管弃去。
2)第二次富集培养
分别取第一次富集培养中确定有微生物的富集液接种于对应的pH值培养液中,在对应的培养温度下进行第二次富集培养,3~4d后观察培养液的颜色、检测pH值,并进行镜检。
3)第三次富集培养
取第二次富集液同法进行第三次富集培养。
1.2.5 分离
1)稀释平板分离
将第三次富集培养液中经镜检有菌的试管用10倍稀释法稀释到适当的浓度后接种到对应的pH值平板分离培养基上,摇匀后置于对应的温度下培养至肉眼可见单菌落。
2)单菌落斜面或液体管的培养
将细菌、放线菌、酵母菌或霉菌的单菌落分别接种至对应的pH值斜面培养基上,编号并置于对应的温度下培养至菌苔丰满后,置于4℃冰箱中保藏备用。
1.2.6 筛选
在250mL三角瓶中分别装入pH值为5.0、6.0、7.0的赤霉素萃余液100mL,进行高效菌株的初筛和复筛。
1)初筛
每个菌落斜面接种一瓶,置于相应的温度下静止培养5~8d后观察培养液的颜色变化,闻气味,检测培养前后的pH值、COD值和固含量。选取pH值、COD值变化较大的菌株为初筛入选菌株,弃去pH值、COD值变化不大的菌株。
2)复筛
将每株初筛入选菌接种3瓶,筛选方法与初筛相同。选取pH值变化大、COD值下降率达到40%以上的菌株为复筛入选菌株。分别将复筛入选菌株进行扩培和菌种保藏,以便进行菌株间的科学配伍和赤霉素萃余液COD降解工艺研究。
1.2.7 免蒸静止连续发酵
1)小试
在250mL三角瓶中装入pH值为6.0的赤霉素萃余液100mL,按10%~15%的接种量分别接入筛选所得单株高效菌或配伍菌,在28~32℃发酵,从41h开始取样检测COD值、固含量和pH值。
2)中试
在100L发酵罐中加入80LpH值为6.0左右的赤霉素萃余液,在28~32℃发酵,接种后2d内少量通气,2d后停止通气,每天搅拌3~4次,每次10 min。接种量和检测项目与小试相同。
1.2.8 分析检测
颜色:目测。
pH值:采用pH酸度计测定。
菌体形态:涂片染色,在普通光学显微镜下观察。
固含量:采用离心沉淀法测定,于4 000r·min-1离心10min,按下式计算固含量:

COD值:于4 000r·min-1离心10min,取上清液测定[2]。
2 结果与讨论
2.1 菌株分离筛选结果
对近200个土样进行富集培养、平板分离及摇瓶初筛及复筛,共获得多株“三耐”高效分解赤霉素萃余液的不同类型的菌株。几株高效菌复筛过程中的培养温度、培养时间及发酵前后培养液颜色、pH值、COD值见表1,显微照片见图1。
从表1可知:几株高效菌的单一降解效果可达42.55%~49.46%;发酵后pH值均有所回升,6#菌升到7.0以上,而7#、8#菌都升到8.0以上。
从图1可知,除8#地衣为细菌外,其它3株菌均为酵母菌。
2.2 免蒸静止连续发酵小试结果
对3株高效菌(6#、8#、xm#)和相互配伍菌进行赤霉素萃余液免蒸静止连续发酵降解COD小试实验,结果见表2。
从表2可知:单一菌的降解效果不及配伍菌;以8#地衣单一菌接种发酵时,其COD下降率不到50%;但和6#酵母及xm#酵母配伍时,COD下降率升高到60%以上,降解效果明显改善。这可能是因为,起始pH值偏低,地衣繁殖慢;而配伍后,由于酵母菌大量繁殖产生乙醇致使pH值上升促进了地衣的繁殖,配伍菌随之大量生长繁殖,改善了降解效果,COD下降率达60%以上。

表1 几株赤霉素萃余液高效降解菌摇瓶复筛结果Tab.1 The shake flask screening results of high-efficient gibberellins raffinate-degrading bacteria

图1 几株赤霉素萃余液高效降解菌的显微照片(×1600)Fig.1 The micrographs of high-efficient gibberellins raffinate-degrading bacteria(×1600)

表2 高效菌的免蒸静止连续发酵降解COD小试结果Tab.2 The degradation rate of COD of free autoclaved static continuous fermentation results for high-efficient bacteria
2.3 免蒸静止连续发酵中试结果
对xm#+6#+8#配伍菌的赤霉素萃余液进行100L罐免蒸静止连续发酵降解COD中试实验,结果见表3。
从表3可知,100L罐中试实验的COD降解效果能重现小试水平,COD下降率达到60%以上;pH值和固含量都是先降后升再缓慢下降。
3 结论
(1)通过定向富集培养、分离筛选,获得多株“三耐”高效降解赤霉素萃余液COD的酵母菌和细菌,利用酵母菌和细菌的协同作用,且不需另外添加饴糖等碳源,萃余液COD降解率达到60%以上。
(2)采用定向富集培养、分离筛选所得高效菌混合发酵,COD一次降解率比单一菌的降解率提高10%左右,但仍不能达标排放。要使COD值继续降低,可对高效菌用目标废液进行定向逐步驯化,进一步提高高效菌的降解能力,最终达标排放。
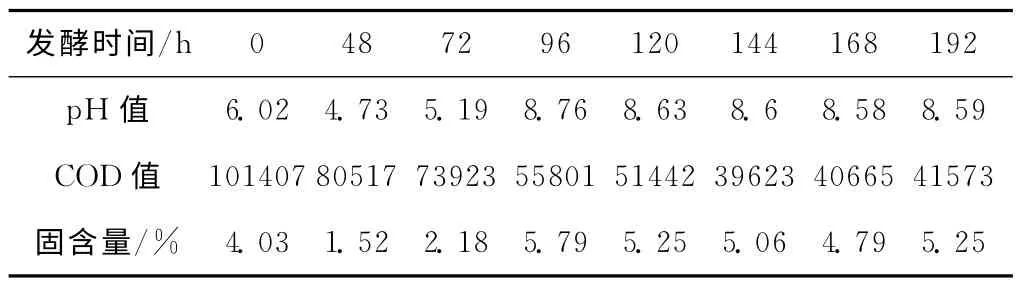
表3 配伍菌100L罐的免蒸静止连续发酵实验结果Tab.3 Free autoclaved static continuous fermentation results of compatibility of high-efficient bacteria in 100Lfermentor
[1]刘义雄,张文宣,徐勇,等.利用微生物混合静止发酵降低赤霉素萃余液中COD含量[J].农药,2013,52(9):647-649.
[2]GB 11914-89,水质化学需氧量的测定——重铬酸盐法[S].
