铑催化芳酮脱羰基合成联芳基化合物
2014-01-14左苏京唐向阳
左苏京,唐向阳
(天津大学理学院,天津300072)
联芳基化合物是天然产物、合成药物、有机功能材料领域的重要合成砌块[1-2],在过去的几十年里,研究者利用过渡金属催化发展了一系列合成该类物质的方法,比如通过过渡金属钯催化芳卤化合物和苯硼酸偶联反应(Suzuki coupling reaction)[3-5]来合成。最近,施章杰课题组发展了铑催化芳酮类化合物脱羰基合成联芳基化合物,但该方法会产生少量的碳氢键活化副产物[6]。作者在此以含氮杂环为导向基[7-8],由过渡金属铑络合物[Rh(cod)Cl]2催化芳酮的羰基α-碳碳单键断裂合成了未见报道的联芳基化合物2-(2′,4′-二氯[1,1′-联苯]-2-基)吡啶(Ⅱ)(图1),该化合物由于含有卤素氯,可由过渡金属催化进一步偶联合成共轭程度更高的联芳基化合物,在有机材料方面具有潜在应用价值。由于催化体系里没有碳氢键活化副产物,更利于反应粗产物的分离。采用1HNMR、13CNMR对其结构进行了表征,并对催化剂用量、溶剂类型、反应温度、反应时间等工艺参数进行了优化。

图1 目标化合物合成示意图Fig.1 Synthetic diagram of target compound
1 实验
1.1 试剂与仪器
醋酸钯(钯含量47.4%),陕西开达化工有限责任公司;环辛二烯氯化铑二聚体(99.9%),Alfa-Aesar试剂有限公司;过氧化叔丁醇(TBHP)、2-苯基吡啶、2,4-二氯苯甲醛,化学纯,上海阿拉丁化学试剂有限公司;二甲苯、氯苯、甲苯、硝基苯、二甲基亚砜(DMSO)、乙酸乙酯、石油醚,分析纯,天津江天化工技术有限公司。
Bruker 600MHz型核磁共振仪;EYELA N-1100型旋转蒸发仪、PSL-1810型低温磁力搅拌水槽,上海爱朗仪器有限公司;X-4型数字显微熔点仪,北京泰克仪器有限公司;TD5102型电子天平。
1.2 合成方法
1.2.1 原料(2,4-二氯苯基)[2-(吡啶-2-基)苯基]甲酮(Ⅰ)的合成[9](图2)

图2 原料合成示意图Fig.2 Synthetic diagram of raw material
在25mL Schlenk瓶里加入2-苯基吡啶10mmol(1eq)、2,4-二氯苯甲醛20mmol(2eq)、醋酸钯5%(摩尔分数)、TBHP 20mmol(2eq),氮气交换3次,120℃反应过夜,将体系降温至室温,加入10mL乙酸乙酯,经硅胶层过滤,得红褐色有机层,减压旋蒸,柱色谱分离提纯(乙酸乙酯∶石油醚=1∶5),真空干燥后得到无色固体芳酮化合物Ⅰ2.24g。
1.2.2 产物2-(2′,4′-二氯[1,1′-联苯]-2-基)吡啶(Ⅱ)的合成
在25mL Schlenk瓶里加入化合物Ⅰ2mmol、铑催化剂[Rh(cod)Cl]22.5%(摩尔分数,下同)、二甲苯5mL,氮气交换3次,130℃反应12h,将体系降温至室温,加入5mL乙酸乙酯,经硅胶层过滤,得深黄色有机层,减压旋蒸,经柱色谱分离提纯(乙酸乙酯∶石油醚=1∶8),真空干燥得淡黄色固体化合物Ⅱ。
2 结果与讨论
2.1 结构表征
化合物Ⅰ,收率75%,m.p.80~82℃。1HNMR(600MHz,CDCl3),δ:8.47(d,J=4.6Hz,1H),7.66(dd,J=13.5Hz,7.6Hz,2H),7.62~7.55(m,2H),7.53(d,J=7.4Hz,1H),7.45(d,J=7.8Hz,1H),7.22(d,J=1.3Hz,1H),7.19(d,J=8.3Hz,1H),7.06~7.01(m,1H),6.99(d,J=8.3Hz,1H)。13CNMR(151MHz,CDCl3),δ:195.17,156.56,148.87,140.11,138.86,136.83,136.39,136.28,133.81,131.74,131.22,130.29,130.08,128.92,128.68,126.14,122.34,121.98。
目标化合物Ⅱ,收率91%,m.p.66~68℃。1HNMR(600MHz,CDCl3),δ:8.57(d,J=4.5Hz,1H),7.75(d,J=7.7Hz,1H),7.52(d,J=7.6Hz,1H),7.45(dt,J=15.1Hz,7.6Hz,2H),7.37~7.29(m,2H),7.14(d,J=8.2Hz,1H),7.09(dd,J=10.3 Hz,5.8Hz,2H),6.95(d,J=7.9Hz,1H);13CNMR(151MHz,CDCl3),δ:158.27,149.36,140.05,138.82,136.66,135.56,133.92,133.45,132.77,130.69,130.01,129.14,128.57,128.15,126.77,124.09,121.52。
2.2 工艺条件优化
对铑催化芳酮脱羰基合成联芳基化合物的工艺条件进行优化,实验设计及结果见表1。
2.3 讨论
(1)本实验选用了位阻较大的1,5-环辛二烯(cod)配体催化剂,可以有效地避免副产物产生,有助于产物分离。
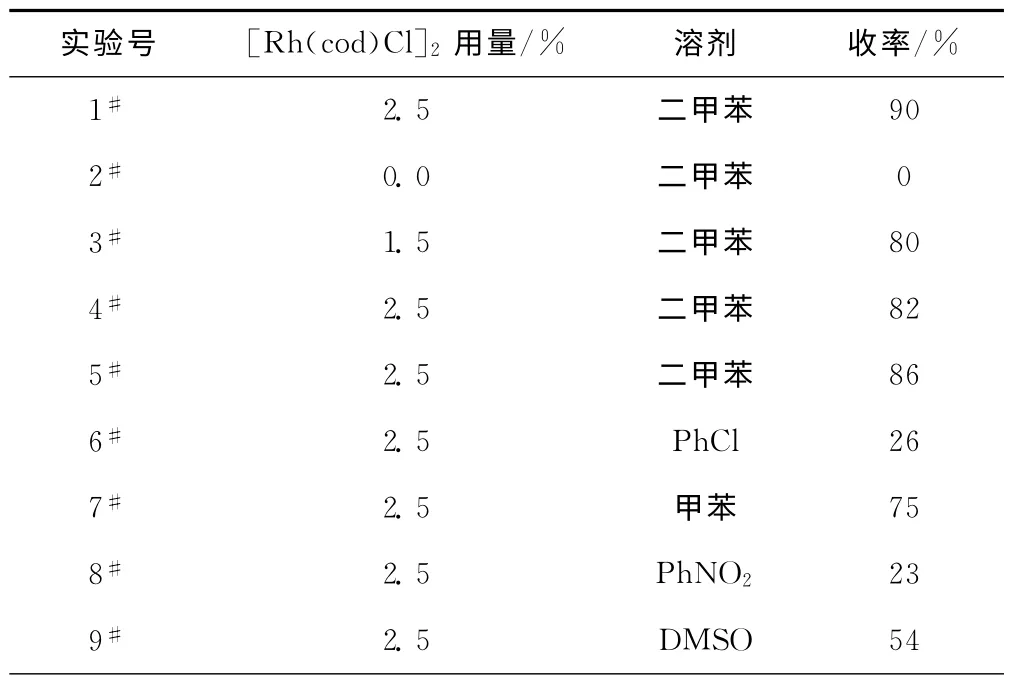
表1 铑催化芳酮脱羰基合成联芳基化合物的工艺优化实验Tab.1 Optimization of synthetic conditions for biaryls via decarbonylation from aryl ketone catalyzed by Rh(Ⅰ)
(2)选择二甲苯作为溶剂,可以在较低的反应温度下取得较高的收率。而对于极性较大的溶剂二甲基亚砜(DMSO)和电子云密度低的溶剂硝基苯及氯苯,反应收率明显降低;甲苯由于本身的沸点偏低也不适宜作为溶剂。
(3)反应体系需保证惰性环境(氮气氛围),否则在反应过程中,催化剂的活性可能会降低。
3 结论
由过渡金属铑络合物催化芳酮化合物脱羰基合成联芳基化合物,在底物芳酮用量为2mmol、铑催化剂[Rh(cod)Cl]2用量为2.5%、溶剂二甲苯用量为5 mL、反应温度为130℃、反应时间为12h的条件下,联芳基化合物收率达到90%。
[1]BLAKENEY J S,REID R C,LE G T,et al.Nonpeptidic ligands for peptide-activated G protein-coupled receptors[J].Chem Rev,2007,107(7):2960-3041.
[2]MYERS A G,TOM N J,FRALEY M E,et al.A convergent synthetic route to(+)-dynemicin A and analogs of wide structural variability[J].J Am Chem Soc,1997,119(26):6072-6094.
[3]XU G Q,FU W Z,LIU G D,et al.Efficient syntheses of korupensamines A,B and michellamine B by asymmetric Suzuki-Miyaura coupling reactions[J].J Am Chem Soc,2014,136(2):570-573.
[4]PENG Z M,HU G B,QIAO H W,et al.Palladium-catalyzed Suzuki cross-coupling of arylhydrazines viaC-N bond cleavage[J].J Org Chem,2014,79(6):2733-2738.
[5]GURUNG S K,THAPA S,KAFLE A,et al.Copper-catalyzed Suzuki-Miyaura coupling of arylboronate esters:Transmetalation with(PN)CuF and identification of intermediates[J].Org Lett,2014,16(4):1264-1267.
[6]LEI Z Q,LI H,LI Y,et al.Extrusion of CO from aryl ketones:Rhodium(Ⅰ)-catalyzed C-C bond cleavage directed by apyridine group[J].Angew Chem Int Ed,2012,51(11):2690-2694.
[7]WANG J,CHEN W Q,ZUO S J,et al.Direct exchange of a ketone methyl or aryl group to another aryl group through C-C bond activation assisted by rhodium chelation[J].Angew Chem Int Ed,2012,51(49):12334-12338.
[8]WANG J J,LIU B W,ZHAO H T,et al.Rhodium-catalyzed crosscoupling reactions of carboxylate and organoboron compounds via chelation-assisted C-C bond activation[J].Organometallics,2012,31(24):8598-8607.
[9]BASLE O,BIDANGE J,SHUAI Q,et al.Palladium-catalyzed oxidative sp2C-H bond acylation with aldehydes[J].Adv Synth Catal,2010,352(7):1145-1149.
