N-Boc-6-氨基-3-苄基-3-氮杂双环[3.2.1]辛烷的合成
2014-01-14邓鹏朋王丽丽黄龙江滕大为
邓鹏朋,王丽丽,黄龙江,滕大为
(青岛科技大学化工学院,山东 青岛266042)
双环[3.2.1]辛烷类化合物,尤其是氮杂或氧杂类广泛存在于活性药物分子结构和天然产物结构中[1],能治疗肥胖、认知缺陷、老年痴呆症等神经退行性疾病,还可作为5-HT1A拮抗剂[2-3]和阿片受体拮抗剂[4]等。在药物化学研究中,该类双环可以作为很多单杂环的生物电子等排体。因此,近年来有关其合成方法和应用得到了广泛的研究。
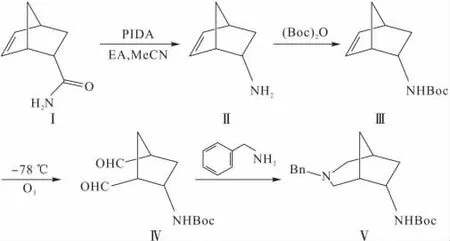
作者在此以降冰片烯-2-酰胺(化合物Ⅰ)为原料,经霍夫曼降解、氨基保护、双键臭氧化、苄胺的还原氨化等系列反应得到氮杂目标产物N-Boc-6-氨基-3-苄基-3-氮杂双环[3.2.1]辛烷(化合物Ⅴ),并优化了关键反应步骤霍夫曼降解和双键臭氧化反应,得到了一条较佳的合成工艺路线,为以其为母核的化合物库的合成和活性研究奠定了基础。具体合成路线如下:
1 实验
1.1 主要试剂和仪器
薄层层析用硅胶板、柱层析用硅胶(200~300目),青岛海洋化工厂;其它试剂均为化学纯,所用溶剂均经常规干燥。
YP-3002型电子天平,上海越平科学仪器有限公司;RE-2000型旋转蒸发仪,上海亚荣生化仪器厂;Bruke 500M型NMR仪,德国布鲁克公司;SW-018型臭氧发生器,青岛维斯特电子净化设备有限公司。
1.2 合成方法
1.2.1 2-氨基降冰片烯(化合物Ⅱ)的合成[5-8]
在1 000mL圆底烧瓶中加入50g(0.365mol)降冰片烯-2-酰胺、141g(0.438mol)二乙酸碘苯、500mL乙酸乙酯、500mL乙腈、250mL水,在10℃下搅拌约15min,然后升温至30℃搅拌过夜,TLC检测反应结束。用乙酸乙酯(500mL×3)萃取,收集有机相并用500mL饱和食盐水洗涤,经无水硫酸钠干燥后旋干溶剂,粗产品经柱层析后得33.8g白色固体即化合物Ⅱ,收率85%。
1.2.2 N-Boc-2-氨基双环[2.2.1]-5-庚烯(化合物Ⅲ)的合成
在500mL圆底烧瓶中加入20g(0.183mol)化合物Ⅱ、500mL乙酸乙酯,滴加三乙胺显碱性,冰浴下滴加47.9g(0.220mol)(Boc)2O,搅拌30min,TLC检测反应结束。加入100mL水,分出有机相。水相用乙酸乙酯(100mL×2)萃取,合并有机相并用50 mL饱和食盐水洗涤,经无水硫酸钠干燥后旋干溶剂,粗产品经柱层析后得36.4g白色固体即化合物Ⅲ,收率95%。
1.2.3 双醛(化合物Ⅳ)的合成
将20g(0.096mol)化合物Ⅲ用100mL二氯甲烷溶解于500mL三口圆底烧瓶中并用液氮冷却至-78℃,在该温度下缓慢通入臭氧至溶液变成并保持蓝色,TLC检测反应结束。用氩气排除三口瓶中多余的臭氧,滴加59.5g(0.96mol)二甲基硫醚,反应一段时间后冷却到室温,加入60mL水洗涤,水相再用二氯甲烷(100mL×3)萃取,合并有机相并用饱和食盐水洗涤,经无水硫酸钠干燥后旋干溶剂,粗产品经柱层析后得17.7g化合物Ⅳ,收率77%。
1.2.4 N-Boc-6-氨基-3-苄基-3-氮杂双环[3.2.1]辛烷(化合物Ⅴ)的合成
将20g(0.083mol)化合物Ⅳ用100mL二氯甲烷溶解于500mL圆底烧瓶中,冰浴下加9.32g(0.087mol)苄胺,搅拌0.5h后缓慢加入44.76g(0.21mol)三乙酰氧基硼氢化钠,搅拌1h,TLC检测反应结束。在布氏漏斗上垫硅藻土,对反应溶液进行抽滤,滤液旋干,粗产品经柱层析后得23.27g白色固体即目标化合物Ⅴ,收率89%。
2 结果与讨论
2.1 霍夫曼降解的优化
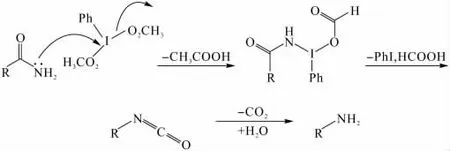
常规的霍夫曼降解是用次溴酸钠将一级酰胺转化为中间产物异氰酸酯,异氰酸酯水解释放二氧化碳,同时生成少一个碳原子的伯胺。本研究采用该方法时发现没有目标产物生成,可能是因为生成的次溴酸钠具有氧化性与双键发生了反应,导致未能生成目标产物且产物复杂。故尝试了一种应用较少的霍夫曼降解试剂二乙酸碘苯,其作用机理如下:伯酰胺中氮原子上的孤电子对进攻亲电的超共价碘,同时失去二乙酸根得到中间体,经重排得到异氰酸酯,再在水中脱二氧化碳得到伯胺。
以二乙酸碘苯为霍夫曼降解试剂,进一步考察反应溶剂、反应温度、反应时间等对反应收率的影响,得到了较佳的霍夫曼降解反应条件为:以V乙腈∶V乙酸乙酯∶V水=2∶2∶1为溶剂,在30℃搅拌24h,反应收率达到85%。
2.2 双键氧化制备双醛的优化
双键氧化断裂生成双醛的方法有四氧化锇/高碘酸钠法[9]、2,6-二甲基吡啶法和臭氧氧化法[10]等。考虑到臭氧作为氧化剂时,不仅操作简单、收率高、产物纯化简单而且基本无废物排放,符合绿色环保的化学发展理念,同时成本也较低,因此,本研究选择臭氧氧化法合成双醛。
3 结论
以降冰片烯-2-酰胺为原料,经霍夫曼降解、氨基保护、双键臭氧化、苄胺的还原氨化等反应制备NBoc-6-氨基-3-苄基-3-氮杂双环[3.2.1]辛烷,通过对反应的关键步骤进行优化,目标产物的总收率达到55.3%。该方法简单,操作容易且收率较高,为后续的化合物库合成与活性研究奠定了基础。
[1]覃宇.新型3-取代-8-氮杂双环[3.2.1]辛烷衍生物的合成与表征[J].武汉职业技术学院学报,2011,10(5):103-106.
[2]Gilbert A M,Stack G P.8-Aza-bicyclo[3.2.1]octan-3-ol derivatives of 2,3-dihydro-1,4-benodioxan as 5-HT1Aantagonists:US,6656951B2[P].2003-12-02.
[3]Stack G P,Gilbert M A,Tran M.Azabicyclylmethyl derivatives of 7,8-dihydro-1,6,9-trioxa-3-aza-cyclopenta[a]naphthalene as 5-HT1Aantagonists:US,7381723B2[P].2008-06-03.
[4]Long D D,Church T J,Jacobsen J R,et al.8-Azabicyclo[3.2.1]octane compounds as MU opioid receptor antagonists:US,8263618[P].2012-09-11.
[5]Gosling J I,Baker S P,Haynes J M,et al.Synthesis and biological evaluation of adenosines with heterobicyclic and polycyclic N(6)-substituents as adenosine A(1)receptor agonists[J].Chem Med Chem,2012,7(7):1191-1201.
[6]Ye J H,Huang Y,Chen R.A new approach to the synthesis of 1,3-aminoalcohols from meso cyclic acid anhydride[J].Oppi Briefs,2003,35(4):429-432.
[7]Bernath G,Stajer G,Szabo A E,et al.Stereochemical studies.83.Saturated heterocycles.76.Preparation and conformational study of partially saturated 3,1-benzoxazines,3,1-benzoxazin-2-ones and 3,1-benzoxazine-2-thiones[J].Tetrahedron,1985,41(7):1353-1365.
[8]Stajer G,Szabo A E,Fulop F,et al.Stereochemical studies.81.Saturated heterocycles.69.Preparation of methylene-bridged 3,1-benzoxazines,3,1-benzoxazin-2-ones and 3,1-benzoxazine-2-thiones[J].J Heterocycl Chem,1984,21(5):1373-1376.
[9]Kazi B,Kiss I,Forro E,et al.Synthesis of conformationally constrained,orthogonally protected 3-azabicyclo[3.2.1]octaneβ-amino esters[J].ARKIVOC,2010,2010(9):31-39.
[10]Taber D F,Nakajima K.Unsymmetrical ozonolysis of a Diels-Alder adduct:Practical preparation of a key intermediate for heme total synthesis[J].J Org Chem,2001,66(7):2515-2517.
