Acinetobacter lwoffii DNS32对阿特拉津污染的氧化应激响应
2014-01-14张颖孟冬芳王志刚郭火生王洋
张颖,孟冬芳,王志刚,郭火生,王洋
(东北农业大学资源与环境学院,哈尔滨 150030)
Acinetobacter lwoffii DNS32对阿特拉津污染的氧化应激响应
张颖,孟冬芳,王志刚,郭火生,王洋
(东北农业大学资源与环境学院,哈尔滨 150030)
文章探讨以A.lwoffiiDNS32为试验菌株革兰氏阳性菌S.aureusR2经阿特拉津处理后,于0、6、12和24 h取样测定SOD、CAT、GST活性和T-AOC。结果表明,暴露6 h,两菌株T-AOC受到诱导,SOD、CAT和GST活性最大诱导率分别为111.26%和55.47%,72.79%和61.61%,33.35%和52.76%。暴露24 h,A.lwoffiiDNS32 SOD和CAT受到诱导,GST和T-AOC受到抑制,而S.aureusR2 SOD、CAT、GST活性和T-AOC都受到抑制。与S.aureusR2相比,A.lwoffiiDNS32对阿特拉津氧化胁迫的耐受性相对较高。
阿特拉津;阿特拉津降解菌;抗氧化酶;活性氧自由基(ROS)
活性氧自由基(ROS)是细胞有氧呼吸代谢过程中的副产物,氧化应激特征是生成ROS。多数污染物具有氧化还原活性,可参与生物体内氧化还原循环,产生大量ROS等有害物质,若ROS产生速度超出抗氧化防御系统清除能力,对机体造成氧化胁迫,引起脂质过氧化、DNA链断裂、碱基核糖基氧化、酶蛋白胶联以致细胞死亡或癌变[1]。抗氧化酶功能是清除ROS保护机体细胞免受氧自由基损伤,其活性能间接反映机体细胞中ROS浓度变化。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽硫转移酶(GST)3种主要抗氧化防御酶是诱导酶,通过代偿机制能被轻微氧化应激诱导,严重氧化应激会导致代偿机制的缺失和细胞氧化损伤而抑制酶活性[2]。抗氧化防御酶系重要特征是其活性或含量由于污染胁迫而发生改变,能间接反映环境中氧化作用存在,可作为环境污染胁迫程度指标。目前,细菌对某些污染物氧化胁迫响应已得到广泛研究[3-5],但针对阿特拉津对细菌污染胁迫研究甚少。阿特拉津可通过产生ROS造成DNA链断裂对生物机体存在基因毒性[6]。关于阿特拉津通过增加ROS浓度诱导生物体产生氧化应激反应,通过影响抗氧化酶活性使生物体产生氧化损伤[7]研究较少,而且集中在动物和植物方面,阿特拉津对细菌等微生物氧化胁迫方面研究尤为少见。A.lwoffiiDNS32是以阿特拉津为唯一氮源的革兰氏阳性高效阿特拉津降解菌株,因此,本文以A.lwoffiiDNS32为试验材料,革兰氏阳性菌S.aureusR2为对照菌株,通过将其暴露到不同浓度阿特拉津中,探讨菌中SOD、CAT、GST活性和总抗氧化能力(T-AOC)对阿特拉津污染氧化应激响应,为阿特拉津对环境微生物抗氧化酶系的生态毒理学研究提供理论依据,为筛选出对阿特拉津污染胁迫耐受性强的高效降解菌提供技术支撑。
1 材料与方法
1.1 菌株及生长条件
阿特拉津纯度≥97%,其余试剂为分析纯或超级纯。T6新世纪紫外分光光度计(北京普析通用仪器有限责任公司)。AcinetobacterlwoffiiDNS32(A.lwoffiiDNS32)是从黑龙江省长期施用阿特拉津的黑土耕层中筛选得到的高效阿特拉津降解菌,对阿特拉津72 h的降解率达到98.91%。StaphylococcusaureusR2(S.aureusR2)由东北农业大学资源与环境学院实验室保存。菌株接种到液体LB培养基(pH 7.0)中,30℃,150 r·min-1培养。
1.2 试验设计
菌株接种在液体LB培养基中培养12~18 h,按2%接种量接种到1个新的液体LB培养基中,继续培养24 h后,加入适量的阿特拉津,使其在培养液中的终浓度为0、2、5、10、15和20 mg·L-1,继续培养,分别在阿特拉津加入后0、6、12和24 h取样用于粗酶制备。每个处理设3组平行。
1.3 粗酶制备
细菌培养液经6 000 r·min-1离心15 min收集菌体后,用预冷的0.9%生理盐水洗涤2次,重悬于3 mL预冷0.9%生理盐水中,冰浴超声破碎,工作时间3 s,间歇3 s,重复99次。破碎后的细胞10 000 r·min-1,4℃离心10 min后将上清转入新的无菌离心管中-20℃储存用于酶活的测定。
1.4 酶活测定
采用南京建成生物工程研究所提供的试剂盒测定抗氧化酶活性。
SOD活性单位定义:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)(U·mg-1·protein)。
CAT活性单位定义:每毫克组织蛋白中过氧化氢酶每秒分解吸光度为0.50~0.55的底物中的过氧化氢相对量为一个过氧化氢酶的活力单位(U·mg-1· protein)。
GST活性单位定义:每毫克组织蛋白,在37℃反应l min扣除非酶促反应,使反应体系中GSH浓度降低1 μmol·L-1为一个酶活力单位(U)(U·mg-1·protein)。
T-AOC单位定义:在37℃时,每分钟每毫克组织蛋白,使反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位(U·mg-1·protein)。
蛋白含量定义:每升上清液中蛋白克数(g·L-1)。
2 结果与分析
2.1 菌体中SOD活性变化
如图1所示,阿特拉津暴露6 h时,两菌株的SOD活性最大诱导率分别出现在阿特拉津15和10 mg·L-1处,为111.26%和55.47%。A.lwoffiiDNS32受阿特拉津暴露的6、12和24 h,SOD活性随着阿特拉津浓度的增加都先增后降,各时间点活性最大值达到0 h的1.5倍以上,分别出现在阿特拉津15、10和15 mg·L-1处。S.aureusR2的SOD活性从12 h开始下降,24h时最大抑制率达44.27%。
SOD能将O2-分解为H2O2和O2[8]。通常认为SOD活性的增加与暴露于污染物中的机体消除氧化应激有关[9],当外来胁迫导致大量活性氧产生时,SOD能及时有效清除自由基,保护细胞免受氧化胁迫的伤害。但SOD的过度表达可能会引发H2O2这一代谢物的过量积累,致使细胞中毒[10],细胞内多种功能受到破坏,生理代谢紊乱,SOD活性受到抑制下降,从而导致抗氧化水平的下降。Song等报道,Vicia faba SOD活性在阿特拉津2.5 mg·L-1时受到诱导,5和10 mg·L-1时受到抑制,证明阿特拉津诱导ROS产生[11]。本试验中,A.lwoffiiDNS32 SOD活性整个暴露时期均受到诱导,说明SOD一直发挥清除ROS作用,与在仙姑弹琴蛙蝌蚪肌肉组织中研究结果相反[12]。随着作用时间延续,菌体内同时存在两种反应,即自由基诱导的抗氧化酶活性增强及自由基对细胞和抗氧化酶直接损伤而引起抗氧化酶活性下降。在长期作用下,前者表现为诱导作用,后者表现为抑制作用。在高浓度暴露下,同一时间点上,A.lwoffiiDNS32 SOD活性均要高于S.aureusR2。而且阿特拉津暴露12 h,S.aureusR2 SOD活性便开始降低,说明A.lwoffiiDNS32对阿特拉津诱导产生的O2-耐受性要高于非阿特拉津降解菌S.aureusR2。
2.2 菌体中CAT活性变化
如图2所示,阿特拉津暴露6 h时,A.lwoffiiDNS32和S.aureusR2 CAT活性最大诱导率都出现在阿特拉津10 mg·L-1处,分别达到72.79%和61.61%。A.lwoffiiDNS32阿特拉津暴露各浓度组CAT活性随着暴露时间的延长呈现逐渐上升趋势。与暴露6 h比,菌株S.aureusR2暴露12 h低浓度组CAT活性明显增加,高浓度组则明显下降,暴露24 h时,各浓度组CAT活性都低于12 h,在阿特拉津15和20 mg·L-1时甚至低于0 h,抑制率分别为35.40%和55.75%。

图1 A.lwoffiiDNS32(A)和S.aureusR2(B)SOD活性变化Fig.1 Variation of SOD activities in A.lwoffiiDNS32(A)and S.aureusR2(B)
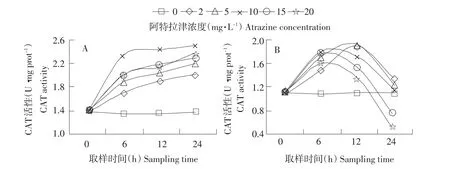
图2 A.lwoffiiDNS32(A)和S.aureu R2(B)CAT活性变化Fig.2 Variation of CAT activities in A.lwoffiiDNS32(A)and S.aureusR2(B)
动植物和微生物细胞内的CAT可催化H2O2分解为H2O和O2,减少过氧化物酶中长链脂肪酸代谢物H2O2的积累[13],与生物代谢强度及抗逆境能力密切相关。Alla等研究表明,经阿特拉津处理的玉米CAT活性受到诱导,提高玉米抗氧化性[14]。本试验中,A.lwoffiiDNS32 CAT活性整个暴露时期均受到诱导,与在仙姑弹琴蛙蝌蚪肌肉组织中研究结果不同[12]。同一时间点上,A.lwoffiiDNS32 CAT活性高于S.aureusR2,出现该结果的原因是,A.lwoffiiDNS32菌体内阿特拉津污染胁迫产生较多的H2O2,CAT发挥较高的清除作用。逆境条件下,CAT活性的下降可导致H2O2的累积,过量积累甚至使生物膜结构受到损伤,而CAT活性的提高能更有效清除H2O2。从酶活性的变化趋势来看,A.lwoffiiDNS32对阿特拉津污染胁迫产生的H2O2耐受性要强于非阿特拉津降解菌S.aureusR2。
2.3 菌体中GST活性变化
如图3所示,阿特拉津暴露6 h时,两菌株GST活性都高于0 h最初水平,最大诱导率都出现在阿特拉津15 mg·L-1处,分别为33.35%和52.76%。暴露12 h时两菌株的GST活性在阿特拉津5 mg·L-1处达到最大值,诱导率分别为26.83%和65.70%。24 h时,两菌株GST活性低于0 h,最大抑制率分别为8.32%和16.60%。
GST是解毒系统第二阶段的解毒酶,可催化谷胱甘肽(GSH)与亲电中间代谢物的结合,减少化合物与细胞内生物大分子如DNA等结合的可能性,还可清除脂类过氧化物,从而去除内源性或外源性毒物的毒性,在解毒系统中起重要作用[15]。正是由于GST在生物转化过程中的独特功效,菌体中GST活性增加表示菌体内相应的防御外源性物质机制的建立。随着阿特拉津污染胁迫的加重,菌体GST活性受到激活,以消除更多的氧化产物;随着污染胁迫的进一步加重,GST活性重新下降至原来水平,甚至受到抑制。
本试验中,两菌株GST活性在试验短期被诱导,长期暴露则受到抑制,这与阿特拉津在鲫鱼肝脏[16]中的研究结果一致,与在中华绒鳌蟹中的研究结果不同[17]。GST活性下降的原因是作为底物的GSH被大量消耗,同时解毒过程中产生的大量中间代谢物改变GST亚基的组成降低GST活性或者在体外测定时与GST底物(如cDNB)发生竞争性抑制[18]。本试验同一时间点上,A.lwoffiiDNS32 GST活性高于S.aureusR2,表现出较高敏感性和诱导性,说明A.lwoffiiDNS32 GST在抵抗阿特拉津诱导产生的氧化应激过程中起重要的解毒作用。
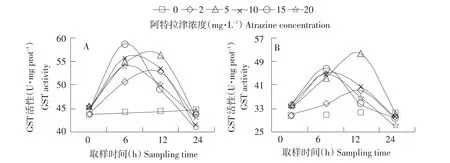
图3 A.lwoffiiDNS32(A)和S.aureusR2(B)GST活性变化Fig.3 Variation of GST activities in A.lwoffiiDNS32(A)and S.aureusR2(B)
2.4 菌体中T-AOC变化
如图4所示,6 h时两菌株T-AOC随着阿特拉津浓度增加而增加,最大值分别为20.87和17.74 U·mg-1protein。12 h时T-AOC呈倒“U”型变化,最大值都出现在阿特拉津10 mg·L-1处。24 h时,低浓度组T-AOC被诱导,高浓度组受到抑制,总体上呈现低促高抑现象。
T-AOC是用于衡量机体抗氧化系统功能状况的综合性指标,它的大小代表机体抗氧化酶系统和非酶系统性能的状态,从总体上反映机体防御体系抗氧化能力的高低[19]。细菌具备抗氧化系统[20],包括一些抗氧化酶及DNA修复系统等。抗氧化酶用于抵御不同的ROS,因而不同的活性氧类会产生不同的反应。本试验经阿特拉津暴露后,细菌相应的抗氧化酶活性和总抗氧化能力升高,因为阿特拉津能够诱导细菌产生ROS,从而对细菌产生氧化胁迫,作为一种应急机制,菌体产生大量的抗氧化酶抵御氧化胁迫[21]。有研究表明,氯乙酰苯胺类除草剂在前期的脱氯降解中可产生ROS[22-23],其他如联吡啶类和合成激素类除草剂,通过电子传递链的电子流的封锁诱导氧化应激的产生,并直接或间接影响膜结构和功能[24-25]。由此推断,阿特拉津诱导细菌产生的氧化应激反应是由于菌体细胞氧化还原电位失衡引起的,进而导致菌体代谢失衡。关于阿特拉津降解菌抗氧化酶活性的动态变化及抗氧化机制,尚待深入研究。

图4 A.lwoffiiDNS32(A)和S.aureusR2(B)T-AOC变化Fig.4 Variation of T-AOC in A.lwoffiiDNS32(A)and S.aureusR2(B)
3 讨论与结论
经阿特拉津暴露,菌体的抗氧化酶活性升高,说明阿特拉津诱导细菌产生氧化应激反应,这是由于菌体细胞氧化还原电位失衡引起,导致菌体代谢失衡。与非阿特拉津降解菌S.aureusR2相比,A.lwoffiiDNS32对阿特拉津氧化胁迫的耐受性相对较高。两菌株中三种抗氧化酶都参与抗氧化反应,A.lwoffiiDNS32在抵抗阿特拉津对菌体产生氧化应激作用方面具有优势。
本研究所用高效阿特拉津降解菌是从黑龙江省寒地黑土耕层中筛选得到,由试验结果可知其对阿特拉津污染胁迫具有较强的抗氧化能力。因此,A.lwoffiiDNS32针对黑龙江省寒地黑土阿特拉津污染治理生物修复工程,具有很好的应用前景。
[1]Zhang J F,Shen H,Xu T L,et al.Effects of long-term exposure of low-level diesel oil on the antioxidant defense system of fish[J]. Bull Environ Contam Toxicol,2003,71(2):234-239.
[2]Sun Y Y,Yu H X,Zhang J F,et al.Bioaccumulation,depuration and oxidative stress in fish Carassius auratus under phenanthrene exposure[J].Chemosphere,2006,63(8):1319-1327.
[3]Hassett D J,Alsabbagh E,Parvatiyar K,et al.A protease-resistant catalase,katA,released upon cell lysis during stationary phase is essential for aerobic survival of a Pseudomonas aeruginosa oχyR mutant at low cell densities[J].J Bacteriol,2000,182 (16):4557-4563.
[4]Geckil H,Gencer S,Kahraman H,et al,Genetic engineering of Enterobacter aerogenes with the Vitreoscilla hemoglobin gene:Cell growth,survival,and antioxidant enzyme status under oxidative stress[J].Res Microbiol,2003,154(6):425-431.
[5]Frederick J R,Elkins J G,Bollinger N,et al.Factors affecting catalase expression in Pseudomonas aeruginosa biofilms and planktonic cells[J].Appl Environ Microbiol,2001,67(3):1375-1379.
[6]Song Y,Zhu L S,Wang J,et al.DNA damage and effects on antioxidative enzymes in earthworm(Eisenia foetida)induced by atrazine[J].Soil Biol Biochem,2009,41(5):905-909.
[7]Jin Y X,Zhang X X,Shu L J,et al.Oxidative stress response and gene expression with atrazine exposure in adult female zebrafish (Danio rerio)[J].Chemosphere,2010,78(7):846-852.
[8]Gerlach D,Reichardt W,Vettermann S.Extracellular superoxide dismutasefromStreptococcuspyogenestype12strainis manganese-dependent[J].FEMS Microbiol Lett,1998,160(2): 217-224.
[9]Üner N,Oruç E,Sevgiler Y.Oxidative stress-related and ATPase effect of etoxazole in different tissues of Oreochromis niloticus[J]. Environ Toxicol Pharmacol,2005,20(1):99-106.
[10]Kang Y S,Lee Y,Jung H,et al.Overexpressing antioxidant enzymes enhances naphthalene biodegradation in Pseudomonas sp. strain As1[J].Microbiology,2007,153(10):3246-3254.
[11]Song Y,Zhu L S,Xie H,et al.Effects of atrazine on DNA damage and antioxidative enzymes in Vicia faba[J].Environ Toxicol Chem, 2009,28(5):1055-1062.
[12]苑宇哲,徐士霞,姚春生,等.阿特拉津溶液中仙姑弹琴蛙(Rana daunchina)蝌蚪抗氧化酶系活性的变化[J].Sichuan Journal of Zoology,2004,23(3):307-312.
[13]Winston G W,Giulio D R T.Prooxidant and antioxidant mechanism in aquatic organism[J].Aquat Toxicol,1991,19(2):137-161.
[14]Alla M M N,Hassan N M.Changes of antioxidants levels in two maize lines following atrazine treatments[J].Plant Physiol Bio⁃chem,2006,44(4):202-210.
[15]Elia A C,Waller W T,Norton S J.Biochemical response of bluegill sunfish(Lepomis macrochirus,Rafinesque)to atrazine induced oxidative stress[J].Bull Environ Contam Toxicol,2002,68 (6):809-816.
[16]陈家长,孟顺龙,瞿建宏,等.低浓度阿特拉津对鲫鱼谷胱甘肽-S转移酶(GSTs)活性的影响[J].J Ecology and Rural Envi⁃ron,2007,23(1):68-72.
[17]李康.阿特拉津和毒死蜂对中华绒鳌蟹(Eriocheir sinensis)的毒性效应研究[D].上海:华东师范大学,2005.
[18]Egaas E,Sandvik M,Fjeld E,et al.Some effects of the fungicide propiconazole on cytochrome P450 and glutathione S-transferase in brown trout(Salmo trutta)[J].Comp Biochem Physiol Part C: Pharmacol Toxicol,1999,l22(3):337-344.
[19]吴琼,孙文志,白兆鹏.牛磺酸对产蛋后期蛋鸡血清生化及抗氧化性能的影响[J].Feed Research,2005:48-50.
[20]Chen I,Christie P J,Dubnau D.The ins and outs of DNA transfer in Bacteria[J].Science,2005,310:1456-1460.
[21]杨栋,邱志刚,金敏,等.纳米氧化铝促进多重耐药质粒RP4接合转移机制的初步研究[J].环境与健康杂志,2011,28(2):102-104.
[22]Fuentes M S,Benimeli C S,Cuozzo S A,et al.Isolation of pesti⁃cide degrading actinomycetes from a contaminated site:bacterial growth,removal and dechlorination of organochlorine pesticides [J].Int Biodeterior Biodegrad,2010,64(6):434-441.
[23]Xu J,Yang M,Dai J Y,et al.Degradation of acetochlor by four microbial communities[J].Bioresour Technol,2008,99(16):7797-7802.
[24]Lü Z M,Sang L Y,Li Z M,et al.Catalase and superoxide dismutase activities in a Stenotrophomonas maltophilia WZ2 resistant to herbicide pollution[J].Ecotoxicol Environ Saf,2009, 72(1):136-143.
[25]Işık K,Kayali H A,Sahin N,et al.Antioxidant response of a novel Streptomyces sp.M3004 isolated from legume rhizosphere to H2O2and paraquat[J].Process Biochem,2007,42(2):235-243.
Oxidative stress response ofAcinetobacter lwoffii DNS32 exposed to atrazine-contaminated
ZHANG Ying,MENG Dongfang,WANG Zhigang,GUO Huosheng, WANG Yang
(School of Resources and Environmental Science,Northeast Agricultural University, Harbin 150030,China)
To investigate the oxidative stress response of antioxidant enzymes in atrazinedegrading bacterium exposed to atrazine played a significant role in the application of bacterium.A.lwoffiiDNS32 andS.aureusR2 cultures were treated with different concentrations of atrazine.After exposure to atrazine for 0,6,12 and 24 h,bacterial cells were harvested in order to assay SOD,CAT,GST activities and T-AOC.The results showed that at 6 h T-AOC was induced,and the biggest inducement rate of SOD,CAT and GST activities were 111.26%and 55.47%,72.79%and 61.61%,33.35%and 52.76%in the two bacteria,respectively.At 24 h SOD and CAT inA.lwoffiiDNS32 were induced,and GST and T-AOC were inhibited.But SOD,CAT,GST activities and T-AOC inS.aureusR2 were inhibited at 24 h.Compared withS. aureusR2,A. lwoffiiDNS32 had relatively high tolerance to atrazine stress.
atrazine;atrazine-degrading bacteria;antioxidant enzymes;reactive oxygen species(ROS)
X172
A
1005-9369(2014)01-0065-06
2012-02-25
国家“十二五”科技计划项目(2011BAD04B02)
张颖(1972-),女,教授,博士,博士生导师,研究方向为环境污染生物修复。E-mail:zhangyinghr@hotmail.com
时间2014-1-9 19:31:14[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140109.1931.002.html
张颖,孟冬芳,王志刚,等.Acinetobacter lwoffiiDNS32对阿特拉津污染的氧化应激响应[J].东北农业大学学报,2014,45(1): 65-69.
Zhang Ying,Meng Dongfang,Wang Zhigang,et al.Oxidative stress response ofAcinetobacter lwoffiiDNS32 exposed to atrazine-contaminated[J].Journal of Northeast Agricultural University,2014,45(1):65-69.(in Chinese with English abstract)
