不同土壤水分处理下冬小麦细胞活力差异比较
2014-01-14付连双王晓楠李卓夫谢冬微孙莹璐郑伟
付连双,王晓楠,李卓夫,谢冬微,孙莹璐,郑伟
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院佳木斯分院,黑龙江佳木斯 154007)
不同土壤水分处理下冬小麦细胞活力差异比较
付连双1,王晓楠1,李卓夫1,谢冬微1,孙莹璐1,郑伟2
(1.东北农业大学农学院,哈尔滨 150030;2.黑龙江省农业科学院佳木斯分院,黑龙江佳木斯 154007)
采用抗寒性不同的两个冬小麦品种“东农冬麦1号”和“济麦22”为试验材料,设置土壤绝对含水量15%±2%、30%±2%、45%±2%和对照(CK,35%~40%)4个水分处理,对越冬期间低温与水分双重胁迫下细胞的活力变化进行研究。结果表明,两品种叶片、叶鞘细胞活力随取样日期变化有降低趋势;两品种间比较,进入封冻期20 d以后细胞活力差异明显,细胞失活受损程度上表现为东农冬麦1号轻于济麦22;在不同土壤水分条件下,CK处理下(正常水分管理)细胞活力最佳;取样部位上,叶鞘细胞活力好于叶片。
土壤含水量;细胞活力;冬小麦
黑龙江省地处高寒地区,“九五”期间,曾进行过冬麦北移试验,但因品种适应性问题并未取得成功,品种抗寒性是限制寒地冬小麦种植的首要问题。东北农业大学于2007年育成适应高寒地区生长的第一个冬小麦品种“东农冬麦1号”,其推广应用对于增加黑龙江省粮食产量,改善作物布局,促进各作物协调增产具有重要意义[1]。东北农业大学小麦课题组在寒地冬小麦越冬领域的研究结果表明,返青期低温胁迫会导致冬小麦幼苗叶鞘MDA含量增加,其值与返青率呈显著负相关[2];细胞超微结构观察表明,封冻后30 d抗寒性强品种分蘖节细胞只发生轻微质壁分离,细胞核依然完整,抗寒性弱品种细胞中内含物消失,细胞空泡化[3];播期过早或过晚均会加重低温对不同冬小麦品种的膜伤害,以播种期到封冻期积累500~600℃有效积温为适宜播期[4];播种深度4~6 cm更有利于冬小麦越冬成活[5]。这些研究对指导黑龙江省冬小麦安全越冬具有重要理论和实践意义。土壤水分也是影响冬小麦能否安全越冬的另一个重要因素,本文采用水分梯度试验,对不同土壤水分处理下冬小麦返青率和电导率变化进行研究,结果表明,入冬前土壤绝对含水量为35%~40%时,更有利于冬小麦安全越冬[6]。在冬小麦越冬过程中,植株能否安全越冬又是一个由量变到质变的过程,取决于植株细胞受伤害程度,观察越冬期间冬小麦植株细胞活力,能够真实反映植株细胞的存活情况。中性红染色法是常用来进行细胞活力检测的有效方法,将中性红染色法用在抗寒性鉴定上,可鉴别不同品种植株细胞在低温胁迫下的致死情况,具有简便快速的特点。本文针对越冬期间不同土壤水分处理下植株细胞活力进行分析,旨在探究水分对冬小麦细胞活力的影响,以期进一步明确土壤含水量对寒地冬小麦越冬性的影响。
1 材料与方法
1.1 材料与设计
以抗寒性不同的两个冬小麦品种“东农冬麦1号”(DN1)和“济麦22”(JM22)为试验材料,采用3个土壤含水量梯度处理(土壤绝对含水量的15%± 2%、30%±2%和45%±2%)和一个对照(CK)处理(正常水分管理)。水分梯度试验在抗旱防雨棚中进行,自出苗后每3 d测定1次含水量,直至封冻。对照(CK)组正常管理,根据土壤干湿状况等量供水,保持土壤湿润,封冻前测定其土壤绝对含水量为35.2%~40.1%。
采用盆栽试验,随机区组设计,3次重复,盆栽试验中盆规格为直径300 mm,高275 mm,供试土壤为黑土,每盆装干土12 kg。试验地点在东北农业大学盆栽试验场,于2009年9月中旬播种,10月初定苗,每盆保苗30株,10月下旬开始取样,每3周取样1次,共取样6次。试验期间温度变化见图1(气象数据来源于黑龙江省气象台),各取样期气温变化如下:2009年10月21日(0~8℃)、2009年11月11日(-13~-3℃)、2009年12月2日(-21~-10℃)、2009年12月26日(-26~-16℃)、2010年1月14日(-28~-17℃)和2010年2月4日(-23~-16℃)。
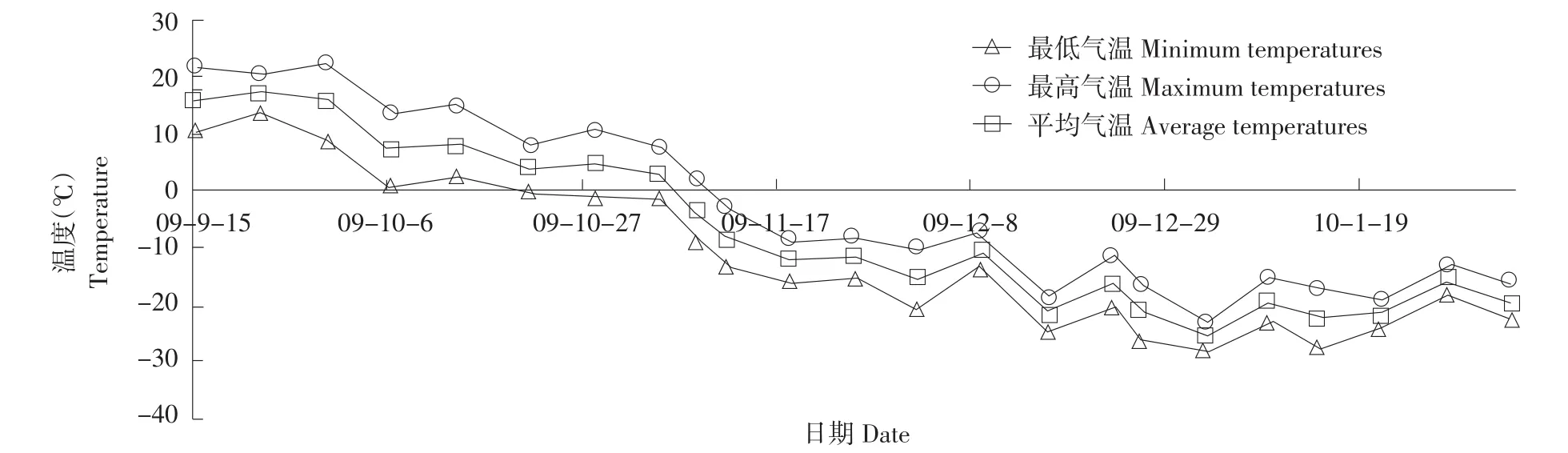
图1 试验期内日最高气温、最低气温与平均气温Fig.1 Maximum,minimum and average temperatures per day during sampling period
1.2 测试项目及方法
每次每个处理随机取样10株,并各取其第三片叶及叶鞘进行细胞活力观察。植株细胞活力检测采用中性红活体染色法[7],光学显微镜(NIKON801+DM×1200C)下等倍放大观察并拍照。镜检中呈现红色的细胞为有活力细胞,不被染色呈无色的为死细胞。每个处理选取3个视野,将各处理中典型有代表性的照片进行比对分析。
2 结果与分析
2.1 叶片不同取样日期及不同品种间的细胞活力分析
15%±2%水分处理叶片细胞活力检测结果见图版I。在15%±2%水分处理组,东农冬麦1号10月21日(见图版I-1)叶片死细胞比例较少,11月11日(见图版I-2)、12月2日(见图版I-3)死细胞比例增大,细胞活力减小,至12月26日(见图版I-4),所有细胞均失去活力。济麦22叶片,从10月21日(见图版I-7)至11月11日(见图版I-8)被染色的细胞数量逐渐减少,死细胞比例逐渐增加,至12月2日(见图版I-9)时所有细胞均未被染色,细胞全部死亡。
品种间相比,10月21日和11月11日差异较小;12月2日差异明显,东农冬麦1号叶片仍有部分细胞存在活力;12月26日以后两品种叶片细胞均全部失活。

图版I15%±2%水分处理叶片细胞活力变化Plate IChanges of leaves cell viability under water content 15%±2%treatment
30%±2%水分处理叶片(见图版II),东农冬麦1号品种10月21日(见图版II-1)、11月11日(见图版II-2)细胞活力无差异,都表现为少部分细胞失活,到12月2日(见图版II-3),有活力细胞只占很小比例,至12月26日(见图版II-4),细胞全部失活。济麦22在10月21日(见图版II-7)和11月11日(见图版II-8)细胞活力较好,到12月2日(见图版II-9)则全部失活。品种间比较,10月21日至12月2日东农冬麦1号细胞活力较好,12月26日以后则无差异。

图版II30%±2%水分处理叶片细胞活力变化Plate IIChanges of leaves cell viability under water content 30%±2%treatment
45%±2%水分处理叶片(见图版III),东农冬麦1号从10月21日至12月2日(见图版III-1、III-2、III-3),随取样日期推迟,细胞活力逐渐减小,到12月26日(见图版III-4)所有细胞均死亡。济麦22品种10月21日(见图版III-7)失活较少,11月11日(见图版III-8)失活较重,到12月2日(见图版III-9)则全部失活。
品种间相比,从10月21日至12月2日,东农冬麦1号细胞活力好于济麦22,12月26日以后则无活力。
正常管理(CK)条件下叶片(见图版IV),东农冬麦1号细胞活力随取样时间推移(见图版IV-1~6),死细胞比例逐渐增多。
济麦22在10月21日(见图版IV-7)和11月11日(见图版IV-8)细胞活力较高,12月2日(见图版IV-9)活力明显变小。品种间,10月21日、11月11日相比,细胞受伤害程度接近,从12月2日开始细胞活力出现较大差异,表现为东农冬麦1号细胞活力要好于济麦22。东农冬麦1号叶片在所有6期取样中都有活细胞被检测到,而济麦22从12月26日至2月4日(见图版IV-10~12)则无活细胞存在。

图版III45%±2%水分处理叶片细胞活力变化Plate IIIChanges of leaves cell viability under water content 45%±2%treatment
2.2 叶鞘不同取样日期及不同品种间细胞活力分析
15%±2%水分处理叶鞘(见图版V),东农冬麦1号叶鞘细胞活力在10月21日至12月2日(图版V-1~3)差异明显,死细胞比例随取样日期变化逐渐增多;12月26日至2月4日(见图版V-4~6),活细胞均所剩无几,彼此间差异较小。济麦22品种在10月21日(见图版V-7)取样时细胞失活较少,11月11日(见图版V-8)取样时细胞失活比例明显增加,至12月2日(见图版V-9)则无活细胞存在。两品种间相比较,在不同取样时期,东农冬麦1号细胞活力都好于济麦22。

图版IVCK水分处理叶片细胞活力变化Plate IVChanges of leaves cell viability under water content control treatment
30%±2%水分处理叶鞘(见图版VI),东农冬麦1号细胞活力随取样日期变化逐渐降低,10月21日(见图版VI-1)和11月11日(见图版VI-2)细胞活力差异不明显,12月2日(见图版VI-3)取样与11月11日差异明显,12月26日以后(见图版VI-4~6)细胞活力均较小。济麦22从10月21日至12月 26日(见图版VI-7~10)活力差异明显,活细胞比例逐渐减小,至1月14日之后(见图版VI-11~12)所有细胞均失去活力。品种间比较,在各取样期,东农冬麦1号细胞活力均好于济麦22。
45%±2%水分处理叶鞘(见图版VII),东农冬麦1号叶鞘细胞10月21日至12月2日(见图版VII-1~3)细胞活力差异较大,细胞活力逐渐减小,12月26日(见图版VII-4)与12月2日活力接近,1月14日(见图版VII-5)、2月4日(见图版VII-6)活力严重降低。济麦22在10月21日(见图版VII-7)和11月11日(见图版VII-8)相比活力差异不明显,活力均较高,至12月2日(见图版VII-9),细胞活力明显变小。
品种间相比较,济麦22品种叶鞘细胞只在前三期取样中存在活力,而东农冬麦1号在全部六期取样中均有活细胞存在。

图版V 15%±2%水分处理叶鞘细胞活力变化Plate V Changes of Leaf sheath cell viability under water content 15%±2%treatment
CK处理叶鞘(见图版VIII),东农冬麦1号10月21日至12月26日(见图版VIII-1~4)细胞活力差异明显,细胞活力逐渐减小,至1月14日以后(见图版VIII-5~6)仍有少部分细胞存在活力。济麦22从10月21日至12月2日(见图版VIII-7~9)细胞活力明显变小,12月26日(见图版VIII-10)与12月2日(见图版VIII-9)活力差异较小,1月14日以后(见图版VIII-11、VIII-12)则无活细胞出现。品种间,10月21日两品种细胞活力均较高,11月11日和12月2日东农冬麦1号细胞活力大于济麦22,12月26日品种间差异不明显,1月14日以后东农冬麦1号好于济麦22。

图版VI 30%±2%水分处理叶鞘细胞活力变化Plate VI Changes of Leaf sheath cell viability under water content 30%±2%treatment
2.3 同一品种、同一部位土壤水分间细胞活力分析
东农冬麦1号叶片,在所有4个水分处理下,10月21日、11月11日,细胞活力受水分影响较小,均表现为少部分细胞失活。12月2日开始,CK管理条件下细胞活力要好于另外3个土壤水分处理,12月26日至1月14日,在CK处理条件下仍有一小部分有活力细胞存在,而另外3个水分处理中则全部失活。封冻期以后土壤水分亏缺(15%± 2%、30%±2%)和水分过多(45%±2%)都会影响东农冬麦1号叶片细胞活力。
济麦22叶片,10月21日取样的4个水分处理中,均有很少一部分细胞死亡;11月11日取样,15%±2%和45%±2%水分处理失活最多,30%±2%处理次之,而CK处理下失活最少。从12月26日开始,不同土壤水分处理下,均未检测到有活力细胞存在。
东农冬麦1号叶鞘,在10月21日的4个水分处理中,细胞活力无明显差异,都表现为小部分细胞失活。11月11日,15%±2%和45%±2%水分处理下叶鞘细胞失活较重,而30%±2%和CK两个处理死细胞相对较少。至12月2日CK水分处理下活细胞比重要高于其他处理。从12月26日取样开始,其活力在水分处理间差异不明显,都表现为失活严重。

图版VII 45%±2%水分处理叶鞘细胞活力变化Plate VII Changes of Leaf sheath cell viability under water content 45%±2%treatment
济麦22叶鞘,10月21日至12月2日,15%± 2%土壤水分处理下细胞活力最低,而其他3个处理细胞活力差异不明显。12月26日取样,30%± 2%和CK两个处理均有少量有活力细胞存在,而另两个处理细胞全部失活。1月14日和2月4日,所有水分处理下的细胞均全部失活。

图版VIII CK水分处理叶鞘细胞活力变化Plate VIII Changes of Leaf sheath cell viability under water content control treatment
3 讨论与结论
3.1 试验品种及取样部位对细胞活力的影响
在pH为中性时,中性红染料能够进入活细胞和死细胞中,在活体细胞中中性红染料易解离并存留在其内部,经清水漂洗后不溢出而使细胞染成红色,而在死细胞中不易解离,经漂洗后染料较容易溢出,不能使细胞染色[8]。本试验中东农冬麦1号叶鞘从10月21日(日平均温度:4℃)至第二年2月 4日(日平均温度:-19.5℃)的4个土壤水分处理下都能检测到有活力细胞,而叶片则只在CK条件下各取样时期检测到有活力细胞,而在其他土壤水分处理下从12月26日(日平均温度:-21℃)至2月4日细胞均全部失活。济麦22叶鞘在15%±2%、30%±2%、45%±2%和对照CK(35%~40%)4个水分处理下,分别在12月2日(日平均温:-17.5℃)、1月14日(日平均温度:-22.5℃)、12月26日、1月14日时细胞全部失活,而叶片细胞则分别在12月2日、12月2日、12月2日和12月26日全部失活。综上可知,同一土壤水分处理下,受负积温变化影响,抗寒性弱品种对低温反应更为敏感,即在封冻早期受低温伤害即较明显,而抗寒性强品种要在进入封冻期后一段时间才表现出低温伤害,所以利用中性红染色法鉴定育种材料抗寒性时,除要求外部环境均匀一致外,还应在不同时期进行鉴定,这样才能更好区别多个育种材料间抗寒性差异,可在封冻初期、进入封冻期后10 d以及进入封冻期后20 d分别进行鉴定。品种间比较,随着取样日期的延后,两个品种叶片、叶鞘的死细胞比例都有逐渐增大趋势,在低温驯化期和封冻初期,细胞活力受品种影响较小,从封冻后20 d开始,东农冬麦1号细胞活力要高于济麦22。从取样部位上来看,本试验中,同一品种上,叶鞘检测出活细胞的取样次数多于叶片,说明地上部感受温度要比地下部低,地上部细胞所受伤害大,叶鞘细胞活力好于叶片。
3.2 土壤水分对细胞活力的影响
水分是构成植物体的主要组成部分,植物在水分胁迫下会通过自身内含物含量和自身结构变化来适应胁迫条件,如引起小麦幼苗MDA含量增加[9]、栓皮栎幼苗叶片SOD活性升高[10]、小麦叶片POD活性增加[11]、水稻功能叶片可溶性蛋白含量增加[12]、小麦根长缩短,根重下降[13]等变化,但当胁迫条件超过其自身承载能力时,对自身造成不可逆伤害。本研究表明,同一品种同一取样时期同一部位在不同土壤水分处理下其细胞活力存在较大差异,即在封冻初期(11月11日)抗寒性较强品种在严重水分亏缺(15%±2%)条件下其细胞失活也较重,而此时水分适宜条件(CK处理)下抗寒性较弱品种细胞失活较少。可见,土壤水分对保持细胞活力意义重大,土壤水分胁迫会加速低温条件下冬小麦植株细胞死亡,越冬期间适宜土壤水分(CK,35%~40%)更有利于植株细胞存活,在此水分含量上其细胞活力最大。
[1]佟明耀,郑家兰,李卓夫,等.高寒地区超强抗寒新品种“东农冬麦1号”的选育[J].东北农业大学学报,2010,41(7):1-4.
[2]冯玉磊,王晓楠,付连双,等.寒地冬小麦返青期抗氧化特性[J].麦类作物学报,2012,32(3):547-550.
[3]付连双,王晓楠,王学东,等.低温驯化及封冻后不同抗寒性小麦品种细胞超微结构的比较[J].麦类作物学报,2010,30(1): 66-72.
[4]刘灿,王金伟,李卓夫,等.低温驯化阶段不同抗寒性冬小麦品种生理代谢的比较[J].东北农业大学学报,2009,40(11):14-17. [5]王金伟,刘灿,李卓夫,等.低温驯化期冬小麦生理指标变化的比较[J].东北农业大学学报,2009,40(9):1-5.
[6]付连双,王晓楠,李卓夫,等.土壤水分对冬小麦越冬期间植株电导率的影响[J].作物杂志,2011(3):38-41.
[7]邹琦.植物生理生化实验指导[M].北京:中国农业出版社, 1995:94-96.
[8]Levitt J.The hardiness of plants[M].New York:Academic,1956: 278.
[9]费明慧.水分胁迫对小麦幼苗生长及抗氧化能力影响[J].吉林师范大学学报:自然科学版,2011(1):43-44.
[10]张文辉,段宝利,周建云,等.不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应[J].植物生态学报,2004, 28(4):483-490.
[11]陈鹏,彭海霞,张静.水分胁迫对小麦叶片抗病相关酶活性的诱导[J].西北农业学报,2011,20(2):56-61.
[12]刘少华,陈国祥,胡艳,等.高产杂交稻“两优培九”功能叶抗氧化系统对水分胁迫的响应[J].作物学报,2004,30(12):1244-1249.
[13]张永清,苗果园.水分胁迫条件下有机肥对小麦根苗生长的影响[J].作物学报,2006,32(6):811-816.
Difference comparison of winter wheat cell viability under different soil water content treatments
FU Lianshuang1,WANG Xiaonan1,LI Zhuofu1,XIE Dongwei1, SUN Yinglu1,ZHENG Wei2
(1.School of Agriculture,Northeast Agricultural University,Harbin 150030,China;2.Jiamusi Branch of Heilongjiang Academy of Agricultural Science,Jiamus Heilongjiang 154007,China)
Dongnongdongmai1 and Jimai22 which were different in cold tolerance were used as experimental materials,and four soil absolute water content such as 15%±2%,30%±2%,45%±2%and normal treatment(CK,35%-40%)were designed,the changes in cell vitality under double effects of low temperature and moisture were studied during over winter.The results showed that cell vitality in leaves and leaf sheath of two varieties were slowly decreased trend with sampling date changing;the cell vitality had significant difference between two varieties in the 20th after freeze up period,and Dongnongdongmai1 was less than Jimai22 in the extent of damage in the cell,under different soil water treatments,the cell vitality was the highest under CK(normal soil water management),and the cell vitality in leaf sheath was better than that in the leaf.
soil water content;cell viability;winter wheat
S572
A
1005-9369(2014)01-0006-11
2013-03-23
黑龙江省高校寒地作物品种改良与生理生态重点开放实验室开放基金项目(hdzw-006);黑龙江省教育厅新农村建设科技服务项目
付连双(1978-),男,副教授,博士,研究方向为小麦遗传育种。E-mail:fulianshuang@163.com
时间2014-1-9 22:49:28[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140109.2249.015.html
付连双,王晓楠,李卓夫,等.不同土壤水分处理下冬小麦细胞活力差异比较[J].东北农业大学学报,2014,45(1):6-16.
Fu Lianshuang,Wang Xiaonan,Li Zhuofu,et al.Difference comparison of winter wheat cell viability under different soil water content treatments[J].Journal of Northeast Agricultural University,2014,45(1):6-16.(in Chinese with English abstract)
