HPLC 法测定肝友胶囊中的槲皮素、木犀草素、对羟基苯乙酮、滨蒿内酯和白藜芦醇
2014-01-13谭雄斯曹娟娟
谭雄斯, 曹娟娟
(肇庆医学高等专科学校,广东 肇庆526020)
肝友胶囊为中药复方制剂,源于卫生部药品标准中药成方制剂第十一册,由火炭母、茵陈、虎杖、丹参、鸡骨草、茯苓、山楂、郁金、泽泻、神曲茶、鸡爪芋、白背叶根、党参、蚕砂、白术等十五味药物组成。具有清热利湿、疏肝解郁、活血化瘀、健脾导滞的功效,可用于急性、迁延性及慢性病毒性肝炎诸症的治疗[1-3]。原质量标准仅对方中丹参和虎杖进行了显微鉴别,未对方中药味的主要成分进行定量测定,不能有效地控制产品的质量和疗效。火炭母、茵陈和虎杖为方中主要药物,火炭母具有清热利湿、凉血解毒的功效,可用于湿热泄泻、痢疾,黄疸,咽喉肿痛,湿热疮疹等症的治疗;茵陈具有清利湿热、利胆退黄的功效,可用于黄疸尿少,湿温暑湿,湿疮瘙痒等症的治疗;虎杖具有利湿退黄、清热解毒、散瘀止痛、止咳化痰的功效,可用于湿热黄疸,淋浊,带下,风湿痹痛,痈肿疮毒,水火烫伤,经闭,癓瘕,跌打损伤,肺热咳嗽等症的治疗。同时槲皮素和木犀草素为火炭母主要成分,对羟基苯乙酮和滨蒿内酯为茵陈主要成分,白藜芦醇为虎杖主要成分,本实验采用高效液相梯度洗脱法对火炭母中槲皮素、木犀草素和茵陈中对羟基苯乙酮、滨蒿内酯以及虎杖中的白藜芦醇进行测定方法研究,为完善该制剂质量标准提供依据,能有效控制产品的内在质量,确保人民用药安全有效。
1 试药与仪器
高效液相色谱仪(日本岛津LC-10ATVP 型,岛津自动进样器SIL-10ADVP);ANASTAR 色谱数据工作站;SPD-1OAVP 型紫外可见检测器(日本岛津公司);槲皮素(批号100081-200907,纯度96.5%)、木犀草素(批号111520-200504)、对羟基苯乙酮(批号111897-201001)、滨蒿内酯(批号111511-201102,纯度97.2%)和白藜芦醇(批号111535-200502)对照品均来源于中国食品药品检定研究院;肝友胶囊(每粒装0.3 g;产品批号分别为130713,130718,130725)购于广东益和堂制药有限公司;磷酸(分析纯,广州化学试剂二厂);冰醋酸(色谱纯,天津市科密欧化学试剂有限公司);甲醇、乙腈(色谱纯,天津市康科德科技有限公司)。
2 方法与结果
2.1 槲皮素和木犀草素的测定[4-14]
2.1.1 色谱条件 Hypersil C18色谱柱(4.6 mm ×250 mm,5 μm);柱温为室温;流动相A 为甲醇-乙腈(4 ∶1),流动相B 为0.6%磷酸溶液,梯度洗脱(0 ~15 min,25% A;15 ~30 min,25% →60%A;30 ~40 min,60%A);检测波长360 nm;体积流量0.7 mL/min。在此条件下槲皮素和木犀草素与其他组分分离效果良好,以木犀草素计理论塔板数应不低于2 500。
2.1.2 检测波长的选择 分别取槲皮素对照品和木犀草素对照品适量,加甲醇-乙腈-0.6%磷酸溶液(40 ∶10 ∶50)溶解,制备成0.05 mg/mL 的溶液,紫外扫描波长范围定为200 ~400 nm,结果在360 nm 处槲皮素对照品和木犀草素对照品均有最大吸收,故将槲皮素和木犀草素的检测波长定为360 nm。
2.1.3 供试品溶液的配制 取本品适量,倾出内容物,研细,取约2.0 g,精密称定,置具塞锥形瓶中,加甲醇-乙腈(4 ∶1)50 mL,称定质量,采用超声波(300 W,30 kHz)超声提取20 min,用甲醇-乙腈(4 ∶1)补足减失质量,摇匀,过滤,取续滤液,即得。
2.1.4 混合对照品溶液的配制 分别精密称取槲皮素对照品和木犀草素对照品各适量,置具塞锥形瓶中,加甲醇-乙腈(4 ∶1)制成混合对照品溶液(槲皮素为0.019 6 mg/mL,木犀草素为0.010 2 mg/mL)。
2.1.5 阴性对照试验 按肝友胶囊处方比例称取除火炭母的其余药味,按肝友胶囊的生产工艺分别制成缺火炭母的阴性样品,按照上述供试品溶液的配制方法制成缺火炭母的阴性供试品溶液。分别精密吸取10 μL 的供试品溶液、混合对照品溶液和缺火炭母的阴性供试品溶液,按上述方法测定,结果在与槲皮素和木犀草素对照品色谱图相应的保留时间处,供试品溶液色谱图中有吸收峰,而阴性样品色谱图中未显吸收峰,色谱图见图1。

图1 槲皮素和木犀草素的HPLC 图谱Fig.1 HPLC chromatograms of quercetin and luteolin
2.1.6 线性关系考察 精密吸取“2.1.4”项下混 合 对 照 品 溶 液 1、5、10、15、20 μL,按“2.1.1”项下色谱条件进行测定,以峰面积积分值Y 为纵坐标,各组分进样量X 为横坐标分别绘制标准曲线,得回归方程为:槲皮素Y = 4.127 6 ×106X-368.9,r=0.999 1;木犀草素Y=2.964 3 ×106X-638.1,r =0.999 4。槲皮素和木犀草素分别在0.019 6 ~0.392 0 μg、0.010 2 ~0.204 0 μg进样量与峰面积具有良好线性关系。
2.1.7 精密度试验 取“2.1.4”项下混合对照品溶液,按照“2.1.1”项下所述色谱条件,重复进样6 次,测定,记录槲皮素和木犀草素的峰面积,试验结果表明,仪器具有良好的精密度,槲皮素和木犀草素的RSD 分别为0.7%、0.5%。
2.1.8 重复性试验 取同一批样品(产品批号130713),按“2.1.3”项下所述方法制备6 份供试品溶液,分别测定,求得各组分RSD,槲皮素和木犀草素的RSD 分别为0.7%、0.8%。结果表明本法测定具有良好的重复性。
2.1.9 稳定性考察 取上述同一供试品溶液(产品批号130713),分别在室温下放置0、1、2、4、6、8 h 后进样10 μL,测定其峰面积值,槲皮素和木犀草素的RSD 分别为0.5%、0.4%,表明供试品溶液8 h 内基本稳定。
2.1.10 加样回收率试验 取已知含有量(槲皮素0.52 mg/g、木犀草素0.24 mg/g)的同一批样品(批号130713)适量,倾出内容物,研细,取约1.0 g,精密称定,置具塞锥形瓶中,分别精密加入对照品混合溶液25 mL、甲醇-乙腈 (4 ∶1)25 mL,按“2.1.3”项制备加样供试品试液,测定,计算,结果见表1。

表1 槲皮素和木犀草素的加样回收率Tab.1 Results of recovery tests for quercetin and luteolin
2.2 对羟基苯乙酮和滨蒿内酯的测定[15-22]
2.2.1 色谱条件 Hypersil C18色谱柱(4.6 mm ×250 mm,5 μm);柱温为室温;流动相A 为乙腈,流动相B 为0.3% 乙酸溶液,梯度洗脱 (0 ~13 min,37.0% A;13 ~38 min,37.0% →53.0%A;38 ~50 min,53.0%A);检测波长278 nm;体积流量0.7 mL/min。在此条件下对羟基苯乙酮和滨蒿内酯与其他组分基线分离良好,以对羟基苯乙酮计理论塔板数应不低于3 000。
2.2.2 检测波长的选择 分别取对羟基苯乙酮和滨蒿内酯对照品适量,加55%甲醇溶解,制备成0.10 mg/mL 的溶液,紫外扫描波长范围定为200 ~400 nm,结果对羟基苯乙酮和滨蒿内酯对照品分别在277 nm、279 nm 处有最大吸收,故综合考虑将对羟基苯乙酮和滨蒿内酯检测波长定为278 nm。
2.2.3 供试品溶液的配制 取本品适量,倾出内容物,研细,称取约2.0 g,精密称定,置50 mL具塞锥形瓶中,精密加入55%甲醇50 mL,称定质量,超声处理 (功率300 W,频率50 kHz)30 min,用55%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.2.4 混合对照品溶液的制备 分别精密称取对羟基苯乙酮和滨蒿内酯对照品各适量,置50 mL 具塞锥形瓶中,加55%甲醇溶解,并稀释至刻度,摇匀,即得混合对照品溶液 (对羟基苯乙酮为0.037 6 mg/mL 和滨蒿内酯0.192 4 mg/mL)。
2.2.5 阴性对照试验 按肝友胶囊处方比例称取除茵陈的其余药味,按肝友胶囊的生产工艺分别制成缺茵陈的阴性样品,按照上述供试品溶液的配制方法制成缺茵陈的阴性供试品溶液。分别精密吸取10 μL 的供试品溶液、混合对照品溶液和缺茵陈的阴性供试品溶液,按上述方法测定,结果在与对羟基苯乙酮和滨蒿内酯对照品色谱图相应的保留时间处,供试品溶液色谱图中有吸收峰,而阴性样品色谱图中未显吸收峰,色谱图见图2。

图2 对羟基苯乙酮和滨蒿内酯的HPLC 图谱Fig.2 HPLC chromatograms of 4'-hydroxyacetophenone and scoparone
2.2.6 线性关系考察 精密吸取“2.2.4”项下混合 对 照 品 溶 液1、5、10、15、20 μL,按“2.2.1”项下色谱条件进行测定,以峰面积积分值Y 为纵坐标,各组分进样量X 为横坐标分别绘制标准曲线,得回归方程为:对羟基苯乙酮Y =2.035 7 × 106X + 567.1,r = 0.999 6;滨蒿内酯Y=5.351 4 ×106X-625.9,r=0.999 2。对羟基苯乙酮和滨蒿内酯分别在0.037 6 ~0.752 0 μg、0.192 4 ~3.848 μg 范围内进样量与峰面积线性关系良好。
2.2.7 稳定性试验 取上述同一供试品溶液(产品批号130713),分别在室温下放置0、1、2、4、6、8 h 后进样10 μL,测定其峰面积值,对羟基苯乙酮和滨蒿内酯RSD 分别为1.0%、0.7%。结果表明,供试品溶液8 h 内基本稳定。
2.2.8 精密度试验 取“2.1.4”项下混合对照品溶液,按照“2.2.1”项下色谱条件重复进样6次,测定,记录对羟基苯乙酮和滨蒿内酯的峰面积,试验结果表明,仪器具有良好的精密度,对羟基苯乙酮和滨蒿内酯的RSD 分别为0.3%、0.8%。
2.2.9 重复性试验 取上述同一批样品(批号130713),按“2.2.3”项下所述方法制备6 份供试品溶液,分别测定,求得各组分RSD,对羟基苯乙酮和滨蒿内酯的RSD 分别为0.9%、0.9%。结果表明本方法测定重复性良好。
2.2.10 加样回收率试验 取已知含有量(对羟基苯乙酮0.96 mg/g、滨蒿内酯4.78 mg/g)的同一批样品(批号130713)适量,剪碎,混匀,取约1.0 g,精密称定,置50 mL 具塞锥形瓶中,分别精密加入对照品混合溶液25 mL,加50%甲醇稀释至刻度,按“2.2.3”项制备加样供试品溶液,测定,计算,结果见表2。
2.3 白藜芦醇的测定[23-26]
2.3.1 色谱条件 Hypersil C18色谱柱(4.6 mm ×250 mm,5 μm);柱温为室温;乙腈-水(30 ∶70)为流动相,体积流量0.7 mL/min,检测波长302 nm。在此条件下白藜芦醇及其他组分均达到基线分离,理论塔板数以白藜芦醇计算应不低于2 000。
2.3.2 检测波长的选择 取白藜芦醇对照品适量,加流动相溶解,并稀释制成0.05 mg/mL 的溶液,紫外扫描波长范围定为200 ~400 nm,结果白藜芦醇在302 nm 处有最大吸收,故选用302 nm 作为白藜芦醇的检测波长。

表2 对羟基苯乙酮和滨蒿内酯加样回收率Tab.2 Results of recovery tests for 4'-hydroxyacetophenone and scoparone
2.3.3 供试品溶液的配制 取样品适量,倾出内容物,研细,取约1.0 g,精密称定,置具塞锥形瓶中,加甲醇50 mL,称定质量,采用超声波(300 W,30 kHz)超声25 min,用甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
2.3.4 对照品溶液的制备 精密称取白藜芦醇对照品适量,加甲醇制成0.071 4 mg/mL 的对照品溶液。
2.3.5 阴性对照试验 按肝友胶囊处方比例称取除虎杖的其余药味,按肝友胶囊的生产工艺分别制成缺虎杖的阴性样品,按照“2.3.3”项制成缺虎杖的阴性供试品溶液。分别精密吸取10 μL 的供试品溶液、混合对照品溶液和缺虎杖的阴性供试品溶液,按上述方法测定,结果在与白藜芦醇对照品色谱图相应的保留时间处,供试品溶液色谱图中有吸收峰,而阴性样品色谱图中未显吸收峰,色谱图见图3。
2.3.6 线性关系考察 分别精密吸取对照品溶液1、5、10、15、20 μL,按“2.3.1”项下色谱条件进行测定,以峰面积积分值Y 为纵坐标,各组分进样量X 为横坐标分别绘制标准曲线,得回归方程为:Y=2.657 8 ×106X +513.7,r =0.999 3。白藜芦醇在0.071 4 ~1.428 0 μg 进样量与峰面积线性关系良好。
2.3.7 精密度试验 取“2.3.4”项下混合对照品溶液,按照“2.3.1”项下所述色谱条件,重复进样6 次,测定,记录白藜芦醇的峰面积,试验结果表明,仪器具有良好的精密度,RSD 为0.8%。

图3 白藜芦醇的HPLC 图谱Fig.3 HPLC chromatograms of resveratrol
2.3.8 稳定性试验 取上述同一供试品溶液(批号130713),分别在室温下放置0、1、2、4、6、8 h后进样10 μL,测定其峰面积,考察样品溶液的稳定性,结果表明,供试品溶液8 h 内基本稳定,白藜芦醇RSD 为0.6%。
2.3.9 重复性试验 取同一批样品 (批号130713),按“2.3.3”项制备6 份供试品溶液,分别测定,求得各组分RSD,结果表明本方法重复性较好,白藜芦醇RSD 为0.7%。
2.3.10 加样回收率试验 取已知含有量(白藜芦醇3.56 mg/g)的同一批样品(批号130713),倾出内容物,研细,取约0.5 g,精密称定,置具塞锥形瓶中,分别精密加入对照品溶液25 mL、甲醇25 mL,按“2.3.3”项制备加样供试品试液,测定,计算,结果见表3。
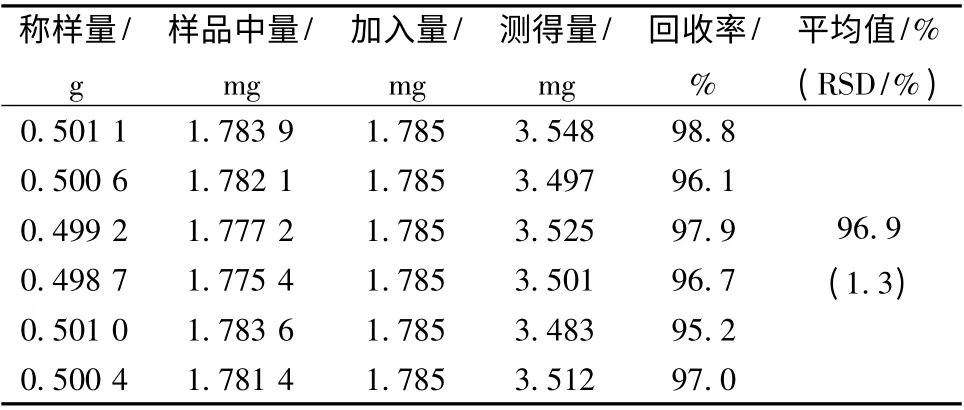
表3 白藜芦醇回收率试验Tab.3 Results of recovery tests for resveratrol
2.4 样品测定 取3 批样品按“2.1”项下槲皮素和木犀草素测定方法、 “2.2”项下对羟基苯乙酮和滨蒿内酯测定方法和“2.3”项下白藜芦醇测定方法测定,各成分定量测定结果见表4。
表4 样品测定结果(±s,n=3)Tab.4 Results of content determination (±s,n=3)
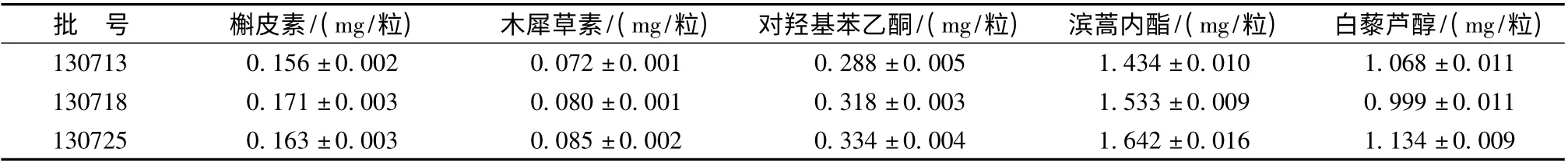
表4 样品测定结果(±s,n=3)Tab.4 Results of content determination (±s,n=3)
批 号 槲皮素/(mg/粒) 木犀草素/(mg/粒) 对羟基苯乙酮/(mg/粒) 滨蒿内酯/(mg/粒) 白藜芦醇/(mg/粒)1.434 ±0.010 1.068 ±0.011 130718 0.171 ±0.003 0.080 ±0.001 0.318 ±0.003 1.533 ±0.009 0.999 ±0.011 130725 0.163 ±0.003 0.085 ±0.002 0.334 ±0.004 130713 0.156 ±0.002 0.072 ±0.001 0.288 ±0.005 1.642 ±0.016 1.134 ±0.009
3 讨论
3.1 对羟基苯乙酮和滨蒿内酯测定时曾分别采用甲醇-0.02%醋酸水溶液为流动相梯度洗脱、甲醇-0.4%磷酸为流动相梯度洗脱和乙腈-0.3%醋酸溶液为流动相梯度洗脱进行试验,结果以甲醇-0.02%醋酸水溶液为流动相梯度洗脱时滨蒿内酯分离效果良好,但对羟基苯乙酮无法达到基线分离;以甲醇-0.4%磷酸为流动相梯度洗脱时对羟基苯乙酮分离效果好,但滨蒿内酯拖尾现象严重;以乙腈-0.3%醋酸溶液为流动相梯度洗脱时对羟基苯乙酮和滨蒿内酯均能达到基线分离,峰形较好。故选用乙腈-0.3%醋酸溶液为流动相梯度洗脱。
3.2 实验中曾采用甲醇-乙腈(4 ∶1)与0.6%磷酸溶液、乙腈与0.3%醋酸溶液和乙腈-水为流动相以不同比例梯度洗脱同时测定以上5 种成分,以甲醇-乙腈(4 ∶1)与0.6%磷酸溶液为流动相不同比例梯度洗脱时,槲皮素和木犀草素能达到基线分离,而对羟基苯乙酮、滨蒿内酯和白藜芦醇分离效果差,不能有效分离;以乙腈与0.3%醋酸溶液为流动相不同比例梯度洗脱时,槲皮素和木犀草素达不到有效分离,白藜芦醇拖尾现象严重。故本实验采用不同流动相对处方中的5 个主要成分进行了定量测定,以有效控制产品的质量。
[1] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010:223-224,附录30,附录36.
[2] 国家药典委员会. 国家药品标准中药成方制剂第十一册[S]. 北京:人民卫生出版社,1998:92.
[3] 国家药典委员会. 中华人民共和国药典:1977 年版一部[S]. 北京:人民卫生出版社,1978:122-123.
[4] 任恒春,万定荣,谷 婧,等. 火炭母化学成分的研究[J]. 天 然 产 物 研 究 与 开 发,2012,24 (10):1387-1389,1411.
[5] 王金香. 火炭母药材HPLC 指纹图谱研究[J]. 中国实验方剂学杂志,2011,17(15):96-98.
[6] 刘明霞,季秀丽,薛梅芩. 火炭母药材HPLC 指纹图谱研究[J]. 亚太传统医药,2011,7(6):50-51.
[7] 叶青美,江仁望,田海妍,等. RP-HPLC 法测定火炭母药材中鞣花酸的质量分数[J]. 暨南大学学报:自然科学与医学版,2011,32(3):300-303.
[8] 杜利云,却 翎,莫亚雄. 火炭母胶囊的薄层色谱鉴别[J]. 云南中医中药杂志,2008,29(6):49-50.
[9] 胡 莹,梅全喜. 火炭母的研究进展[J]. 亚太传统医药,2009,5(1):121-123.
[10] 朱 华,高 雅,张可锋,等. 不同产地火炭母中槲皮素的含量测定方法研究[J]. 中药新药与临床药理,2009,20(6):557-559.
[11] 谢贤强,吴 萍,林立东,等. 火炭母化学成分的研究[J]. 热带亚热带植物学报,2007,15(5):450-454.
[12] 林焕泽,吴秀荣. 高效液相色谱法测定火炭母中槲皮苷的含量[J]. 中国医院药学杂志,2006,26(8):1032-1033.
[13] 王永刚,谢仕伟,苏薇薇. 火炭母化学成分研究[J]. 中药材,2005,28(11):1000-1001.
[14] 杜憬生,蔡 宇. 不同产地火炭母中槲皮素及木犀草素的含量测定[J]. 中药材,2012,35(2):243-245.
[15] 韦庆宁,李小凤,史柳芝,等. 茵陈多糖的提取及含量测定[J]. 国外医学:医学地理分册,2012,33(3):207-208,217.
[16] 郭红玲,曹佩雪,潘卫东,等. 不同制法茵陈蒿汤中栀子苷、对羟基苯乙酮、大黄酸的含量比较[J]. 时珍国医国药,2011,22(11):2614-2615.
[17] 孙冬梅,谭志灿,毕晓黎,等. 茵陈配方颗粒红外光谱分析及总黄酮含量测定[J]. 湖北中医药大学学报,2011,13(6):30-33.
[18] 王乾丽,梁 会,曹佩雪,等. 不同制法茵陈蒿汤中京尼平-1-β 龙胆二糖苷的含量比较[J]. 贵阳中医学院学报,2011,33(5):37-39.
[19] 王 涛,梁 会,曹佩雪,等. 不同制法茵陈蒿汤中没食子酸、绿原酸的含量比较[J]. 贵阳中医学院学报,2011,33(5):10-12.
[20] 万 丽,叶 娉,周 立,等. 茵陈中总香豆素的含量测定[J]. 成都中医药大学学报,2009,32(2):75-77.
[21] 王 静,张玉萍,刘 影. 不同采收期茵陈中对羟基苯乙酮的含量测定[J]. 现代中药研究与实践,2011,25(3):7-9,14.
[22] 王金鹏,王 砚,任华忠,等. HPLC 测定复方茵陈糖浆中龙胆苦苷[J]. 中国实验方剂学杂志,2011,17(11):71-73.
[23] 汪冬庚,刘宝华,黄金华,等. RP-HPLC 紫外、荧光检测法测定虎杖中白藜芦醇及其苷含量的比较研究[J]. 南通大学学报:医学版,2013,33(1):17-20.
[24] 潘 磊,晏 健. 高效液相色谱法测定虎杖有效成分白藜芦醇的含量[J]. 中国中医药现代远程教育,2013,11(3):152-153.
[25] 于 艳,于世杰,修丽丽,等. HPLC 法同时测定祛瘀清胰颗粒中虎杖苷和黄芩苷[J]. 中成药,2013,35(5):964-966.
[26] 刘亚蓉,宋 霞,刘海青,等. 双波长RP-HPLC 法同时测定妇科十味片中芍药苷、阿魏酸[J]. 中成药,2013,35(6):1222-1224.
