补体C3、C4在家犬脑出血模型中的变化
2014-01-11唐协林姚庆宁夏祥国黎乾科刘胜华肖奎顾应江钟俊赵超
唐协林,姚庆宁,夏祥国,黎乾科,刘胜华,肖奎,顾应江,钟俊,赵超
补体C3、C4在家犬脑出血模型中的变化
唐协林1,姚庆宁1,夏祥国2,黎乾科1,刘胜华1,肖奎1,顾应江2,钟俊1,赵超1
目的:研究家犬脑出血(ICH)模型补体C3、C4与血肿周围脑水肿的关系。方法:30只家犬随机分为正常对照组、影像组和血肿组3组各10只。正常对照组不予任何处理,影像组和血肿组采用立体定向自体血脑内注入法制备ICH模型。正常对照组和影像组分别于术后6 h、24 h、72 h、5 d、7 d检测外周静脉血C3、C4含量,各时间点行头颅CT扫描并计算水肿比值。血肿组分别于术后6 h、24 h、72 h、5 d、7 d检测血肿液C3、C4含量。各时间点采用Purdy PD评分标准评估神经功能缺损。结果:影像组和血肿组外周血、血肿液补体C3、C4含量术后6 h开始升高,72 h达高峰,之后逐渐下降。影像组、血肿组与正常对照组比较,术后6 h外周血C4差异无统计学意义(>0.05),其余同时间点两两比较差异均有统计学意义(<0.05)。ICH后Purdy PD评分即有所下降,72 h下降为最低,之后逐渐升高。结论:ICH后补体C3、C4激活可能参与血肿周围脑水肿形成和继发性脑损害的病理过程。
脑出血;免疫组织化学;补体C3;补体C4;脑水肿
目前脑出血(intracerebral hemorrhage,ICH)发病率、致残率、死亡率均较高。ICH的病理生理机制尚未完全阐明,缺乏有效的治疗手段。ICH后血脑屏障破坏,血浆中补体进入脑组织,补体沿着不依赖抗体的经典途径激活,打破了脑组织内原有补体系统平衡。在补体蛋白家族中,C3含量最多,而且是3条激活途径(经典激活途径、旁路激活途径和甘露聚糖结合凝集素激活途径)中的共同通路,是补体系统发挥免疫作用的关键分子,因此常被作为补体激活的指标。C4在介导补体损伤方面也有至关重要的作用。本实验观察补体C3、C4在实验性ICH家犬外周血、血肿液中含量,探讨ICH血肿周围脑水肿及继发性脑损害的可能机制,为临床治疗ICH提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性家犬30只,由泸州医学院实验动物中心提供,体质量11~13 kg,月龄10~12月,血常规正常。
1.1.2 主要试剂 与仪器 C3(T503025)、C4(T403025)、CA(T502270)、Pf(407016)试剂购于美国Beckman Coulter公司,批内变异系数均<10%;羊抗人C3、C4多克隆抗体购于美国Sigma公司;免疫组化试剂盒及二氨基联苯胺(diaminobenzidine,DAB)显色剂均购于北京中山生物技术有限公司;Array 360全自动特定蛋白分析系统、Array 360免疫化学分析系统购于美国Beckman公司。
1.2 方法
30只家犬随机分为正常对照组、影像组、血肿组3组各10例,各组月龄、体质量、神经功能比较差异无统计学意义(>0.05)。正常对照组不予任何处理,于实验开始后6 h、24 h、72 h、5 d、7 d取小腿外侧静脉血;影像组和血肿组制备ICH模型,影像组分别于术后6 h、24 h、72 h、5 d、7 d取外周静脉血,各时间点(n=2)行头颅CT扫描;血肿组沿原手术创道分别取术后6 h、24 h、72 h、5 d、7 d血肿液,各时间点(n=2)进行神经功能缺损评分。采用立体定向自体血脑内注入法制备ICH模型:①手术前禁食12 h,禁水4 h。术前氯胺酮15 mg/kg、阿托品0.04 mg/kg、安定10 mg肌肉注射麻醉,小腿外侧静脉置入留置针后,以3%戊巴比妥钠40 mg/kg缓慢静脉推注。当犬出现呼吸浅慢,角膜反射迟钝,舌外伸时,为麻醉适度表现。如出现呼吸抑制,立即静推尼可刹米0.375 g、洛贝林3 mg,挤压胸廓辅助呼吸后可恢复自主呼吸。②CT定位:犬俯卧于CT检查床上,头部剪毛后用特殊缚带固定,以外耳道连线为基线并用龙胆紫标记,采用Siemens 16 CT Sensation扫描机垂直进行扫描(冠状位)。扫描参数:层厚5 mm,层距5 mm,视野(FOV)160,电压120 kV,共扫18层面。选择避开鼻窦气腔及侧脑室、清晰显示基底核的扫描层面作为目标注血层面(ScanN)。测量左/右基底核皮质目标血肿部位(C)距基线的垂直距离(F)、中线矢状缝(B)旁开的距离(L)和进针深度(D)。测量后采用参数:F:21.5~23.5 mm,L:10.0~11.5 mm,D:19.0~21.0 mm。③立体定向和钻颅:犬俯卧于手术台上,头固定于金属头架,锁紧耳棒和门齿钩。消毒、铺巾。以左/右耳棒所在平面为基准零平面,在定器上固定外径1 mm的硬膜外麻醉穿刺针并使该针其重合于该平面。转动螺旋钮,让穿刺针沿着矢状缝前移22.5 mm,然后转动平移11 mm,此时针尖所在处即为穿刺点,用龙胆紫标记后移开定向器,以标记进针点为中心,沿前后方向切开长约2~2.5 cm的皮肤切口,全层切开头皮直至颅骨,向两侧牵开暴露骨面。启动钻头为2 mm的电动颅钻钻透颅骨,达硬膜时有落空感。撤除颅钻,无菌纱布暂时覆盖伤口。④取血和注血:犬下肢侧卧,充分暴露大腿根部,剪毛、消毒,于股动脉搏动最强点处,用5 mL注射器(针头呈30°进针)先取新鲜股动脉血4 mL(不抗凝),立即插入固定在立体定向器上穿刺针穿刺针上,选用硅胶注射器轻推1 mL以排尽气泡或气血混合液。定向器移回原来的定向穿刺位置,固定定向器,转动垂直移动旋钮,使穿刺针的针尖由头皮向颅内进针20 mm,将不含气体的3 mL新鲜股动脉血用微量泵缓慢匀速注入目标血肿区,注血时间5 min,注血压力<100 mmHg(1 mmHg= 0.133 kPa)。注血完毕后留针10 min。拔针后迅速用骨蜡封骨孔。生理盐水及庆大霉素冲洗切口后,逐层缝合,无菌纱布包扎伤口。青霉素80万U肌肉注射,预防感染。
1.3 评估指标
1.3.1 于各时间点按注血前的位置、参数和方法复查CT,观察目标血肿区的高信号改变、血肿周围脑水肿以及有无硬膜下血肿、侧脑室积血。采用多田氏公式计算血肿和水肿体积及水肿比值(血肿体积/水肿体积)。
1.3.2 使用Array 360全自动特定蛋白分析系统采用免疫散射比浊法检测各时间点外周静脉血和/或血肿液中补体C3、 C4含量。取待测血清200 μL加样,使用Array 360免疫化学分析系统及配套试剂自动分析完成。水肿脑组织免疫组化染色采用SABC法:石蜡切片经常规脱蜡,梯度酒精浸泡后充分水洗,置于3%H2O2甲醛溶液中15 min,浸入0.01 mol/L、pH 6.0枸橼酸盐缓冲液中,加热至95℃,成适当浓度混悬液。一抗为羊抗人C3、C4多克隆抗体(滴度1∶5 000),进行免疫组化染色和DAB显色。
1.3.3 采用Purdy PD评分标准评估神经功能缺损:于术后6 h、24 h、72 h、5 d、7 d,对脑出血模型犬的意识、行为、转头、转圈及偏盲五方面进行神经功能缺损评分。总得分最低分为2分,表示完全正常,无神经功能缺陷;总得分最高分为11分,表示动物意识丧失或死亡。
1.4 统计学处理
2 结果
2.1 影像学检查
影像组和血肿组在基底核皮质的目标血肿区均有高密度阴影(图1)。按多田氏公式计算血肿体积为(2.75±0.45)mL,血肿形态:类圆形或椭圆形15个,不规则形3个,条带形2个。

图1 术后6 h(A)、24 h(B)犬ICH后冠状位CT
2.2 C3、C4含量检测
影像组和血肿组外周血、血肿液补体C3、C4含量在术后6 h开始升高,至72 h达高峰,5 d时较72 h有所下降,7 d后降得更低。影像组、血肿组与正常对照组比较,术后6 h外周血C4差异无统计学意义(>0.05),其余同时间点两两比较差异均有统计学意义(<0.05),见表1。
表1 3组犬外周血及血肿液补体C3、C4含量及水肿比值比较(±s)
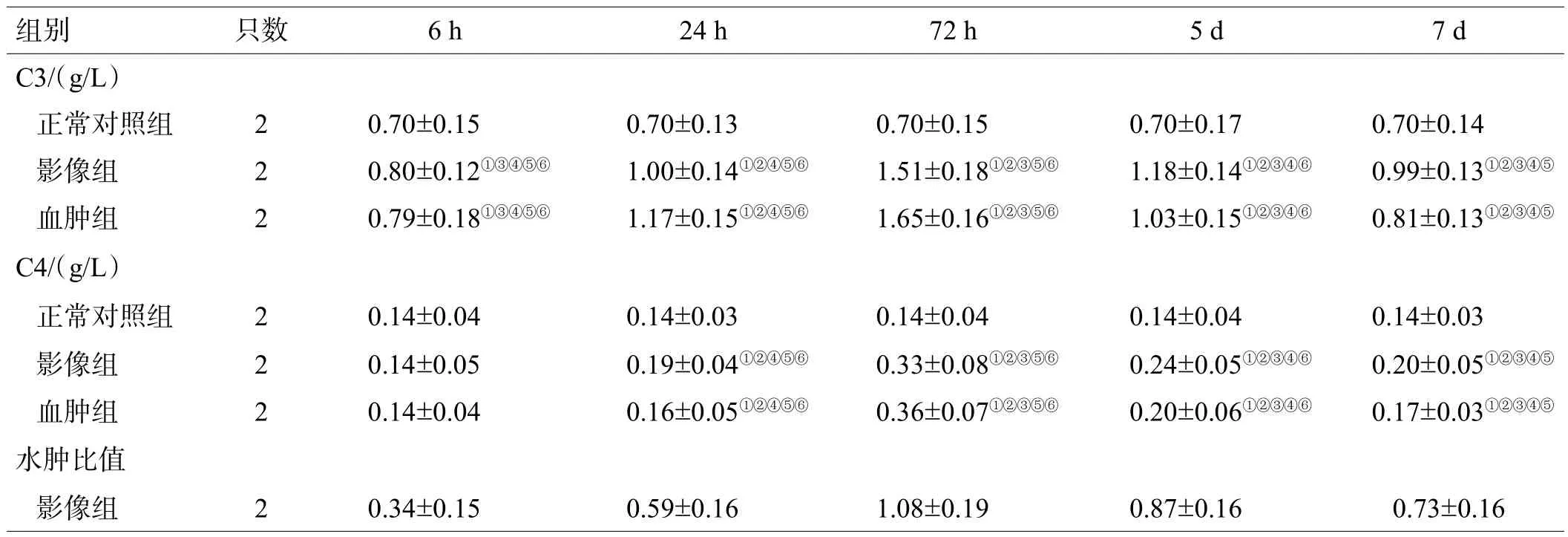
表1 3组犬外周血及血肿液补体C3、C4含量及水肿比值比较(±s)
注:正常对照组、影像组测量外周血;影像组还测量水肿比值;与正常对照组比较,①<0.05;与6 h比较,②<0.05;与24 h比较,③<0.05;与72 h比较,④<0.05;与5 d比较,⑤<0.05;与7 d比较,⑥<0.05
组别 只数 6 h 24 h 72 h 5 d 7 d C3/(g/L)正常对照组 2 0.70±0.15 0.70±0.13 0.70±0.15 0.70±0.17 0.70±0.14影像组 2 0.80±0.12①③④⑤⑥ 1.00±0.14①②④⑤⑥ 1.51±0.18①②③⑤⑥ 1.18±0.14①②③④⑥ 0.99±0.13①②③④⑤血肿组 2 0.79±0.18①③④⑤⑥ 1.17±0.15①②④⑤⑥ 1.65±0.16①②③⑤⑥ 1.03±0.15①②③④⑥ 0.81±0.13①②③④⑤C4/(g/L)正常对照组 2 0.14±0.04 0.14±0.03 0.14±0.04 0.14±0.04 0.14±0.03影像组 2 0.14±0.05 0.19±0.04①②④⑤⑥ 0.33±0.08①②③⑤⑥ 0.24±0.05①②③④⑥ 0.20±0.05①②③④⑤血肿组 2 0.14±0.04 0.16±0.05①②④⑤⑥ 0.36±0.07①②③⑤⑥ 0.20±0.06①②③④⑥ 0.17±0.03①②③④⑤水肿比值影像组 2 0.34±0.15 0.59±0.16 1.08±0.19 0.87±0.16 0.73±0.16
2.3 神经功能缺损评分
影像组术后6 h、24 h、72 h、5 d、7 d,Purdy PD评分分别为(5.68±1.57)、(6.34± 1.54)、(8.95±1.25)、(4.88±1.25)、(3.58± 1.47)分;血肿组术后6 h、24 h、72 h、5 d、7 d,Purdy PD评分分别为(5.26±1.83)、(6.50±1.39)、(8.77±1.42)、(4.47±1.53)、(3.64±1.23)分。影像组、血肿组均出现与血肿部位相对应的神经系统定位体征,其中运动障碍表现为血肿对侧下肢瘫痪或以下肢瘫为主的对侧偏瘫,意识状态表现为清醒、嗜睡和昏睡,无昏迷或死亡。正常对照组无特殊变化,Purdy PD评分为(2.35±0.40)分。影像组和血肿组各时间点两两比较,差异有统计学意义(<0.05)。
3 讨论
近年研究发现,中枢神经系统炎症、变性疾病、脑血管疾病中都有补体激活,并参与病理生理过程[1-4]。血浆中的补体蛋白主要由肝细胞分泌,中枢神经系统内补体蛋白主要由胶质细胞释放[5,6]。测定补体C3、C4即可充分反映补体的活化及功能状态[7]。
正常情况下,脑内补体系统与补体抑制处于动态平衡,故不发生病理损伤反应。本研究发现ICH后犬外周血中补体C3、C4在术后6 h较正常对照组升高较少,可能是因为ICH初期,血脑屏障破坏,补体成分进入血肿周围组织,补体成分消耗,此时自身免疫系统生成补体的速度比消耗慢,组织损伤较轻,脑水肿较轻,CT水肿比值较低。24 h后自身免疫系统被充分调动,72 h达高峰,此时神经功能缺损评分值升高达峰值,组织损伤最严重,脑水肿也达高峰,CT水肿比值明显升高。自身补体成分的损害也激活了机体的自身免疫监控系统,以纠正生成过多的补体,第5天时的补体成分、神经功能缺损评分值有所下降,7 d时进一步下降。由于血脑屏障已被破坏,水肿比值下降缓慢,第7天时水肿比值仍较高。ICH后,由于血脑屏障的破坏,血浆和中枢神经系统抗原物髓鞘、磷脂、凝血酶、血红蛋白均能激活脑内补体,使补体C3、C4等形成催化作用的C3a等,引起免疫级链反应,导致继发性脑损伤。此外,通过破坏的血脑屏障,浸润血肿周围组织炎性细胞本身也具有合成及分泌补体的功能,进一步加重脑损害。激活的补体能促进肥大细胞、嗜碱性细胞释放炎症介质组织胺,破坏血脑屏障;还具有趋化因子作用,使大脑白细胞聚集,释放溶酶体,破坏细胞的结构和功能[8]。C3还可引起巨噬细胞释放TNF-α、IL-6等细胞因子,进一步加剧脑组织的病理损伤反应[9]。Hua等[10]在大鼠ICH的实验中发现,血肿周围组织补体及激活后的过敏毒素明显增加,同时补体抑制剂也相应增加,但增加的幅度低于补体,使补体激活系统与抑制系统平衡破坏,导致免疫损伤。过度激活的补体系统成为脑缺血/再灌注二次损伤的重要原因。研究表明,补体激活后可对神经元起细胞毒作用,加重脑组织的损害[11]。Huang等[12]通过大鼠实验发现,补体激活抑制剂有神经元保护作用,提示补体激活可能加重脑组织的损伤。至于补体激活加重脑组织损害的机制,可能与补体末端复合物的溶细胞作用有关。此外,近年来有一些研究提示,补体激活的一些中间产物似还参与神经元的凋亡[11],其机制还不清楚。中枢神经系统炎症反应的基本标志是小胶质细胞的激活和白细胞的浸润。激活的小胶质细胞和浸润的白细胞可释放炎性因子[13]。炎性因子之间存在正反馈调节作用,引起神经元损伤[14]。补体的激活和膜攻击复合物的生成可破坏细胞,调节细胞释放TNF-α、IL-6、IFN-γ等炎性因子、自由基和MMPs等[10]。高表达的MMP-9可破坏血管基底膜并降解细胞外基质,增加血管通透性,使蛋白质等大分子物质进入脑组织,导致脑水肿和脑组织损伤加重,而脑水肿和脑组织损伤导致炎性细胞浸润和炎性因子的进一步释放[15]。补体激活在ICH后脑水肿形成的病理生理过程中发挥了重要作用[16,17],C3、C4激活是继发性脑损害的重要因素[18,19]。Mocco等[20]报道,小鼠局灶性脑缺血后,C3缺陷小鼠可观察到神经保护效应,梗死体积缩小34%,补体C3a受体拮抗剂可起到神经保护作用。抑制补体C3、C4激活可能阻碍ICH后脑水肿程度及继发性损害。
通过对家犬ICH动物模型的研究,本研究发现ICH后家犬外周血、血肿液中补体C3、C4含量、水肿比值、脑水肿组织补体C3和C4的表达及神经功能缺损评分值的动态变化总的趋势保持一致,补体激活与脑损伤、脑水肿程度时间上的相关性,表明补体C3、C4激活是ICH后血肿周围脑水肿形成以及继发性脑损害的重要因素,为临床减轻ICH后脑水肿程度以及继发性脑损害提供理论依据。
[l]Rus H,Cudrici C,David S,et al.The complement system in central nervous system diseases[J].Autoimmunity,2006,39:395-402.
[2]Madaliński K,Cedzyński M,Swierzko A,et al. Complement system--an effector of inflammatory reactions. Possibilities of complement regulation in ischaemic diseases[J]. Przegl Epidemiol,2007,61:701-711.
[3]Zhou J,Fonseca MI,Pisalyaput K,et al. Complement C3 and C4 expression in C1q sufficientand deficientmouse modelss of Alzheimer's Disease[J].J Neurochem,2008,106: 2080-2092.
[4]Smith SS,Ludwig M,Wohler JE,et al. Deletion of both ICAM-1 and C3 enhances severity of experimental autoimmune encephalomyelitis compared to C3-deficient mice[J].Neurosci Lett,2008,442:158-160.
[5]王金保,聂发传,顾建腾,等.坐骨神经结扎大鼠脑脊液补体异常活化与痛觉过敏的关系[J].第三军医大学学报,2008,30:138-141.
[6]Stevens B,Allen NJ,Vazquez LE,et al.The classical complement cascade mediates CNS synapse elimination [J].Cell,2007,131: 1164-1178.
[7]van Beek J,Bernaudin M,Petit E,et al. Expression of receptors for complement anaphylatoxins C3a and C5a following permanent focal cerebral ischemia in the mouse [J].Exp Neurol,2000,161:373-382.
[8]高晨,张建生,丁永忠,等.重型颅脑损伤患者血清免疫球蛋白和补体C3、C4的动态变化及临床意义 [J].中国急救医学,2006,26: 895-897.
[9]林杰,张军,张国华.脑出血血肿周围组织损伤的炎症反应机制 [J].国外医学·脑血管疾病分册,2004,12:517-517.
[10]Hua Y,Xi G,Keep RF,et al.Complement activation in the brain afterexperimental intracerebral hemorhage[J].J Neurosurg,2000, 92:1016-1022
[11]MoranBP,GasqueP.Expressionof complement in the brain:role inhealth and disease[J].Immunol Today,1996,l7:461-466.
[12]Huang J,Kim LJ,MeMey R,et al.Neuronal protection in stroke by all slex-glycosylated complement inhibitory protein[J].Science,1999, 285:595-599.
[13]XueM,DelBigioMR.Intracortieal hemorrhage injury in rats relationship between blood fractions and brain cell death[J].Stroke, 2000,31:1721-1727.
[14]Zhang X,Li H,Hu S,et al.Brain edema after intracerebral hemorrhage in rats:the role of inflammation [J].NeurolIndia,2006,54: 402-407.
[15]Héry C,Sébire G,Peudenier S,et al. Adhesion to human neurons and astrocytes of monocytes:the role of interaction of CR3 and ICAM-1 and modulation by cytokines[J].J Neuroimmunol,1995,57:101-109.
[16]Karwacki Z,Kowiański P,Witkowska M,et al. The pathophysiology of intracerebral haemorrhage[J].Folia Morphol(Warsz),2006, 65:295-300.
[17]HoffJT,XiG.Brain edemafrom intracerebral hemorrhage [J].Acta Neurochir Suppl,2003,86:11-15.
[18]Yang S,Nakamura T,Hua Y,et al.The role of complement C3 in intracerebral hemorrhage-induced brain injury [J].J Cereb Blood Flow Metab,2006,26:1490-1495.
[19]You Z,Yang J,Takahashi K,et al.Reduced tissue damage and improved recovery of motor function after traumatic brain injury in mice deficient in complement component C4[J].J Cereb Blood Flow Metab,2007,27:1954-1964. [20]Mocco J,Mack WJ,Ducruet AF,et al. Complement component C3 mediates inflammatory injury following focal cerebral ischemia[J].Circ Res,2006,99:209-217.
Change of Complement C3 and C4 Levels in Dogs after Intracerebral Hemorrhage


Objective:To study the correlation between perihematomal edema and levels of complements C3 and C4 in intracerebral hemorrhage (ICH)dogs.Methods:Thirty dogs were randomly divided into normal control group,imaging group and hematoma group equally.The normal control group had received no treatment whereas the ICH model was established in both the imaging and hematoma groups by stereotactic injection of autologous anti-coagulated blood into the brain.The peripheral blood C3 and C4 contents in the control and imaging groups were measured respectively at 6 h,24 h,72 h,5 d,7 d after surgery,while head CT scan was performed and the ratio of edema were calculated at each time point.Neurological deficits were evaluated by the Purdy PD standard. Results:In the ICH dogs,the C3 and C4 levels in peripheral blood and hematoma liquid began to increase 6 h after ICH and reached the peak at 72 h,then decreased.The C4 level at 6 h in the imaging and hematoma groups showed no significant difference compared to the control group (>0.05).However,at other time points investigated,the C3,C4 levels in the imaging and hematoma groups were significantly higher than those in the control group (<0.05).Purdy PD score began to decrease after ICH,and further decline at 72 h,then gradually return to baseline.Conclusion:The activation of complements C3 and C4 may be involved in the cerebral edema formation around hematoma and secondary brain damage after ICH.
intracerebral hemorrhage;immunohistochemistry;C3;C4;brain edema
R741;R743.34
A DOI 10.3870/sjsscj.2014.03.010
1.三台县人民医院(川北医学院附属三台医院)神经外科四川 绵阳 621100 2.泸州医学院附属医院神经外科四川 泸州646000
2013-08-19
姚庆宁txlint@163.com
