YC-1对Aβ寡聚体毒性的保护作用及其相关机制
2014-01-11闫鹏乔娴刘金玲孙圣刚郑瑾
闫鹏,乔娴,刘金玲,孙圣刚,郑瑾
YC-1对Aβ寡聚体毒性的保护作用及其相关机制
闫鹏,乔娴,刘金玲,孙圣刚,郑瑾
目的:探讨YC-1针对 Aβ寡聚体(ADDLs)毒性的保护作用及其相关机制。方法:原代培养小鼠皮质神经元及星形胶质细胞混合培养体系,应用不同浓度ADDLs(500 nmol/L、1 μmol/L、2 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L)干预以模拟体外AD模型,应用YC-1对此模型进行干预,以CCK-8法检测细胞活力,Western blot检测NICD及缺氧诱导因子-1α(HIF-1α)水平,采用real-time PCR检测Caspase-3 mRNA水平。结果:浓度≥2 μmol/L的ADDLs干预明显降低混合培养体系细胞活力水平,并呈现浓度依赖性(<0.01)。10 μmol/L ADDLs持续干预4 h显著降低细胞活力(<0.01),YC-1可明显拮抗这种毒性作用(<0.01)。10 μmol/L ADDLs持续干预4 h明显上调NICD及HIF-1α水平(<0.01),YC-1可拮抗这种提高(<0.05或0.01)。10 μmol/L ADDLs干预4 h显著提高Caspase-3的mRNA水平(<0.01),YC-1可显著抑制这种上调(<0.05)。结论:ADDLs表现出对原代培养小鼠皮质神经元及星形胶质细胞混合培养体系的毒性作用,YC-1可发挥保护作用。
YC-1;Aβ寡聚体;保护作用;NICD;缺氧诱导因子-1α
阿尔茨海默病(Alzheimer's disease,AD)是老年期痴呆的主要类型,β淀粉样蛋白(Amyloid β protein,Aβ)沉积是其主要的病理特征之一,这同时也是AD较为公认的发病机制假说之一。目前越来越多的研究表明,Aβ寡聚体(Aβ-derived diffusible ligands,ADDLs)为主要的毒性形式,在AD的发病中扮演重要角色[1]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是缺氧条件下呈高表达的一种蛋白分子,对细胞或组织的缺氧状态有一定的保护作用[2]。目前HIF-1α在AD中的研究较少,且结论缺乏一致性[3,4]。同时有研究发现HIF-1α与Notch-1信号通路之间存在交互作用[5,6]。YC-1因抑制HIF-1α表达及影响HIF-1α稳定性,而表现出潜在的抗肿瘤特性[7]。本研究基于ADDLs对原代培养小鼠皮质神经元及星形胶质细胞混合培养体系的毒性作用,探讨YC-1针对这种毒性作用所发挥的保护性作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 新生0~2 d乳小鼠购自华中科技大学同济医学院实验动物中心。
1.1.2 主要试剂 DMEM/F12(1∶1)、胎牛血清购自美国Hyclone公司;F12培养基、Neurobasal及B27购自美国Gibco公司;CCK-8试剂盒购自美国SAB公司;Aβ1-42及YC-1购自美国Sigma公司;六氟异丙醇(Hexafluoroisopropanol,HFIP)、甘油醛 -3-磷 酸 脱 氢 酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)抗体、GFAP抗体、MAP2抗体购自美国Santa Cruz公司;Notch-1抗体购自美国Epitomic公司;HIF-1α抗体购自美国Ebioscience公司。
1.2 方法
1.2.1 ADDLs制备 依文献报道[8]制备ADDLs:冰上将 Aβ1-42溶于 HFIP至1 mmol/L,室温置1 h,后于4℃通风橱内使溶剂充分挥发至干燥膜状,-80℃保存。使用前以DMSO溶解干燥的膜状药物至5 mmol/L,充分振荡溶解,以4℃无酚红的F12培养基进一步溶解药物至100 μmol/L,4℃孵育过夜。14 000g离心10 min,留取上清即为ADDLs的F12溶液,BCA法测定蛋白浓度。鉴于ADDLs的异质性,其摩尔浓度为其相应初始Aβ1-42单体蛋白的摩尔浓度(一般ADDLs的产率大概为55%~75%)。
1.2.2 小鼠皮质神经元和星形胶质细胞混合体系的原代培养 新生小鼠经酒精消毒后置于超净台中,解剖分离大脑半球皮质,剥除脑膜并剪碎后经消化、终止消化、吹打、过滤、离心、重悬等步骤后至均匀单细胞悬液,计数,接种于预先经多聚赖氨酸包被的孔板中。细胞培养箱中维持培养2~6 h后全量更换维持培养基(含2%体积B27的Neurobasal),后每周予1/3量更换维持培养基。
1.2.3 免疫荧光法查看混合培养体系 原代培养至第7天,终止培养,全量吸弃培养基,PBS漂洗3遍,先后经历甲醛固定、穿孔、封闭、一抗[GFAP抗体(1∶150)]孵育、二抗孵育、第二种一抗[MAP2抗体(1∶200)]孵育、二抗孵育等系列步骤,期间间隔数次PBS漂洗,后于倒置荧光显微镜下激发相应的荧光并观察拍照。
1.2.4 CCK-8法检测细胞活力 接种于96孔板的原代培养混合体系至第7天,给予不同浓度ADDLs(500 nmol/L及1、2、5、10、20 μmol/L)干预4 h,同时设置空白对照,每组分别设置5个副孔。于干预终点前2 h在各实验孔加入CCK-8试剂10 μL/孔,继续孵育2 h后于酶标仪上检测450 nm吸光值。以“相应实验孔吸光值-无细胞空白对照孔平均吸光值”为最终指标进行相应分析。据此选择后续ADDLs干预浓度。
1.2.5 Western blot检测 HIF-1α、NICD(Notch-1 intracellular domain)蛋白表达 6孔板所培养原代混合体系第7天,给予10 μmol/L ADDLs分别干预2、4、8、12、24 h,并同时设置空白对照。于干预终点将各培养孔中的细胞分别收集并RIPA裂解法提取总蛋白。以BCA法检测蛋白浓度。按照既定流程进行蛋白电泳、转膜、封闭、一抗[Notch-1(1∶200),HIF-1α(1∶800)]孵育、HRP标记二抗(1∶5 000)孵育等系列步骤后ECL法显像,X光胶片显影、定影。以GAPDH蛋白为内参。BandScan分析胶片灰度值。每批次实验重复5次。
1.2.6 YC-1干预对原代培养混合体系的影响 接种于96孔板的原代培养混合体系至第7天,给予10 μmol/L ADDLs或10 μmol/L ADDLs+10 μmol/L YC-1干预,同时设置空白对照,分别干预4、24 h。①检测细胞活力:于干预终点前2 h行CCK-8法检测相应的细胞活力。②Western blot检测蛋白表达:于干预终点进行总蛋白抽提及相应蛋白表达水平的检测。③Real-time PCR检测Caspase-3 mRNA水平:于干预终点终止培养,吸弃培养基并PBS漂洗后以Trizol法提取混合体系细胞总RNA,并进行含量和纯度测定。按照既定流程进行反转录及RT-PCR。Caspase-3引物为 F(5'-TCTGACTGGAAAGCCGAAAC-3');R(5'-GACTGGATGAAC CACGACCC-3'),产物204 bp。应用△CT法分析结果。同时对扩增产物进行3%琼脂糖凝胶电泳,在凝胶成像系统中获取图像,验证目的基因片段的大小。
1.3 统计学处理
2 结果
2.1 细胞免疫荧光染色
原代培养混合体系体外培养第7天,小鼠皮质细胞MAP-2、GFAP染色阳性,见图1。

图1 倒置荧光显微镜观察原代培养小鼠皮质神经元与星形胶质细胞混合体系(×400)
2.2 不同浓度ADDLs干预后细胞活力
低浓度ADDLs对混合体系的细胞活力无影响;ADDLs浓度≥2 μmol/L时,对细胞活力有显著损害,且损害程度与ADDLs浓度呈明显的正相关(<0.01),见图2。10 μmol/L ADDLs作用4 h可使细胞活力下降约40%,基于本部分实验,笔者选取10 μmol/L作为后续实验中ADDLs的干预浓度。
2.3 ADDLs对原代培养混合体系中HIF-1α及NICD水平的影响
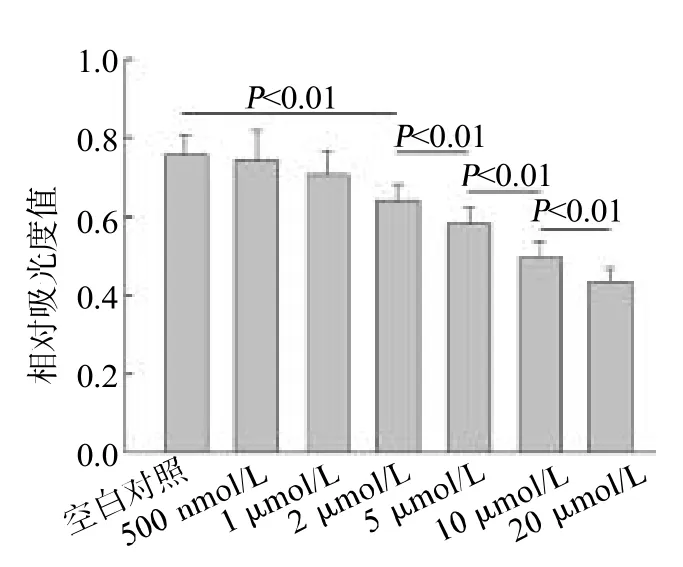
图2 不同浓度ADDLs干预4 h对细胞活力的影响(n=5)
10 μmol/L ADDLs干预后原代培养混合体系中的HIF-1α及NICD水平显著上调,且随干预时间的延长二者均呈现先升高后降低的类似总体趋势,二者的高峰水平均出现在ADDLs干预后8 h,之后表达呈减低趋势,在24 h,HIF-1α蛋白水平尚未降至与空白对照一致的水平,但NICD在24 h的表达水平与空白对照无明显差异,见图3。
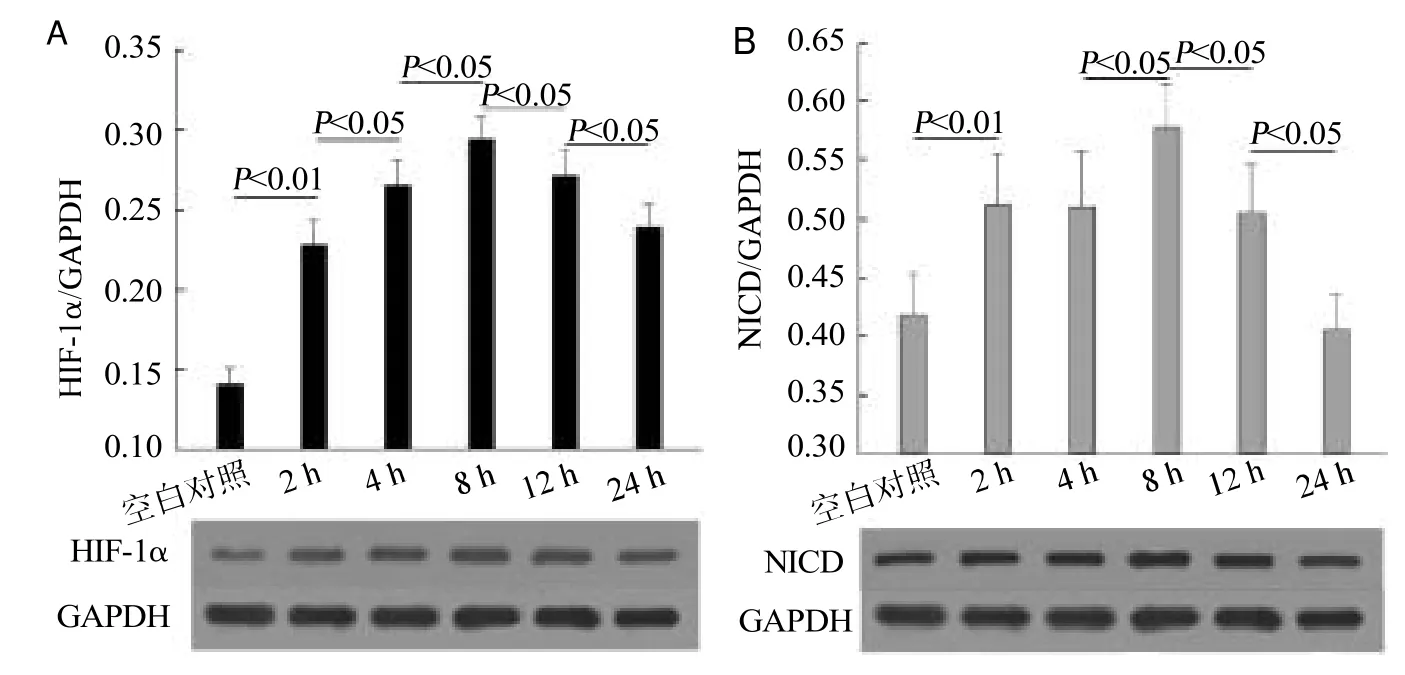
图3 10 μmol/L ADDLs干预不同时长对HIF-1α(A)及NICD(B)水平的影响(n=5)
2.4 YC-1对ADDLs干预下原代培养混合体系细胞活力的影响
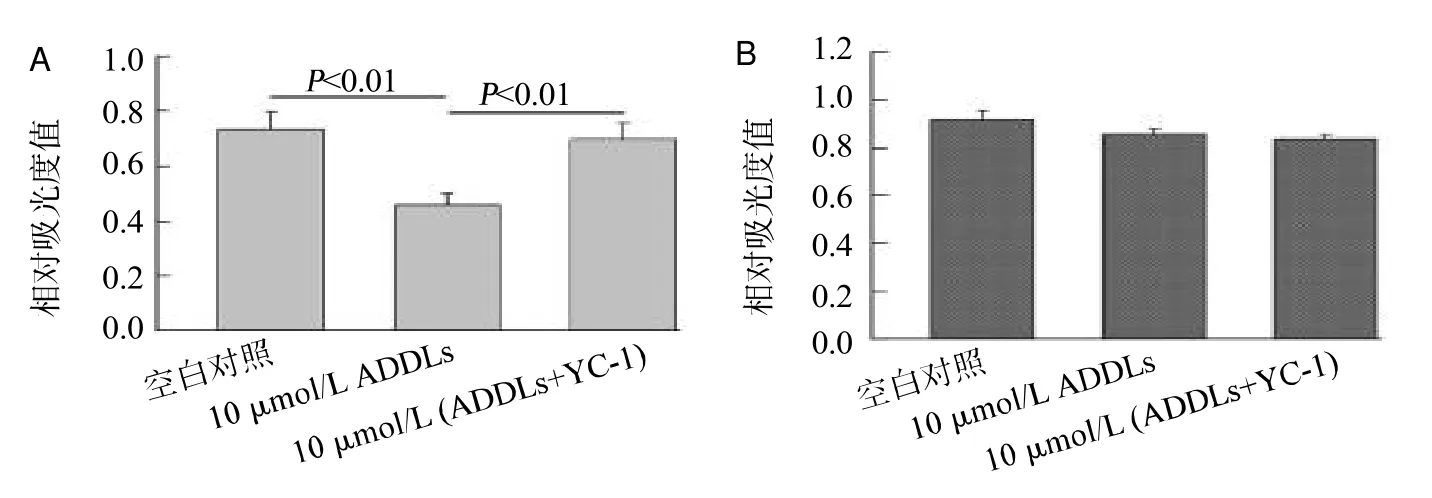
图4 YC-1对ADDLs干预4 h(A)和24 h(B)细胞活力的影响(n=5)
2.5 YC-1对ADDLs干预下原代培养混合体系HIF-1α及NICD水平的影响
ADDLs干预4 h后,原代培养混合体系的NICD及HIF-1α水平均明显升高(<0.01),同时应用YC-1可显著抑制NICD及HIF-1α水平的升高(<0.05或0.01);ADDLs干预24 h后,原代培养混合体系的HIF-1α较空白对照升高(<0.01),但升高幅度较4 h明显减弱,NICD升高程度较4 h类似,同时应用YC-1对HIF-1α水平升高无明显影响,下调ADDLs干预造成的NICD水平升高(<0.01),见图5。

图5 YC-1对ADDLs干预4 h(A)和24 h(B)HIF及NICD表达水平的影响(n=5)
2.6 YC-1对ADDLs干预下原代培养混合体系Caspase-3 mRNA水平的影响
干预4 h后,10 μmol/L ADDLs显著提高 Caspase-3的 mRNA水平(<0.01),同时应用YC-1可抑制Caspase-3 mRNA水平的上调(<0.05);干预24 h后,10 μmol/L ADDLs显著提高 Caspase-3 mRNA水平(<0.01),YC-1并未对Caspase-3 mRNA水平的升高产生明显影响,见图6。
3 讨论
既往研究提示HIF-1α水平异常升高在AD发病中可能扮演重要角色[3,4]。本研究据此应用ADDLs对原代培养小鼠皮质神经元和星形胶质细胞混合体系进行干预以模拟体外AD模型。既往关于评估ADDLs作用的研究基本都是采用单一种类的纯净细胞[4,8,9]。然而脑组织是神经元及胶质细胞等共同组成的有机整体,其中星形胶质细胞占胶质细胞的绝大部分,且数量远大于神经元。鉴于此,本研究采用原代培养小鼠皮质神经元及星形胶质细胞混合体系,以期更大程度接近在体情况。
CCK-8实验显示低浓度ADDLs对原代培养混合体系的细胞活力无显著影响,ADDLs干预浓度≥2 μmol/L时,4 h的干预显著降低细胞活力,且降低程度与ADDLs浓度呈明显的正相关,这与既往研究基本一致[8]。随后,随着10 μmol/L ADDLs干预时间的延长,HIF-1α及NICD水平均表现出先升高后降低的趋势,二者的变化趋势大体一致。NICD为Notch-1受体剪切后的细胞内活性形式,其蛋白水平可在一定程度上反映Notch-1信号通路的活性水平[10]。这提示在ADDLs对原代培养混合体系的毒性作用中HIF-1α及Notch-1信号通路可能存在着某种关联。既往Schubert等[4]应用纯净的星形胶质细胞发现Aβ可一过性上调HIF-1α蛋白水平继而下降,最高峰值出现在Aβ干预4 h,在24 h时HIF-1α水平已降至低于空白对照的水平。本研究中ADDLs诱导的HIF-1α上调高峰值出现在干预后8 h,虽然之后亦呈现出下降的趋势,但24 h时HIF-1α水平仍高于空白对照组,对比分析这种差异可能与神经元及星形胶质细胞之间的相互作用有关,相关机理有待进一步深入探讨。
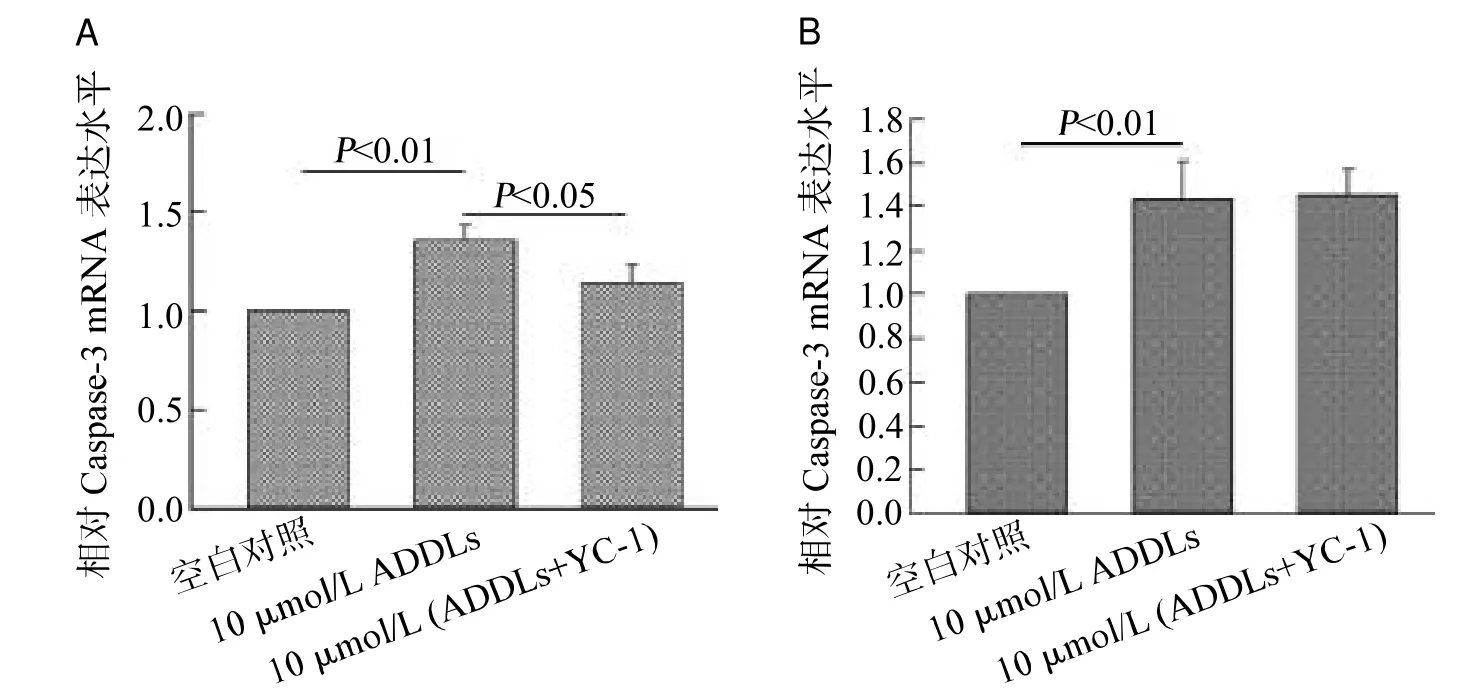
图6 YC-1对ADDLs干预4 h(A)和24 h(B)Caspase-3 mRNA水平的影响(n=5)
在干预 4 h,YC-1表现出针对ADDLs毒性的保护作用,但在24 h却未表现出显著的效果,显示YC-1的保护作用和ADDLs的干预时间有关。考虑到Aβ聚合的时间依赖性进程[9],笔者分析ADDLs在4 h孵育过程中可保持相对稳定的浓度,而24 h ADDLs浓度或许已由于持续37℃孵育聚合为纤维状Aβ而大幅降低,此刻针对ADDLs毒性低微的情况YC-1即不表现出显著的保护性作用。考虑到既往研究发现 HIF-1α可能与Notch-1信号通路存在交互作用,本研究同时检测HIF-1α及NICD的蛋白水平,结果发现,在 4 h,YC-1可同时降低ADDLs所诱导的HIF-1α及NICD水平上调,而24 h YC-1对ADDLs所诱导HIF-1α及NICD水平上调并未表现出显著的影响。这提示YC-1所表现出的保护性作用与其抑制HIF-1α及NICD水平上调相关,同时还提示在ADDLs的毒性作用中HIF-1α及Notch-1信号通路存在相互作用。
Avramovich-Tirosh等[11]发现,利用M30激活HIF-1α及其调控基因可降低Aβ25-35的毒性,提示本研究中ADDLs所诱导的HIF-1α一过性上调可能为一种自我保护机制,但另一方面HIF-1α的上调同时又和Notch-1信号通路相互作用,对神经细胞产生有害的影响。Li等[12]反复用低氧处理SH-5Y细胞之后诱导Aβ增加,同时低氧会上调HIF-1α水平,而Aβ的增加反之又会进一步诱导HIF-1α上调,从而可能形成一种“恶性循环”,这提示YC-1的保护作用可能是干预了这种“恶性循环”。
综上,本研究提示ADDLs的毒性作用与HIF-1α上调及Notch-1信号通路异常活化密切相关,且HIF-1α与Notch-1信号通路的相互作用在ADDLs的毒性作用中可能发挥重要作用,其中HIF-1α可能发挥双面作用。另外,针对ADDLs的毒性作用,YC-1可能通过“抑制HIF-1α上调”及“抑制Notch-1信号通路的异常活化”发挥其保护作用,其中具体相关机理仍需进一步深入探讨。
[1]Cheng IH,Scearce-Levie K,Legleiter J,et al. Accelerating amyloid-β fibrillization reduces oligomerlevels and functionaldeficits in Alzheimer disease mouse models[J].J Biol Chem,2007,282:23818-23828.
[2]Hashmi S,Al-Salam S.Hypoxia-inducible factor-1 alpha in the heart:a double agent?[J]. Cardiol Rev,2012,20:268-273.
[3]Soucek T,Cumming R,Dargusch R,et al. The regulation of glucose metabolism by HIF-1 mediates a neuroprotective response to amyloid beta peptide[J].Neuron,2003,39:43-56.
[4]Schubert D,Soucek T,Blouw B.The induction of HIF‐1 reduces astrocyte activation by amyloid beta peptide[J].Eur J Neurosci,2009, 29:1323-1334.
[5]Du R,Sun W,Xia L,et al.Hypoxia-induced down-regulation ofmicroRNA-34a promotes EMT by targeting the Notch signaling pathway in tubular epithelial cells[J].PloS one,2012,7: e30771.
[6]Gao W,Sweeney C,Connolly M,et al. Notch-1 mediates hypoxia-induced angiogenesis in rheumatoid arthritis[J].Arthritis Rheumatism, 2012,64:2104-2113.
[7]Tsui L,Fong TH,Wang IJ.YC-1 targeting of hypoxia-inducible factor-1αreduces RGC-5 cell viability and inhibits cell proliferation[J].Mol Vis,2012,18:1594-1603.
[8]Zhou Y,Klein WL.AβOligomers-induced toxicity is attenuated in cells cultured with NbActiv4?medium [J].Neurotox Res,2012,22: 335-344.
[9]Prangkio P,Yusko EC,Sept D,et al.Multivariate analyses of amyloid-beta oligomer populations indicate a connection between pore formation and cytotoxicity[J].PloS one,2012,7: e47261.
[10]Ables JL,Breunig JJ,Eisch AJ,et al.Not (ch)just development:Notch signalling in the adult brain [J].Nat Rev Neurosci,2011,12: 269-283.
[11]Avramovich-Tirosh Y,Bar-Am O,Amit T, et al.Up-regulation of hypoxia-inducible factor (HIF)-1 and HIF-target genes in cortical neurons by the novel multifunctional iron chelator anti-Alzheimer drug,M30[J].Curr Alzheimer Res, 2010,7:300-306.
[12]Li L,Zhang X,Yang D,et al.Hypoxia increases Aβgeneration by alteringβ-andγ-cleavage of APP [J].Neurobiol Aging,2009,30: 1091-1098.
Protective Effect of YC-1 Against ADDLs-induced Toxicity and HIF-1α Related Mechanism
Objective:To study the protective effect of YC-1 against ADDLs(Aβ oligomers)-induced toxicity and related mechanism.Methods:Different concentrations (500 nmol/L,1 μmol/L,2 μmol/L,5 μmol/L, 10 μmol/L,20 μmol/L)of ADDLs were used to intervene the primary co-culture system of mouse cortical neurons and astrocytes,and YC-1 was applied at the same time.CCK-8 assays were used to assess cell vitality of co-culture cells.NICD and HIF-1α levels of primary co-culture system were assessed with western blot,and real-time PCR was used to detect apoptosis associated Caspase-3 mRNA level of co-culture system.Results: ADDLs at≥2 μmol/L reduced the cell viability of the co-culture system in a concentration-dependent manner (<0.01).Exposure to 10 μmol/L ADDLs for 4 hours showed obvious toxic effect on the co-culture system(<0.01),while the application of YC-1 significantly attenuated the toxic effect induced by ADDLs(<0.01).The NICD and HIF-1α levels were up-regulated after the exposure of 10 μmol/L ADDLs for 4 hours(<0.01),while the application of YC-1 significantly attenuated the up-regulation of the protein levels(<0.05 or 0.01).The Caspase-3 mRNA level was increased after intervened by 10 μmol/L ADDLs for 4 hours(<0.01),and YC-1 significantly inhibited the increase (<0.05).Conclusion:The toxic effect induced by ADDLs on primary co-culture system of mouse cortical neurons and astrocytes could be protected by YC-1.
YC-1;Aβ-derived diffusible ligands;protective effect;NICD;hypoxia-inducible factor-1α
R741;R741.02
A DOI 10.3870/sjsscj.2014.03.002

华中科技大学同济医学院附属协和医院神经内科武汉430022
国家自然科学基金青年基金(No.81301085)
2013-12-31
郑瑾wickey4083@gmail. com
