水解乳蛋白的制备及在细胞培养中的初步应用
2014-01-09冯玉萍李明生崔梦楠靳冬武龙仕和马忠仁
田 伟 ,冯玉萍,李明生,崔梦楠,靳冬武,龙仕和,马忠仁*
1西北民族大学生命科学与工程学院;2 甘肃省动物细胞工程技术研究中心,兰州 730030
水解乳蛋白是乳蛋白经蛋白酶或肽酶水解的产物,含有丰富的氨基酸和多肽,可为细胞生长提供多种营养成分、贴壁因子及生长因子类似物等[1],广泛用于生物制药、疫苗、食品等行业。Eagle 等[2,3]20 世纪50 年代将水解乳蛋白用于细胞和微生物培养基,随后Mamoru[4],Amiot[5]等分别将水解乳蛋白用于皮肤、器官等多种细胞的培养。我国学者张尔贤[6]于1986 年从原料、酶制剂及产品检测等多个角度探讨了细胞培养用水解乳蛋白的研制过程,这为国内水解乳蛋白的研制奠定了基础。
目前国内水解乳蛋白主要以美国Hyclone 和Gibco 产品为主,开发水解乳蛋白在国内具有广阔的市场前景。试验针对传统工艺水解率低,氨基酸破坏程度高,污染环境等缺陷,选取天然牧区凝乳酶干酪素为原料,用复合蛋白酶水解酪蛋白,以多肽含量和氨基氮含量为指标优化酶解工艺,对所得粗制品进行游离氨基酸等一系列检测。最后选取两种常用的动物细胞进行培养,研究其对动物细胞生长的影响,以期为细胞培养用水解乳蛋白的大规模生产奠定基础。
1 材料与方法
1.1 材料
凝乳酶干酪素为甘肃省动物细胞工程技术研究中心自制;胰酶由西北民族大学生物工程与技术国家民委重点实验室提供(胰蛋白酶1298 U/g;胰淀粉酶17503 U/g;胰脂肪酶7200 U/g);中性蛋白酶购自南宁庞博(20 万U/g);谷胱甘肽标准品购自索莱宝公司。
1.2 仪器与设备
L-8900 氨基酸分析仪(日本日立);SD-1500 喷雾干燥机(上海沃迪科技);BioMate5 紫外分光光度计(美国Thermo Fisher);SG-2 pH 计(美国METTLER TOLEDO);HJ-6A 加热搅拌器(常州国华);LC-6M 离心机(上海离心机械研究所);CKX41 显微镜(OLYMPUS)。
1.3 方法
1.3.1 最佳工艺条件的确定
根据复合酶的最佳使用条件并结合单因素试验结果确定各因素适合的酶解范围,设计L9(34)正交试验,方案见表1。

表1 正交试验方案Table 1 Orthogonal experiment design
1.3.2 水解乳蛋白的制备
配制5%[5]的酪蛋白水溶液,pH 调至8.0,加热至完全溶解,迅速冷却,按L9(34)正交试验筛选得最优组合控制酶解条件,反应结束后将反应体系置于沸水浴中维持10 min,迅速冷却,离心取上清喷雾干燥。
喷干条件:进风温度180 ℃,出风温度90 ℃,风速45 Hz,流速200 mL。
1.3.3 蛋白水解液中氨基氮含量测定
氨基氮含量的测定参考甲醛滴定法[7]。
1.3.4 蛋白水解液多肽含量测定
采用肽键测定法[8]。所得回归方程:Y=0.095X+0.004,R2=1.0000。
1.3.5 游离氨基酸测定
样品前处理[9]:准确移取水解蛋白液于试管中,加入等体积5% 的三氯乙酸,充分震荡摇匀,3800 rpm 离心5 min,除去蛋白,取上清液用0.45 μm 微孔滤膜过滤后上机。
色谱条件:泵1(洗脱溶液)流速:0.100 mL/min;泵2(茚三酮溶液)流速:0.100 mL/min;分析柱温度:50 ℃;反应柱温度:135 ℃;进样体积:20 μL。
1.3.6 细胞培养试验
配制水解乳蛋白终浓度为0.2%含10%胎牛血清的MEM 培养基,用对应浓度的Hyclone 产品作为对照,以1.0 ×104/mL 的细胞浓度接种BHK 和Vero 细胞于96 孔板培养。每隔24 h 观察细胞生长情况,并计数。
2 结果与分析
2.1 最佳工艺条件的确定
2.1.1 水解时间的确定
试验数据显示不同条件下水解时间对氨基氮含量的影响呈现一定规律性,结果见图1。

图1 水解时间对氨基氮的影响Fig.1 The influence of hydrolysis time on amino nitrogen content
水解乳蛋白需具有满足细胞生长所需要的多种氨基酸[6],而氨基氮含量与游离氨基酸含量成正比。从图1 可看出,不同反应条件下,产物中氨基氮含量在反应初期缓慢上升,至6 h 最大,随后缓慢降低至平稳。这是由于反应初期酪蛋白解聚不彻底,与酶结合较少;一段时间后底物彻底解聚,底物上反应位点逐渐被酶分子饱和。因此,水解乳蛋白制备的水解时间为6 h。
2.1.2 工艺条件的优化
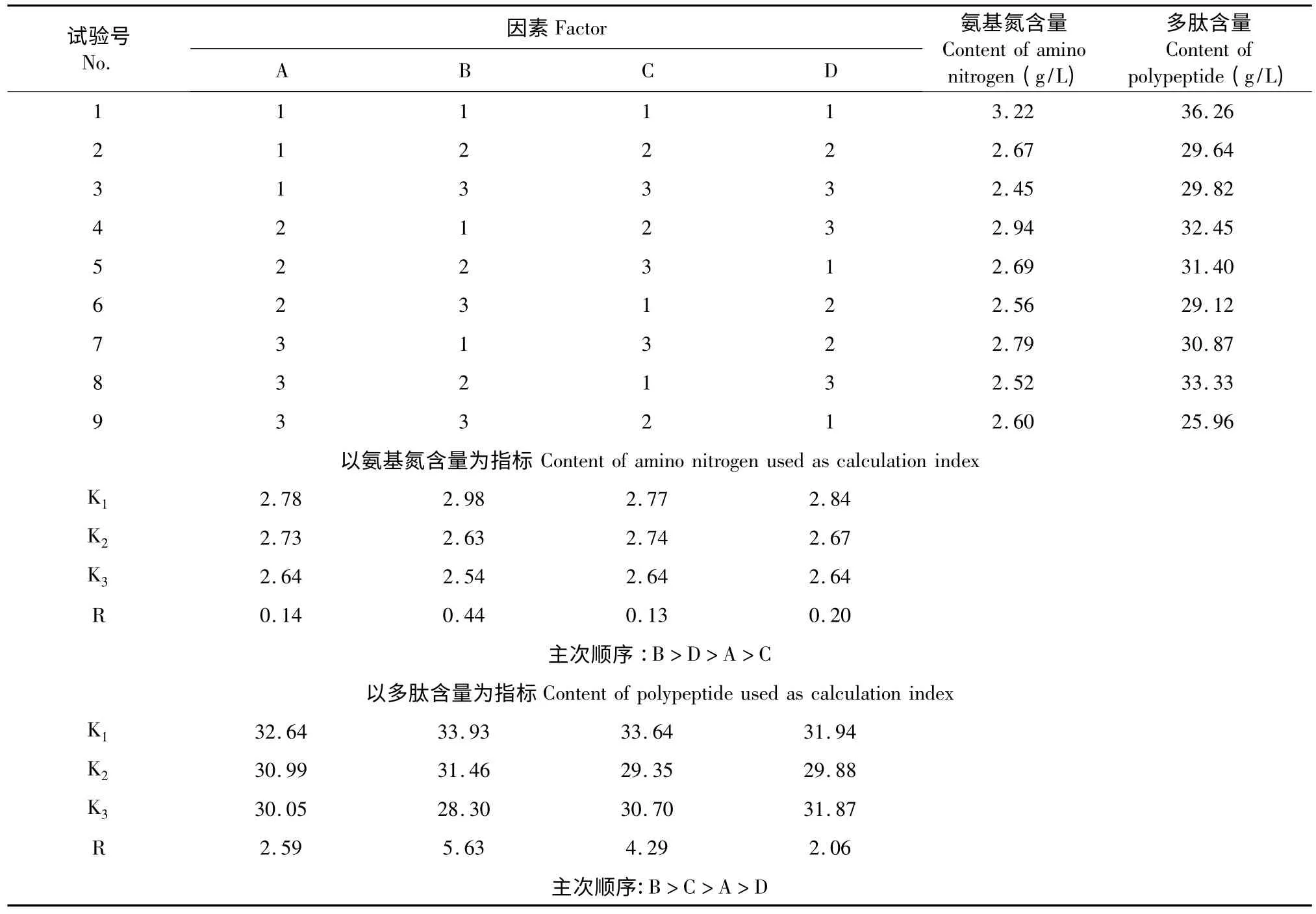
表2 正交试验结果Table 2 Results of orthogonal experiment
2.1.2.1 以氨基氮含量为指标的正交试验结果分析
表2 中以氨基氮含量为指标的极差分析显示,各因素影响氨基氮含量的主次顺序为:酶量>酶组分>温度>pH,最优组合为A1B1C1D1。
2.1.2.2 以多肽含量为指标的正交试验结果分析
由表2 以多肽含量为指标的极差分析显示,各因素对多肽含量影响的主次顺序为:酶量>pH >温度>酶组分,最优组合为A1B1C1D1。
综上所述,各因素对两个指标影响的主次顺序略有差异,但对两者影响的最优组合是一致的。因此,复合蛋白酶(胰酶:中性蛋白酶=2∶1)水解酪蛋白制备水解乳蛋白的最优工艺条件为:40 ℃,pH=7.0,E/S=1∶5 水解6 h。
2.2 对自制水解乳蛋白的检测
按正交试验筛选的最优条件进行不同规模放大验证试验,对产物进行分析,结果如下:
2.2.1 氨基氮及多肽含量测定

表3 不同批次放大验证试验Table 3 Different batches validation test
结果表明,在最优条件下,不同规模放大各指标基本稳定,收率(以酪蛋白算)为40.20%,氨基氮含量平均为3.21 g/L,多肽含量平均为35.63 g/L。
2.2.2 氨基酸组分测定
配制5%的自制水解乳蛋白,以5%的Hyclone水解乳蛋白作对照,测定常用18 种游离氨基酸组分,图谱见图2。

图2 Hyclone 对照品(A)和样品(B)的氨基酸色谱图Fig.2 Chromatograms of Hyclone standard (A)and sample (B)
在细胞培养过程中使用水解乳蛋白目的是满足细胞生长所需要的多种氨基酸,不仅种类上有要求,而且需要保证各种氨基酸的数量[10]。由图2 看出,自制样品分离效果较好,与Hyclone 产品基本一致。自制品和对照品均有17 种常用游离氨基酸,各氨基酸含量有一定的差异,结果见表4。

表4 产物氨基酸组成Table 4 Amino acids composition of the lacto-protein hydrolysate
由表4 可看出,自制水解乳蛋白中赖氨酸、精氨酸、苯丙氨酸含量高,这与胰酶中胰蛋白酶和胰凝乳蛋白酶的专一性有关。其中酸性氨基酸(如谷氨酸、缬氨酸、亮氨酸、酪氨酸、苯丙氨酸等)含量较高,这与酪蛋白有明显酸性是一致的。酪蛋白中超过55%的氨基酸有极性基团,而水解产物中极性氨基酸含量均较高。另外,自制水解乳蛋白氨基酸总量也明显高于对照品,而个别氨基酸却远远低于对照品。这与两者所用原料不同有关。
2.3 水解乳蛋白对细胞生长的影响
通过细胞计数和细胞形态图反应水解乳蛋白对细胞生长的影响,结果如下:
2.3.1 细胞计数
由表5(细胞计数结果)可看出,细胞培养24 h时,BHK 和Vero 细胞的密度分别为4.0 ×104/mL和6.0 ×104/mL,两者均为各自空白的2.0 倍;与Hyclone 产品相比,BHK 和Vero 细胞的密度分别是Hyclone 的1.0 倍和0.86 倍。48 h 时,BHK 和Vero细胞的密度分别为1.5 ×105/mL 和1.6 ×105/mL,是各自空白的5.0 倍和4.0 倍,与Hyclone 产品相比,两细胞密度均是Hyclone 的0.88 倍。因此,添加水解乳蛋白对BHK 和Vero 细胞生长有明显的促进作用,且自制样品和Hyclone 产品相差不明显。

表5 细胞计数结果Table 5 Cell count result
2.3.2 细胞形态图

图3 水解乳蛋白培养BHK 和Vero 细胞Fig.3 BHK and Vero cells cultured with lacto-protein hydrolysate
从图3(细胞整体形态)可看出,添加水解乳蛋白对BHK 和Vero 细胞生长有明显的促进作用。自制水解乳蛋白和Hyclone 产品差别不明显。这是因为蛋白水解物在一定条件下可提高细胞活力,促进细胞增殖。
在细胞培养过程中我们发现添加水解乳蛋白浓度过高或过低对细胞增殖的促进作用均有抑制。这是由于浓度过低营养物质未达到最大化;浓度过高时水解乳蛋白中某种抑制细胞生长的氨基酸浓度过大抑制了细胞的生长,或者某些氨基酸的浓度过大使培养基的某些环境发生改变,对细胞的生长产生抑制。
3 结论
水解乳蛋白制备的最优工艺为:复合蛋白酶(胰酶∶中性蛋白酶=2∶1),40 ℃,pH 7.0,E/S=1∶5(重量比)水解6 h。在此工艺条件下,氨基氮含量3.21 g/L,多肽含量35.63 g/L,喷干收率(以酪蛋白计)达40.20%。自制水解乳蛋白对两种细胞有明显促进作用,且与Hyclone 产品差异不明显。这为细胞培养用水解乳蛋白的大规模生产奠定了基础。
1 Heidemann R,Zhang C,Qi H,et al.The use of peptones as medium additives for the production of a recombinant therapeutic protein in high density perfusion cultures of mammalian cells.Cytotechnology,2000,32:157-167.
2 Eagle H.The specific amino acid requirements of mammalian cells (stain L)in tissue culture.Biol Chem,1955,214:839-852.
3 Eagle H.Amino acid metabolism in mammalian cell cultures.Science,1959,130:432-437.
4 Mamoru TY,Takesi KS,Seiji KY,et al.Milk-protein hydrolyzates and compositions for use as hair and skin treating agent.US5314873,1994-05-24.
5 Amiot J,Ancienne-Lorette L.Enzymatic hydrolysate of milk protein.US/2003/0130195 A1,2003-07-10.
6 Zhang EX(张尔贤).The discussion of several problems in the cell culture Lactoprotein hydrolysate.Amino Acids (氨基酸杂志),1986,1:17-27.
7 Cui M(崔敏),Fu J(傅婕),Chi YL(迟原龙),et al.Comparison of ninhydrin colorimetry and formaldehyde titration in determination of collagen hydrolysate.China Leather(中国皮革),2011,40(7):1-4.
8 Xu J(徐娟),Lv JL(吕嘉枥).Determination of content of peptides in milk protein hydrolysates.Food Sci Tech(食品科技),2010,35:275-278.
9 Zhang H(张华),Xu CD(徐德昌),Yang X(杨鑫),et al.Determination of dissimilative amino acid in cerebroprotein hydrolysate.Mod Inst(现代仪器),2006,1:36-38.
10 Gu RZ(谷瑞增),Liu Y(刘艳),Lin F(林峰),et al.Application and research progress of protein hydrolysates in animal cell culture.Biotechnol Bull(生物技术通报),2012,9:21-27.
