一株链霉菌产生的抗肿瘤活性产物
2014-01-09蒋秋龙杨志钧钱秀萍
蒋秋龙,杨志钧,饶 敏,戈 梅,钱秀萍*
1上海交通大学药学院;2 上海来益生物药物研究开发中心,上海 200240
链霉菌是一类具有丝状分枝细胞的革兰氏阳性细菌,与其他细菌相比具有较为复杂的发育分化过程,而其形态分化的同时又伴随着复杂的生理变化和大量次级代谢产物的生成[1]。链霉菌除了产生临床上应用的大部分抗生素外,还包括抗肿瘤活性产物如Lee[2]等从Streptomyces sp.KACC91015 中分离到的苯二羟基辛烯酮衍生物对肿瘤细胞有抗增殖作用,酶抑制剂如Shin-ya[3]等从S.anulatus 中分离得到telomestatin,该物质是一种强效特异的端粒酶抑制剂,杀虫剂如Lewer[4]等从Streptomyces CP1130分离得到tartrolone C 对舔菜夜蛾具有中等的杀虫作用等等,因此研究链霉菌代谢产物具有重要的意义。作者在一株链霉菌属的放线菌发酵液中,分离出2 个新化合物和4 个已知化合物(图1),且两个新化合物都具有一定的抗肿瘤活性。
1 材料与方法
1.1 仪器与材料
Master cycler epgradient PCR 仪(Eppendorf);Heidoldf Laborata-4000 旋转,蒸发仪;硅胶柱色谱300~400 目;戴安液相色谱仪P680(DIONEX);Agilent 1100 型高效液相色谱仪(Agilent);Q-Tofmicro磁式质谱仪(Waters);BrukerAvanceII-400 型超导核磁共振仪,TMS 为内标;JASCO P2000 旋光仪。
1.2 菌种来源
链霉菌HCCB11431、金黄色葡萄球菌、乳腺癌细胞MCF-7、肝癌细胞PANC-1 和前列腺癌细胞Du-145(菌种和细胞均保藏于上海来益生物药物研究开发中心)。

图1 化合物1~6 的化学结构Fig.1 Chemical structures of compounds 1-6
1.3 菌株HCCB11431 的分子生物学鉴定
采用CTAB 法[5]提取放线菌基因组DNA,提取后用50 μL TER(含RnaseA 20 μg/mL)溶解,以提取的DNA 为模版,利用细菌gyrB 通用引物(gryBPF-1、gryB-PR-2)进行扩增。PCR 扩增条件为:94℃预变性3 min,94 ℃变性1 min,58 ℃复性30 s,72℃延伸5 min,共30 个循环,最后72 ℃延伸10 min。
将获得的序列与GenBank 中已发表的gyrB 基因序列进行同源性比较,选取同源性在95%以上的若干菌株,利用MEGA5.0 软件进行亲缘关系和系统发育树的构建。MEGA 软件相关参数为:统计方法选择Neighbor-Joining,Bootstrap 选择1000,置换法选择Kimura2-parameter model。
1.4 培养基及发酵条件
种子培养基:葡萄糖20 g,甘油20 g,可溶性淀粉20 g,黄豆饼30 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g 和水1 L;发酵培养基:葡萄糖8 g,黄豆饼粉22 g,玉米淀粉40 g,MgSO4·7H2O 1 g,KH2PO40.2 g,NaCl 2 g 和水1 L。发酵过程:先将HCCB11431接种于种子培养基中,摇床培养2 d(28 ℃、220 rpm),再将培养好的种子以8%的接种量接种于5 L的发酵罐中,培养6~7 d。
1.5 产物的分离纯化
发酵结束后,用同等体积的甲醇过夜浸泡,离心得上清液,蒸干后得粗品20 g。粗品用甲醇溶解并用硅胶拌样,氯仿和甲醇体系过硅胶柱,梯度(甲醇浓度10%~90%)洗脱,洗脱液根据TLC 点板和HPLC 分析后合并馏分得到馏分1 和馏分2,蒸干溶剂后复溶于甲醇中。
馏分1 和馏分2 分别用戴安液相色谱仪P680进行分离,制备柱YMC-Pack RP C18(20 mm ×250 mm,5 μm);柱温:30 ℃;流动相:A 相为超纯水,B相为甲醇(色谱纯);进样量:1 mL;0~30 min 用30%~100%甲醇洗脱,流速8 mL/min,得到馏分1-1、1-2、2-1 和2-2。
馏分1-1 经Agilent 1100 制备液相色谱仪分离,半制备柱YMC-Pack RP C18(10 mm × 250 mm,5 μm);柱温:40 ℃;流动相:A 相为甲酸水(0.05%甲酸),B 相为甲醇(色谱纯);进样量:20 μL;0~30 min 用30%甲醇等度洗脱,流速2 mL/min)得到化合物1(tR=28.9 min);馏分1-2 经Agilent 1100 制备液相色谱仪分离(0~35 min 用15%甲醇等度洗脱,流速2 mL/min)得到化合物3(tR=30.7 min);馏分2-2 经Agilent 1100 制备液相色谱仪分离(0~30 min 用15%甲醇等度洗脱,流速2 mL/min)得到化合物2(tR=22.0 min);馏分2-1 经Agilent 1100制备液相色谱仪分离(0~30 min 用15%甲醇等度洗脱,流速2 mL/min)得到馏分2-1-1 和馏分2-1-2;馏分2-1-1 经Agilent 1100 制备液相色谱仪分离(0~30 min 用15%甲醇等度洗脱,流速2 mL/min)得到化合物4(tR=7.9 min)和化合物6(tR=8.5 min);馏分2-1-2 再经Agilent 1100 制备液相色谱仪分离(0~30 min 用15%甲醇等度洗脱,流速2 mL/min)得到化合物5(tR=16.6 min)。
1.6 细胞毒活性测定方法
参照贴壁细胞的MTT 法[6]进行测试。具体方法如下:在96 孔板上,加5 ×104/mL 浓度的测试细胞的悬浮液,每孔90 μL,待细胞贴壁后加入待测样品10 μL,每个浓度重复3 个孔,置于37 ℃的5%CO2培养箱中培养48 h 后加入20 μLMTT 染料继续培养4 h,弃上清液,每孔加入120 μL DMSO 后,等待20 min 后用Bio-Rad680 酶标仪测定OD570。抑制率计算公式如下:
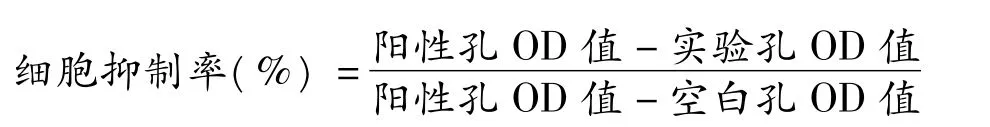
根据计算出的细胞抑制率,用统计学软件SPSS 11.0 的Probit 回归法,计算样品的IC50。
2 结果与分析
2.1 菌株HCCB11431 分子生物学鉴定
gyrB 基因是编码DNA 促旋酶的亚单位蛋白,对于细菌DNA 的转录和复制很重要,是一段较保守的序列,不出现频繁的基因横向转移,因而常常被选用于细菌系统发育分析[7]。测序结果表明HCCB11431 的gyrB 基因含有1229 个核苷酸,GenBank号:KF746164。将HCCB11431 的gyrB 基因序列与GenBank 中相关序列的BLAST 比较,结果显示HCCB11431 属于链霉菌属,与Streptomyces labedae 的序列同源性高达99%以上。
利用HCCB11431 的gyrB 基因序列构建系统发育树(图2),由图可知HCCB11431 与Streptomyces labedae 位于同一分支,同源性很高,在所比对的链霉菌中,与Streptomyces labedae 的关系最接近,故该菌株初步鉴定为Streptomyces labedae 菌。

图2 HCCB11431 的系统发育树Fig.2 Phylogenic tree of HCCB11431 based on gyrB full-length sequence
2.2 结构鉴定
化合物1 白色粉末,UV (H2O)λmax280(ε1159.85),。质谱图显示其准分子离子峰为m/z 268.1155[M+H]+,分子式为C13H17NO5(理论计算值为268.1185,不饱和度为6);红外光谱在3440、3423 cm-1上有吸收表明有氨基或羟基的存在,1630 cm-1上的吸收表明有羰基的存在,在1385、1122 cm-1处的吸收表明可能有芳香环的存在。通过分析1H NMR、13C NMR 和HMQC 波谱数据(表1)证实化合物1 含有3 个甲基(1 个连氧的甲基)、1 个亚甲基、1 个连氮的次甲基、1 个四取代的苯环和2 个羰基(δC171.2 和163.2);根据以上数据推得,其分子式和不饱和度要求化合物1 结构中含有1 个羟基和1 个氨基。通过1H-1H COSY 相关谱1 得到1个孤立的C-2– C-3 自旋体。在HMBC 谱(图3)中,H2-3 与C-4、C-5 和C-9 相关,表明C-3 在苯环的C-4 位取代;H3-13 与C-7、C-8 和C-9 相关,表明C-13 与C-8 相连;H3-12 与C-7 相关,以及考虑C-12的化学位移,C-12 通过氧与苯环上的C-7 相连;H3-11 与C-10 相关,以及考虑到C-6(δC148.9)和C-7(δC144.2)的化学位移,C-11 通过酯健与C-6 相连;H-2 与C-1 相关以及考虑到C-2 的化学位移,剩下的-COOH 和-NH2与C-2 相连。通过以上数据,推出化合物1 的平面结构为三取代苯丙氨酸衍生物,该物质为一新化合物,命名为3-(3-acetoxy-4-methoxy-5-methylphenyl)-2-aminopropanoicacid。化合物1 的化学结构与文献[8]中报道的已知化合物3-(3-hydroxy-4-methoxy-5-methylphenyl)-2-aminopropanoic acid 的结构类似,多了一个乙酯基,其他部分核磁数据基本一致,证明了化合物1 的推测结构符合事实。

表1 化合物1 的核磁数据Table 1 NMR spectroscopic data of 1 (Actone-d6,400 MHz)

图3 化合物1 的HMBC 关系图Fig.3 Key HMBC correlations of 1
化合物2 白色粉末,λmax280(ε1226.52),=-23.21(c 0.2,CH3OH);高分辨正离子电喷雾质谱图显示其准分子离子峰为m/z254.1022[M+H]+,分子式为C12H15NO5(理论计算值为254.1028,不饱和度为6)。1H NMR (CD3OD,400 MHz)δ:6.53(1H,s,H-5),6.47(1H,s,H-9),4.57(1H,dd,J=8.5,5.3 Hz,H-2),3.00(1H,dd,J=13.9,5.1 Hz,H-3α),2.78(1H,dd,J=13.9,8.7 Hz,H-3β),1.94(3H,s,H-11),2.17(3H,s,H-12)。红外光谱与化合物1 相近,另外通过与化合物1的1H NMR 数据比较发现,氧甲基(δH3.73)在化合物2 中消失外,其它1H NMR 数据基本一致,表明该化合物比化合物1 少了氧甲基,其它结构与化合物1 相同,该物质也为一新化合物,命名为3-(3-acetoxy-4-hydroxyl-5-methylphenyl)-2-aminopropanoic acid。化合物2 的化学结构与文献[8]中报道的已知化合物3-(3,4-hydroxyl-5-methylphenyl)-2-aminopropanoic acid的结构类似,多了一个乙酯基,其他部分核磁数据基本一致,从而证实了化合物2 推测的结构是正确的。
化合物3 白色粉末,TOF-MS m/z 252.1081[M+H]+,分子式为C10H13N5O3。1H NMR(400 MHz,CDCl3)δ:8.19(1H,s,H-2),8.34(1H,s,H-8),6.34(1H,dd,J=6.1,8.0 Hz,H-1'),2.28(1H,ddd,J=2.7,6.0,-13.1 Hz,H-2'α),2.75(1H,ddd,J=5.7,8.0,-13.1 Hz,H-2'β),4.42(1H,dddd,J=2.6,2.7,4.0,5.7 Hz,H-3'),3.88(1H,ddd,J=2.6,4.2,4.4 Hz,H-4'),3.62(1H,ddd,J=4.4,5.0,-12.0 Hz,H-5'a),3.52(1H,ddd,J=4.2,6.7,-12.0 Hz,H-5'b),5.30(1H,d,J=4.0 Hz,OH-3'),5.23(1H,dd,J=5.0,6.7 Hz,OH-5')。以上数据与文献[9]报道基本一致,故化合物3 确定为2'-deoxyadenosine。
化合物4 白色粉末,TOF-MS m/z 244.0906[M+H]+,分子式为C9H13N3O5。1H NMR(400 MHz,CD3OD)δ:3.80(1H,dd,J=12.4,2.4 Hz,H-5'),3.93(1H,dd,J=12.4,2.4 Hz,H-5'),4.09(1H,ddd,J=2.8,3.2,2.4 Hz,H-4'),4.18(1H,dd,J=5.3,5.2 Hz,H-3'),4.21(1H,dd,J=4.8,4.2 Hz,H-2'),6.12(1H,d,J=7.8 Hz,H-5),5.89(1H,d,J=3.2 Hz,H-1'),8.51(1H,d,J=8.0 Hz,H-6),以上数据与文献[10]报道基本一致,故化合物4 确定为Cytidine。
化合物5 白色粉末(CH3OH),TOF-MS m/z 245.0736[M+H]+,分子式为C9H12N2O6。1H NMR(CD3OD,400 MHz)δ:8.03(1H,d,J=8.1 Hz,H-6),5.92(1H,d,J=4.6 Hz,H-1'),5.71(1H,d,J=8.1 Hz,H-5),4.19(1H,dd,J=6.1,5.0 Hz,H-2'),4.17(1H,dd,J=4.9,4.9 Hz,H-3'),4.03(1H,ddd,J=2.9,3.1,4.0 Hz,H-4'),3.85(1H,dd,J=12.3,2.8 Hz,H-5'),3.75(1H,dd,J=12.3,3.0 Hz,H-5'),以上数据与文献[11]报道基本一致,故化合物5确定为Uridine。
化合物6 白色粉末,TOF-MS m/z 228.0978[M+H]+,分子式为C9H13N3O4。1H NMR(CD3OD,400 MHz)δ:8.12(1H,d,J=7.2 Hz,H-6),6.27(1H,dd,J=6.2,7.6 Hz,H-1'),6.00(1H,d,J=7.6 Hz,H-5),4.40(1H,d,H-3'),3.98(1H,ddd,J=2.8,8.0 Hz,H-4'),3.85-3.72 (2H,m,H-5',H-5''),2.42-2.14(2H,m,H-2',H-2''),以上数据与文献[12]报道基本一致,故化合物6 确定为2'-deoxycytidine。
2.3 活性分析
活性测定结果表明,化合物对不同的肿瘤细胞具有不同的细胞毒活性(表3)。化合物1 和化学物2 是属于氨基酸衍生物,其中化合物1 只对MCF-7有一定的抑制作用,化合物2 对三种肿瘤细胞均具有较高的抑制作用,推测可能是由于甲基化减弱了细胞毒的缘故。化合物3~6 属于核苷类似物,其中化合物3 和4 的抗肿瘤活性较强,化合物3 是虫草素的结构类似物,而虫草素[13](cordycepin)是第一个从真菌中分离出来的核苷类抗生素,具有抗肿瘤、抗菌抗病毒、免疫调节、清除自由基等多种药理作用。虽然化合物4 和化合物6 同属于胞苷类似物,但化合物4 的活性明显较高,说明2'位的羟基是重要的活性位点。

表3 化合物1~6 的IC50结果Table 3 IC50values of compounds 1-6 on tumor cells growth(μg/mL)
3 讨论
本实验分离得到的化合物分别为氨基酸衍生物(1~2)和核苷类似物(3~6),目前很多研究者将氨基酸进行结构修饰应用于抗肿瘤药物的筛选,部分氨基酸经过修饰后不仅增加了对肿瘤细胞的靶向性,其抗肿瘤活性也有了提高,毒副反应也有所降低,因此利用氨基酸设计出新的抗肿瘤药物具有重要意义。在本实验中,化合物1 和化合物2 在结构上相差一个甲基,即化合物2 苯环上的羟基被甲基化,化合物2 的抗肿瘤活性明显比化合物1 要高很多,表明化合物2 苯环上的羟基可能是活性位点之一。
核苷类似物结构易改造,生物体内多种分子作用靶标也让核苷类似物可以通过多种途径产生抗肿瘤活性。通过构效关系建立模型来指导药物的合成是目前核苷类抗癌药物的发展方向之一,本实验分离出的化合物4 和化合物6 也证明了结构的差异引起了抗肿瘤活性的改变。
1 Lang XM(郎晓萌),Lin WH(林文翰),Ji YB(季宇彬).Advance in research of bioactive substance derived from marine Streptomyces.J Harbin Univ Commerce,Nat Sci Ed(哈尔滨商业大学学报,自科版),2010,2:136-141.
2 Lee CH,Lim H,Moon S,et al.Novel anticancer agent,benzyldihydroxyoctenone,isolated from Streptomyces sp.causes G1 cell cycle arrest and induces apoptosis of HeLa cells.Cancer Sci,2007,98:795-802.
3 Shin-ya K,Wierzba K,Matsuo K,et al.Telomestatin,a novel telomerase inhibitor from Streptomyces anulatus.J Am Chem-Soc,2001,123:1262-1263.
4 Lewer P,Chapin EL,Graupner PR,et al.Tartrolone C:a novel insecticidal macrodiolide produced by Streptomyces sp.CP1130.J Nat Prod,2003,66:143-145.
5 Zhao YD(赵裕栋),Zhou J(周俊),He J(何璟).土壤微生物总DNA 提取方法的优化.ActaMicrobiol Sin(微生物学报),2012,9:1143-1150.
6 huang YJ(黄银久),Song BA(宋宝安),Jin LH(金林红),et al.SRB 法和MTT 法抗肿瘤药物筛选结果相关性研究.J Biol(生物学杂志),2009,4:13-16.
7 Hao YJ(郝云婕),Han SZ(韩素贞).Application of gyrBgene in bacterial phylogenetic analysis.Biotechnol Bull(生物技术通报),2008,2:39-41.
8 Schmidt EW,Nelson JT,Fillmore JP.Synthesis of tyrosine derivatives for saframycin MX1 biosynthetic studies.Tetrahedron Lett,2004,45:3921-3924.
9 Ciuffreda P,Casati S,Manzocchi A.Complete (1)H and(13)C NMR spectral assignment of alpha-and beta-adenosine,2'-deoxyadenosine and their acetate derivatives.MagnResonChem,2007,45:781-784.
10 Kwon HC,Jung IY,Cho SY,et al.Phospholipids from Bombycis corpus and their neurotrophic effects.Arch Pharm Res,2003,26:471-477.
11 Xian P,Li T,Bing Y,et al.Studies on the constituents from the Rhizoma of Alismaorientalis.J of Chinese Sci.1999,8(3):173.
12 Moussa A,Wang JY,Storer R.Industrially scalable nucleoside synthesis.US7595390.Google Patents,2009.
13 Gao J(高健),Lian ZQ(连泽勤),Zhu P(朱平),et al.Lipid-lowering effect of cordycepin (3'-deoxyadenosine)from Cordycepsmilitaris on hyperlipidemic hamsters and rats.Acta Pharm Sin(药学学报),2011,46:669-676.
