HPLC-DAD 和UPLC-MS/MS 对蔓花生中二苯乙烯类化合物的研究
2014-01-09韩寒冰王明阳李海航
韩寒冰,王明阳,马 超,李海航
1广东石油化工学院化学与生命科学学院;2 茂名出入境检验检疫局,茂名 525000;3华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广州 510631
蔓花生(Arachis duranensis)为蝶形花科蔓花生属多年生宿根草本植物,原产于亚洲热带及南美洲。由于其生长快、再生能力强、根系发达、抗逆性强、四季常青、花色鲜艳和观赏性强,在南方各省作为地面覆盖物或园艺观赏被广泛种植[1]。蔓花生的茎叶营养丰富,口感好,易消化,是动物的良好牧草[2]。栽培种花生为异源四倍体,是由二倍体野生型花生杂交、加倍形成。蔓花生作为花生二倍体野生型的种质资源,具有较强的抗病、抗虫和抗干旱能力,在花生基因改良中的作用越来越受到人们的重视[3,4]。
白藜芦醇(3,4',5-三羟基二苯乙烯)、白藜芦醇苷(白藜芦醇的葡萄糖苷)和二苯乙烯苷(2,3,5,4'-四羟基二苯乙烯-O-β-D-葡萄糖苷)为常见的二苯乙烯类天然活性物质。白藜芦醇和白藜芦醇苷是植物体内抵抗病原菌侵染的一类重要的植物抗毒素,并有显著的抗癌抑癌、心血管保护、抗氧化和清除自由基等药理作用[5,6]。白藜芦醇及其苷主要存在于虎杖、葡萄和花生等植物中,以虎杖中的含量最高。二苯乙烯苷具有抗衰老、降血脂、保肝护肝、促智、抗肿瘤等作用,是何首乌的主要药效成分[7]。人们通常用乙醇溶液提取法提取,并用HPLC 法测定其含量,本实验除了利用乙醇溶液辅助超声提取法外,还使用了柱层析提取法。目前,对蔓花生中二苯乙烯类化合物的研究尚未见报道,因此,本实验对蔓花生中的二苯乙烯类化合物进行了含量测定,为综合利用蔓花生,探索二苯乙烯类化合物的资源开发,改良花生种质资源,提高花生的食用和保健价值提供科学依据。
1 材料与方法
1.1 材料、试剂和仪器
植物材料采集于广州石牌华南师范大学校园内,经华南师范大学生命科学学院王英强教授鉴定为蔓花生(Arachis duranensis),整株或根茎叶分别置50 ℃烘箱中烘干至恒重,粉碎后过40 目筛,备用。
白藜芦醇、白藜芦醇苷和二苯乙烯苷对照品购于成都曼思特生物科技有限公司,纯度≥98%。甲醇和乙腈等色谱纯溶剂为美国Burdick & Jackson Inc.(Muskegon,MI,USA)产品,其它试剂均为分析纯。
Agilent 1200 高效液相色谱仪(VWD 检测器),美国安捷伦公司;QUATTRO Premier XE 型三重四级杆串联质谱仪,美国WATERS 公司;DL-6000 低速冷冻大容量离心机,上海安亭科学仪器厂;KQ5200B 超声波清洗器,江苏省昆仑山市超声仪器有限公司;电热恒温鼓风干燥箱,上海沪粤明科学仪器有限公司。
1.2 样品的制备
1.2.1 HPLC-DAD 定性分析样品
称取整株、根、茎或叶粉末各1 g,分别置于10 mL 提取管中,加入6 mL 60%乙醇溶液,密封,超声提取30 min,离心,上清液过0.22 μm 滤膜,滤液供HPLC-DAD 检测。
1.2.2 UPLC-MS/MS 定性分析样品
用柱层析提取法提取[8]。取10 g 蔓花生茎粉末,用60% 的乙醇溶液湿样上柱,浸泡2.0 h,以60%乙醇溶液为洗脱溶剂,洗脱液流速40 mL/h,收集洗脱液40 mL 浓缩后,经大孔树脂D101 纯化,用0.22 μm 滤膜过滤,滤液供UPLC-MS/MS 定性分析。
1.2.3 HPLC 定量分析样品
用柱层析提取法[8]提取。分别称取蔓花生根、茎、叶或整株粉末5 g,采用直径为1.25 cm 的玻璃层析柱,以60%乙醇溶液为提取溶剂,浸泡2.0 h,收集洗脱液体积除叶以4.5 mL/g 为一个收集单位(即一份)外,其余均以4.0 mL/g 为一份,共提取四份。洗脱液用0.22 μm 滤膜过滤,HPLC 法分别测定各提取液中二苯乙烯类化合物的含量。
1.3 对照品溶液的制备
1.3.1 HPLC-DAD 定性分析对照品混合液
按白藜芦醇、白藜芦醇苷和二苯乙烯苷分配为50、150 和350 μg/mL 配制而成。
1.3.2 HPLC 定量分析对照品混合液
分别以2.5、5、7.5、10、12.5 μg/mL 的白藜芦醇标准溶液,5、10、15、20、25 μg/mL 的白藜芦醇苷标准溶液和25、50、75、100、125 μg/mL 的二苯乙烯苷标准溶液制作三种化合物的浓度与峰面积关系的标准曲线。根据样品中各化合物的峰面积计算样品中各化合物的含量。
稳定性:取同一批稻谷,在 0h、2h、4h、6h、8h 各测定一次,计算出叶黄素提取量的RSD为1.22%,表明样品溶液在8h内基本稳定。
1.4 HPLC-DAD 分析条件
色谱条件:色谱柱为依利特ODS1 柱(250 mm× 4.6 mm,5 μm,大连依利特公司),柱温40 ℃;流动相:甲醇(A)-1%乙酸水溶液(B);梯度洗脱程序:0~14 min,25%~28%A;14~30 min,28%~30%A;流速1.0 mL/min;检测波长为303 nm;进样量10 μL,样品与对照品叠加试验的进样量为20 μL,HPLC-DAD 的扫描波长为190~400 nm。
1.5 UPLC-MS/MS 分析条件
UPLC-MS/MS 分析仪器为QUATTRO Premier XE 型三重四级杆串联质谱仪(美国WATERS 公司);色谱柱为ACQUITY UPLC BEH C18(2.1 mm ×50 mm,1.7 μm);流动相为乙腈(A)-水(B),梯度洗脱程序:0~1 min,20% A;1~1.5 min,20%~50%A;1.5~2.5 min,50% A;2.5~3.0 min,20%A;流速:0.25 mL/min,柱温:40 ℃,进样量10 μL。质谱条件:电喷雾离子源(ESI),负离子检测,离子喷雾电压(IS)为3.5 kV,离子源温度(TEM)为110℃,气帘气(CUR)为47 L/Hr,雾化气(GAS1)为700 L/Hr,采集方式为多反应监测(MRM)模式,离子选择以灵敏度高和稳定性好为前提条件。
2 结果与分析
2.1 HPLC-DAD 的定性分析
用HPLC 分别测定了根、茎、叶和整株提取液,结果见图1。与对照品混合液比较,除叶提取液在二苯乙烯苷相应的位置没有明显出峰之外(图1D),其余的在白藜芦醇苷、二苯乙烯苷和白藜芦醇相应的保留时间均有峰出现,用等量的对照品混合溶液与茎提取液混合做叠加实验(图1C),结果保留时间与原来的保持一致,峰面积也与各自峰面积总和相等。因此,可以初步判断蔓花生中存在被鉴定的三种二苯乙烯类化合物,根茎中二苯乙烯苷含量高,叶中检测不到,白藜芦醇含量相对较低。分别对对照品、样品和叠加实验的对应峰进行紫外吸收光谱扫描(DAD),发现有一致的紫外吸收峰,白藜芦醇和白藜芦醇苷的两个最大吸收峰波长分别为303 nm 和320 nm,二苯乙烯苷的最大吸收峰的波长为320 nm。因此,可以进一步确定样品中含有三种二苯乙烯类化合物。
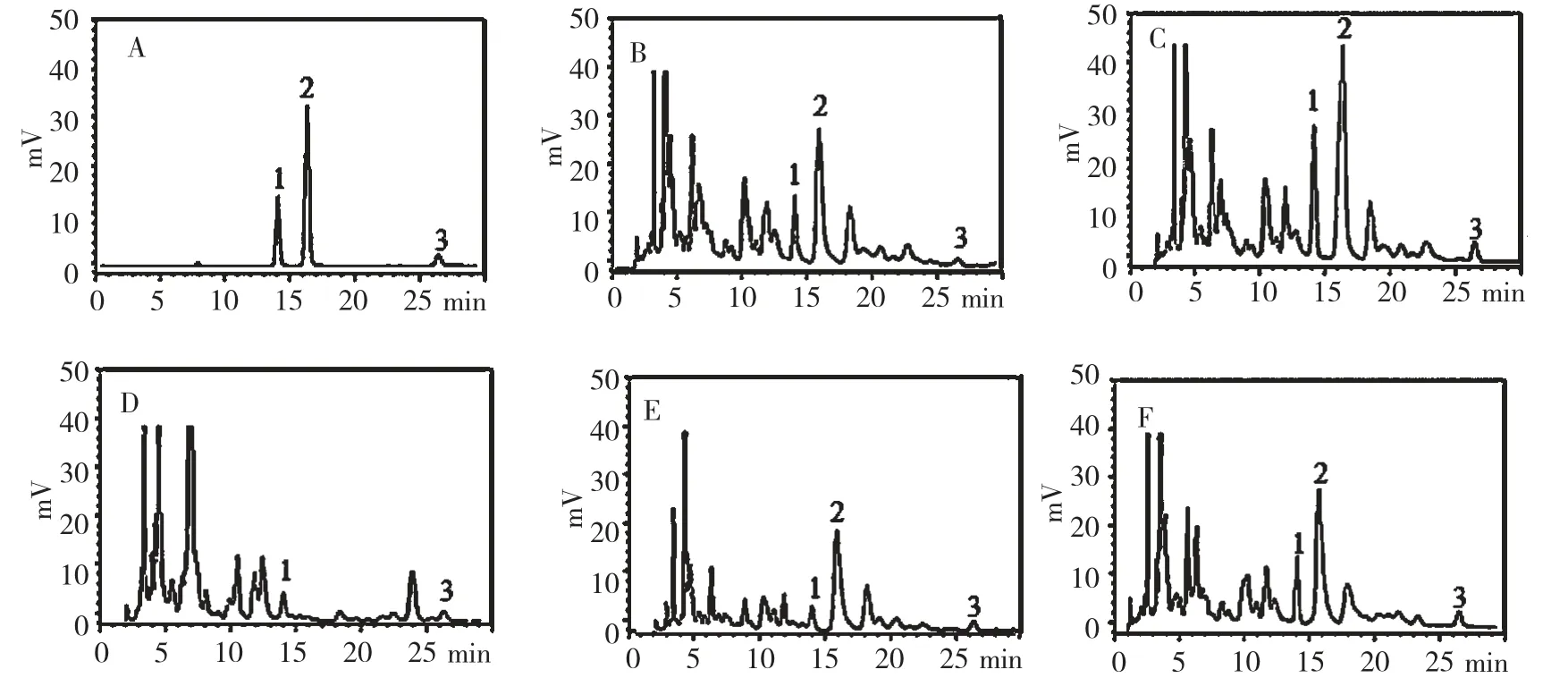
图1 蔓花生提取液中白藜芦醇、白藜芦醇苷和二苯乙烯苷的HPLC 色谱图Fig.1 HPLC chromatograms of resveratrol,polydatin and stilbene glucoside in the extracts of A.duranensis
2.2 UPLC-MS/MS 定性分析
对纯化的样品提取液进行一级质谱全扫描,发现准离子的分子量分别为227.0、388.9、404.9 的三种化合物(图2)。与对照品白藜芦醇、白藜芦醇苷和二苯乙烯苷的负离子的相对分子量227.2、389.0和404.8 相吻合。分别对疑似白藜芦醇、白藜芦醇苷和二苯乙烯苷三种化合物离子峰进行二级扫描,得到二级质谱图(图3),其碎片离子及离子强度均与对照品二级质谱图显示的结果一致。图3A 中的碎片子离子m/z 185.1、159.1、143.1 等与文献[9]分析白藜芦醇的裂解规律和MS2一致,可以确定m/z为227.0 是白藜芦醇。图3B 中得到的三个接近m/z 为227.0 的碎片,与白黎芦醇苷母离子裂解丢失一个取代葡萄糖基(-C6H10O5)生成的苷元,白黎芦醇负离子的m/z 为227.0 相符,并与文献[10]对白藜芦醇苷(虎杖苷)的分析结果一致,因此,确定m/z为388.9 的化合物为白黎芦醇苷。图3C 中主要碎片子离子m/z 242.9、243.3,与m/z 为404.9 的母离子裂解丢失一个取代葡萄糖基团(-C6H10O5)后m/z 为242.9 相符,其二级质谱图与文献[7]的分析结果相同,因而,确定m/z 404.9 为二苯乙烯苷。
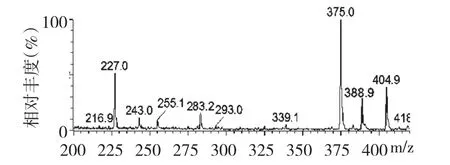
图2 茎样品中白藜芦醇(m/z=227.0)、白藜芦醇苷(m/z=388.9)和二苯乙烯苷(m/z=404.9)质谱图Fig.2 MS spectrum showing resveratrol (m/z=227.0),polydatin (m/z=388.9)and stilbene glucoside(m/z=404.9)in stem extracts

图3 蔓花生样品中白藜芦醇(A)、白藜芦醇苷(B)和二苯乙烯苷(C)的二级质谱图Fig.3 MS2 spectra of resveratrol (A),polydatin (B)and stilbene glucoside (C)in stem extracts
2.3 不同器官中二苯乙烯类化合物的含量
2.3.1 标准曲线与线性范围
分别以三种对照品的浓度为横坐标,峰面积(A)为纵坐标绘制标准曲线,得到白藜芦醇的回归方程为A=50724x+1542.2,R2=0.9998,线性范围为2.5~12.5 μg/mL,白藜芦醇苷的回归方程为A=27947x-2889.5,R2=0.9992,线性范围为5~25 μg/mL,二苯乙烯苷的回归方程为A=33810x-1614.8,R2=0.9999,线性范围为25~125 μg/mL。
2.3.2 精密度试验
将对照品混合溶液重复进样5 次,根据峰面积分别计算出三种成分的含量和RSD 值,三种对照品的RSD 值均小于1%,表明检测方法的精密度良好。
2.3.3 重复性试验
取茎提取液样品5 份,分别用HPLC 检测,根据峰面积计算三种成分的RSD 值,白藜芦醇苷为1.18%,二苯乙烯苷为0.97%,白藜芦醇为1.22%,表明检测方法的重复性良好。
2.3.4 溶液稳定性试验
取茎提取液于室温下分别放置0、2、4、6、8 h后,HPLC 检测。根据三种化合物的峰面积计算检测的RSD 值,白藜芦醇苷为2.05%,二苯乙烯苷为3.24%,白藜芦醇为1.41%,说明供试品溶液在8 h内稳定。
2.3.5 加标回收率试验
精密吸取茎提取液2.0 mL,各平行三份,分别加入对照品混合液(白藜芦醇15 μg/mL,白藜芦醇苷30 μg/mL,二苯乙烯苷150 μg/mL)1 mL、1.5 mL、2.0 mL,定容到10 mL,HPLC 测定各样品的加样回收率,结果见表2。白藜芦醇、白藜芦醇苷和二苯乙烯苷的平均回收率分别为99.78%、98.76%和98.93%。
2.3.6 定量限和检测限
取蔓花生茎提取液,逐渐稀释,进样10 μL,记录色谱图,按10 倍信噪比计算,测得提取液的定量限为69.22 ng/mL,按3 倍信噪比计算,测得提取液检测限为24.81 ng/mL。
表1 加样回收率试验结果(n=3,)Table 1 Results of recovery rates of the 3 investigated compounds (n=3,)

表1 加样回收率试验结果(n=3,)Table 1 Results of recovery rates of the 3 investigated compounds (n=3,)
2.3.7 二苯乙烯类化合物提取次数的考察
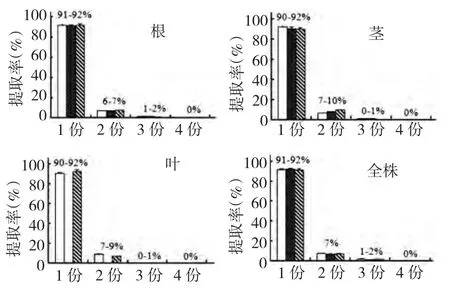
图4 柱层析法提取蔓花生中二苯乙烯类化合物Fig.4 Extraction rates of stilbene compounds from A.duranensis by the column chromatographic extraction method
用柱层析提取法提取,收集4 份提取液,HPLC检测含量,以4 份提取液中含量的总和作为目标成分的总含量。每份提取液中白藜芦醇苷、二苯乙烯苷和白藜芦醇的提取率见图4。第1 份的提取率均达到90%以上,第2 份为5%~10%之间,第3 份1%~2%,第4 份均检测不到三种成分。因此,只需测定三份提取液中目标成分的含量就可准确得出材料中各成分的含量。
2.3.8 蔓花生中二苯乙烯类化合物的含量
用柱层析提取法提取各样品,收集三份洗脱液,合并后,用HPLC 测定提取液中目标成分的含量。分别测定了蔓花生叶、茎、根及整体植株中三种二苯乙烯类化合物的含量,结果见表2。根、茎和叶中的白藜芦醇含量较接近,均不及白藜芦醇苷的一半,根茎中二苯乙烯苷含量较高,是白藜芦醇的8~10 倍,但叶中检测不到二苯乙烯苷,茎中三种二苯乙烯类化合物的总量最高。

表2 蔓花生不同器官中二苯乙烯类化合物的含量(μg/g)Table 2 Contents of stilbene compounds in different organs of A.duranensis (μg/g)
3 讨论
采用HPLC-DAD 和UPLC -MS/MS 法首次从蔓花生中鉴定了白藜芦醇、白藜芦醇苷和二苯乙烯苷。通过柱层析提取法和HPLC 检测,准确测定了根茎叶和整体植株中三种二苯乙烯类化合物的含量,结果表明,除叶中检测不到二苯乙烯苷外,三种器官中都检测到二苯乙烯类化合物,其中茎中三种化合物的含量均最高。三种化合物中,白藜芦醇在各器官中的含量最低、二苯乙烯苷的含量最高。茎、根和叶中三种二苯乙烯类化合物的总含量分别为1158.25、863.66 和318.09 μg/g。目前,同时研究白黎芦醇和白藜芦醇苷的材料主要有中药虎杖、桑椹和葡萄,其中虎杖中的含量最高,达到2%~3%[5]。桑椹中白藜芦醇含量为8~21.9 μg/g,白藜芦醇苷含量为16.8~133.8 μg/g[11]。研究发现白藜芦醇普遍存在于豆科、葡萄科、百合科、蓼科等植物中,但含量都普遍很低,花生中根茎叶的白藜芦醇含量普遍在100 μg/g 左右[12],葡萄皮中白黎芦醇的含量为50~100 μg/g,葡萄酒中白黎芦醇的含量为1.5~3 mg/L[13]。由于含量低,要从中提取分离活性成分比较困难。蔓花生中二苯乙烯类化合物的含量比花生、葡萄和桑椹等植物均高得多,加之它的资源丰富,成本低,可作为二苯乙烯类化合物原料。蔓花生作为畜牧业饲料的原料,由于含有较高的二苯乙烯类化合物,对提高动物的抵抗力,减少疾病的发生有一定的作用。
1 Liu JX(刘金祥),Chen KD(陈款弟),Luo FB(罗凤冰),et al.Weed species investigation and chemical control of Arachis duranensis lawn in edge of tropical.Grassland and Turf(草原与草坪),2011,31(5):12-15.
2 Zhou L(周立),Zheng H(郑荷),Zhang L(张利),et al.Study on fertilizing K2HPO4of Arachis duranensis under low temperature stress.Modern Agric Sci(现代农业科学),2008,15(2):27-31.
3 Nagy ED,Guo Y,Tang S,et al.A high-density genetic map of Arachis duranensis,a diploid ancestor of cultivated peanut.BMC Genomics,2012,13:469.
4 Temsch EM,Greilhuber J.Genome size in Arachis duranensis:a critical study.Genome,2001,44:826-830.
5 Mantegna S,Binello A,Boffa L,et al.A one-pot ultrasoundassisted water extraction cyclodextrin encapsulation of resveratrol from Polygonum cuspidatum.Food Chem,2012,130:746-750.
6 Xie HQ(谢红旗),Liu FB(刘发宝),Yang XX(杨星星),et al.General law of dynamic accumulation of resveratrol and viniferin in grape.Nat Prod Res Dev(天然产物研究与开发),2012,24:1079-21083.
7 Sun JL(孙晋苓),Huang XL(黄晓兰),Wu HQ(吴惠勤),et al.HPLC/IT/MS analysis of glycosides radix Polygonimultiflori.Nat Prod Res Dev(天然产物研究与开发),2009,21:806-812.
8 Han HB,Li H,Hao RL,et al.One-step column chromatographic extraction with gradient elution followed by automatic separation of volatiles,flavonoids and polysaccharides fromCitrus grandis.Food Chemistry,2014,145:542-548.
9 Liu Y(刘一),Li Y(李媛),Zhao LB(赵立波),et al.Study on the Fragmentation Pathways of 4 Kinds of Resveratrol Compounds by ESI-MSm.China Pharm(中国药房),2013,24:33-36.
10 Dong J(董静),Wang H(王弘),Wan LR(万乐人),et al.Identification and determination of major constituents in Polygonum cuspidatum Sieb et Zucc by high performance liquid chromatography/electrospray ionizatioin-ion trap-time of flight mass spectrumetry.Chin J Chromatography(色谱),2009,27:425-430.
11 Zhao K(赵 康),Su ZY(苏政荣),Yang BW(杨碧文),et al.Determination of resveratrol and polydatin in Mulberry.Food Sci(食品科学),2010,31:241-244.
12 Wu XY(吴向阳),Wang CX(王彩霞),Da ZL(笪祖林),et al.HPLC determination of resveratrol in roots,stems and leaves of peanut.Food Sci(食品科学),2009,30:240-242.
13 Zhou L(周丽),Dong YH(董永海),Hu CL(胡传来),et al.Quantitative determination of resveratrol and resveratrol glucoside in grape juice(wine)by HPLC.Acta Nut Sin(营养学报),2010,32:86-90.
