瑞香狼毒根中异新狼毒素A 和新狼毒素B 对松材线虫和拟松材线虫的触杀活性研究
2014-01-09崔海燕王丹丹路利芹
崔海燕,金 辉,王丹丹,路利芹,秦 波*
1中国科学院兰州化学物理研究所中国科学院西北特色植物资源化学重点实验室甘肃省天然药物重点实验室,兰州 730000;2中国科学院研究生院,北京 100039
松材线虫(Bursaphelenchus xylophilus,PWN)引起的松树萎蔫病被视为松树的癌症,其主要危害黑松、马尾松、黄松、赤松、海岸松和黄山松等松属植物,是一种毁灭性森林病害[1]。拟松材线虫(Bursaphelenchus mucronatus)与松材线虫的形态极为相似。关于拟松材线虫的致病性,一直以来存在着争议,分无致病性、弱致病性或潜在致病性以及强致病性的几种观点[2,3]。从近几年来的研究结果来看,拟松材线虫的致病性受环境条件的影响较大,在一定条件下也能造成大片松树的死亡,而且拟松材线虫往往比松材线虫的分布范围更广,在同一地区常常是拟松材线虫先出现,然后才有松材线虫出现,例如在我国也在许多非松材线虫病疫区的松树尤其马尾松上也发现了大量的拟松材线虫。因此,在松材线虫病的防治方面,拟松材线虫理应和松材线虫一样受到重视。
目前对于松材线虫病的防治除了加强检疫、林分改造和其它农业措施之外,主要依赖化学防治。由于高毒杀线剂的使用,产生了环境污染和抗药性等诸多问题。随着人类环保意识的提高,生物防治已成为线虫防治的主导。植物是天然活性物质的重要宝库,许多植物提取物对植物线虫具有良好的杀线虫活性[4]。研究和开发具有选择性强、高效、低毒、环境友好、无公害的植物源线虫触杀活性物质,利用植物活性代谢物防治松树线虫病,是保护森林资源和生态环境、促进我国林业发展的有效途径。
瑞香狼毒(Stellera chamaejasme L.)为瑞香科狼毒属植物,在我国东北、华北、西南、西北、内蒙古和黑龙江等地广泛分布[5],其根中富含香豆素、双黄酮和萜类等生物活性物质[6]。据我国民间记载,其根粉常被用来作为杀虫剂[7],瑞香狼毒对山楂叶螨的毒力及酶活力影响和对蚜虫的杀虫活性已有报道[8,9]。但对瑞香狼毒根中二氢黄酮类成分的杀线虫活性鲜有研究报道,只是以瑞香狼毒根部不同溶剂的萃取物对马铃薯腐烂茎线虫的触杀活性进行了报道,并没有明确其具体的杀线虫活性成分[10]。因此,本文就瑞香狼毒根乙醇提取物中分离鉴定的两个二氢黄酮类化合物对松材线虫和拟松材线虫的触杀活性进行了研究,以期为植物资源的开发利用和松树线虫病的防治提供依据。
1 材料与方法
1.1 试验材料
供试植物:植物材料于2009 年10 月采集于甘肃省定西市岷县高山草甸,由兰州大学生命科学院植物及植物生理研究所蒲训副教授鉴定为瑞香狼毒(Stellera chamaejasme L.)的 根,植 物 标 本(GSM002)保存于中国科学院兰州化学物理研究所天然药物实验室。
供试线虫:松材线虫(Bursaphelenchus xylophilus)和拟松材线虫(Bursaphelenchus mucronatus),均分离自江苏省溧水县感病的马尾松(Pinus massoniana)树上,由南京林业大学森林资源与环境学院森林保护教研室的韩正敏教授鉴定并提供虫源,然后在本实验室自行扩繁。
1.2 仪器与试剂
旋转蒸发仪SW-CJ-2G(瑞士Buchi 公司),循环水式多用真空泵(上海豫康公司),AL104 电子天平(梅特勒-托利多仪器上海有限公司),恒温摇床(武汉瑞华仪器设备有限责任公司),HP250G-C 型智能光照培养箱(武汉瑞华仪器设备有限责任公司),LDZX-40 立式电热压力蒸汽灭菌(上海悦丰仪器仪表有限公司),洁净工作台(上海博迅实业有限公司医疗设备厂),倒置显微镜(上海光学仪器厂)。柱层析用硅胶(200~300 目)由青岛海洋化工厂生产,薄层色谱用硅胶板GF254(0.20~0.25 mm,青岛海洋化工厂)。显色剂为5%硫酸乙醇溶液,加热显色。1H 和13C NMR 谱在氘代溶剂(Acetone-d6)中用Varian Mercury-400BB 超导核磁共振仪测定,以四甲基硅烷(TMS)为内标。高效氟氯氰菊酯,购自广东瑞德丰生物技术有限公司。实验中所用的试剂均为分析纯。
1.3 试验方法
1.3.1 线虫的培养
在直径为9 cm 的培养皿中加入约20 mL PDA固体培养基,待培养基凝固后,接入灰葡萄孢菌(Botrytis cinerea),于28 ℃恒温箱中暗培养。待菌丝长满整个培养皿后,在培养基中央刻一小口,加入表面消毒过的线虫约500 条。将培养皿用封口膜包好,正置放入28 ℃恒温箱中暗培养。接种培养2~3 d 后将培养皿倒置,继续培养至菌丝消失,线虫长满平板。用无菌水将培养皿皿盖上的线虫悬浮,置于显微镜下,观察浓度及虫龄,准确选取二龄幼虫(简称J2),供测试用。
1.3.2 瑞香狼毒根提取物中二氢黄酮类化合物的分离
将瑞香狼毒干燥根20 kg 进行粉碎,置于广口瓶内,95%乙醇中浸泡24 h,以渗漉法提取,渗漉液减压浓缩,得乙醇提取物浸膏4.5 kg。然后将乙醇提取物浸膏用4 L 蒸馏水悬浮,依次分别用等体积的石油醚、氯仿和乙酸乙酯于室温下连续萃取3 次,合并各萃取液,减压浓缩,依次制得瑞香狼毒根的石油醚、氯仿、乙酸乙酯及水相萃取物浸膏,待试验用。
将乙酸乙酯的萃取物浸膏1.46 kg 上硅胶柱(18 ×145 cm,3600 g),用氯仿和甲醇(100∶0~100∶100)梯度依次洗脱,通过薄层色谱检测,合并相近组分,得到14 个馏分(Fr1-14),将其中的Fr8(135.2 g)经硅胶柱(13 ×130 cm,900 g)层析,以氯仿和甲醇(40∶0~3∶1)梯度依次洗脱,通过薄层色谱检测,合并相近组分,得到6 个组分(Fr8-1~8-6),将其中的Fr8-4(92.5 g)再上硅胶柱(2 ×75 cm,160 g),以氯仿和甲醇(20∶0~2∶1)梯度依次洗脱,得到两个淡黄色粉末状化合物1(79.4 mg)和化合物2(622.9 mg)。
1.3.3 触杀活性测定
取线虫悬浮液和二甲基亚砜(DMSO)溶解的样品加到直径为9 cm 的培养皿中,样品制成浓度为80 mmol/L 的母液,将上述母液于无菌滤膜过滤,分别稀释至5、10、20 和40 mmol/L 四个浓度梯度。于24 孔板中每孔加入一定浓度的线虫悬浮液495 μL,将实验样品的五个浓度梯度溶液各5 μL 依次加入24 孔板,使实验样品浓度占总浓度的1%,每个浓度重复两次,以相同比例的DMSO 作为对照,在摇床上(180 rpm,2 min)混合均匀后,置于温度为28 ℃、湿度为50%~60%的培养箱中暗培养。每个处理选取3 个视野,重复两次。处理后在40 倍显微镜下24、48、72 h 分别记录各处理组线虫的死亡情况,计算公式如下:

1.4 数据处理
采用Excel 2007 和SPSS 16.0 软件对试验数据进行整理和统计分析。数据结果以校正死亡率的平均值±标准偏差()表示,同一时间点五个不同处理浓度的校正死亡率相互间的显著性差异用邓肯氏新复极差检验法(Duncan's Multiple Ranger Test,DMRT)。
2 结果与分析
2.1 异新狼毒素A 和新狼毒素B 的分离与结构鉴定
瑞香狼毒根乙醇提取物的乙酸乙酯萃取物经过反复硅胶柱层析,分别得到两个淡黄色粉末状固体化合物1(79.4 mg)和化合物2 (622.9 mg),在254 nm 处有强吸收。以Acetone-d6为溶剂,结合1H 和13C NMR 数据对其结构进行了分析鉴定。
化合物1 的1H NMR 中包含双二氢黄酮的C2,C2″位的两个质子[δ 5.42(2H,s,J=0 Hz)],C3,C3″位的两个质子[δ 3.37(2H,s,J=0 Hz)]信号,包含的12 个芳香质子信号[δ 5.80~7.04]表明存在两个典型的5,7-二氧取代的A 环[δ 5.80(2H,s,J=0 Hz),5.93(2H,s,J=0 Hz)]和两个典型的对位氧取代的B 环[δ 6.77(4H,d,J=8.0 Hz),7.04(4H,d,J=8.0 Hz)],同时化合物1 的13C NMR中显示了两个羰基碳(δc194.9,194.9)的信号,典型的5,7-二氧取代的A 环上6-,8-位的碳信号(δc96.4,95.3)和典型的对位氧取代的B 环上2-,3-,5-,6-位的碳信号(δc128.1,115.9,115.6,128.1)。C-2,C-2″(δc81.2,81.2)和C-3,C-3″(δc47.2,47.2)信号表明化合物1 是由两个二氢黄酮单位组成的。通过与已知C-3/C-3″双二氢黄酮的相应质子的J 值(0 和0 Hz)比较,化合物1 的C-2/C-3 和C-3″/C-2″位的相对构型被确定为cis-cis。1H NMR 和13C NMR没有甲氧基信号,提示化合物1 没有甲氧基取代,结构是高度对称的。化合物1 的1H NMR 和13C NMR信号与异新浪毒素A 非常相似,通过与文献对照[11],故确定其为异新浪毒素A(isoneochamaejasmin A)。
化合物2 的1H NMR[δ 7.01(2H,d,J=8.4 Hz)],[δ 7.08(2H,d,J=8.4 Hz)],[δ 7.15 (2H,d,J=8.4 Hz)],[δ 7.28(2H,d,J=8.4 Hz)]为两个对位取代苯环的信号。比较化合物2 和化合物1 的1H NMR 和13C NMR,可以看出化合物2 与化合物1 的13C NMR 数据基本一致,但是在化合物2的1H NMR 数据中,C2,C2″位的两个质子[5.75(1H,d,J=4.4 Hz),5.14(1H,d,J=8.4 Hz)],C3,C3″位的两个质子[3.14(1H,s,J=0 Hz),3.34(1H,d,J=3.2 Hz)]不同于化合物1 的C2,C2″位的两个质子和C3,C3″位的两个质子,说明二者的立体结构不同,通过与已知C-3/C-3''双二氢黄酮的相应质子的J 值比较,化合物2 的C-2/C-3 和C-3″/C-2″位的相对构型被确定为cis-trans,化合物2 的1H NMR和13C NMR 信号与新狼毒素B 非常相似,通过与文献对照[12],故确定其为新狼毒素B(neochamaejasmin B)。化合物1 和化合物2 的结构如图1 所示。
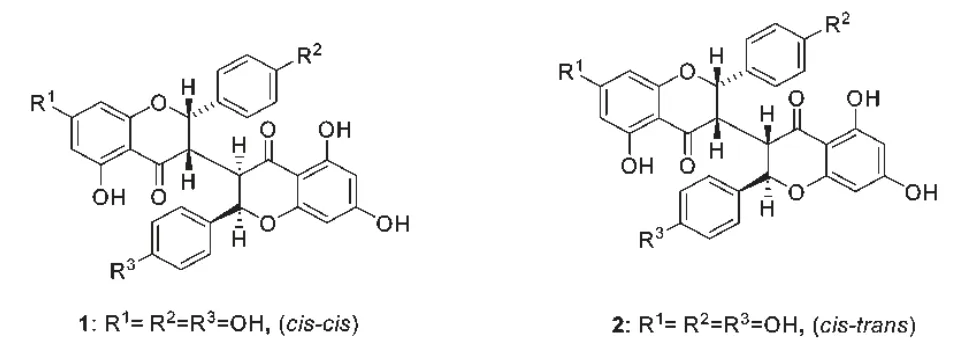
图1 化合物1 和2 的化学结构Fig.1 Chemical structures of compounds 1 and 2
异新狼毒素A 和新狼毒素B 的核磁波谱数据如下:
异新狼毒素A:1H NMR(Acetone-d6,400 MHz)δ:5.42(2H,s,H-2,H-2″),3.37(2H,s,H-3,H-3″),5.80(2H,s,H-6,H-6″),5.93(2H,s,H-8,H-8″),7.04(4H,d,J=8.0 Hz,H-2',H-2″',H-6',H-6″'),6.77(4H,d,J=8.0 Hz,H-3',H-3″',H-5',H-5″');13C NMR(Acetone-d6,100 MHz)δ:81.2(C-2,C-2″),47.2(C-3,C-3″),194.9(C-4,C-4″),163.5(C-5,C-5″),96.4(C-6,C-6″),167.2(C-7,C-7″),95.3(C-8,C-8″),163.8(C-9,C-9″),103.2(C-10,C-10″),127.8(C-1',C-1″'),128.1(C-2',C-2″'),115.9(C-3',C-3″'),157.7(C-4',C-4″'),115.6(C-5',C-5″'),128.1(C-6',C-6″')。
新狼毒素B:1H NMR(Acetone-d6,400 MHz)δ:5.14(1H,d,J=8.4 Hz,H-2″),5.75(1H,d,J=4.4 Hz,H-2),3.34(1H,d,J=3.2 Hz,H-3″),3.14(1H,s,H-3),5.96(1H,d,J=2.0 Hz,H-6″),5.83(1H,d,J=2.0 Hz,H-6),6.10(1H,d,J=2.0 Hz,H-8″),5.98(1H,d,J=2.0 Hz,H-8),7.15(2H,d,J=8.4 Hz,H-2',H-6'),7.28(2H,d,J=8.4 Hz,H-2″',H-6″'),7.01(2H,d,J=8.4 Hz,H-3',H-5'),7.08(2H,d,J=8.4 Hz,H-3″',H-5″');13C NMR(Acetone-d6,100 MHz)δ:80.8(C-2),82.8(C-2″),49.0 (C-3),49.8 (C-3″),196.0 (C-4),198.1(C-4″),165.0(C-5),165.3(C-5″),97.0(C-6),97.1(C-6″),167.3(C-7),167.7(C-7″),96.0(C-8),96.8(C-8″),162.8(C-9),164.7(C-9″),103.7(C-10),104.8(C-10″),128.6(C-1'),129.9(C-1″'),128.5(C-2',C-6'),130.6(C-2″',C-6″'),116.3(C-3',C-5'),116.4(C-3″',C-5″'),158.3(C-4'),158.6(C-4″')。
2.2 异新狼毒素A 和新狼毒素B 对松材线虫的室内触杀活性测定结果
分别精确称取异新狼毒素A 和新狼毒素B 减压干燥样品溶于DMSO 中制成样品为80 mmol/L 的母液。试验时以适量DMSO 将母液依次稀释成浓度分别为5、10、20 和40 mmol/L 四个浓度梯度的试液,对松材线虫进行室内生物活性测定。试验中设与试验药液相应浓度的DMSO 作为对照,异新狼毒素A 和新狼毒素B 对松材线虫的室内触杀活性试验结果见表1。处理24 h 后,800 μmol/L 浓度下异新狼毒素A 和新狼毒素B 对松材线虫的触杀活性分别为10.98%和31.22%,此浓度下二者对松材线虫的触杀活性与50 μmol/L 浓度下相比差异极显著(P <0.01)。随着处理时间和浓度的增加,两个化合物对松材线虫的触杀活性逐渐增强。处理72 h后,800 μmol/L 浓度下异新狼毒素A 和新狼毒素B对松材线虫的触杀活性分别为47.13%和54.32%,此浓度下二者对松材线虫的触杀活性与50 μmol/L浓度下相比差异极显著(P <0.01)。
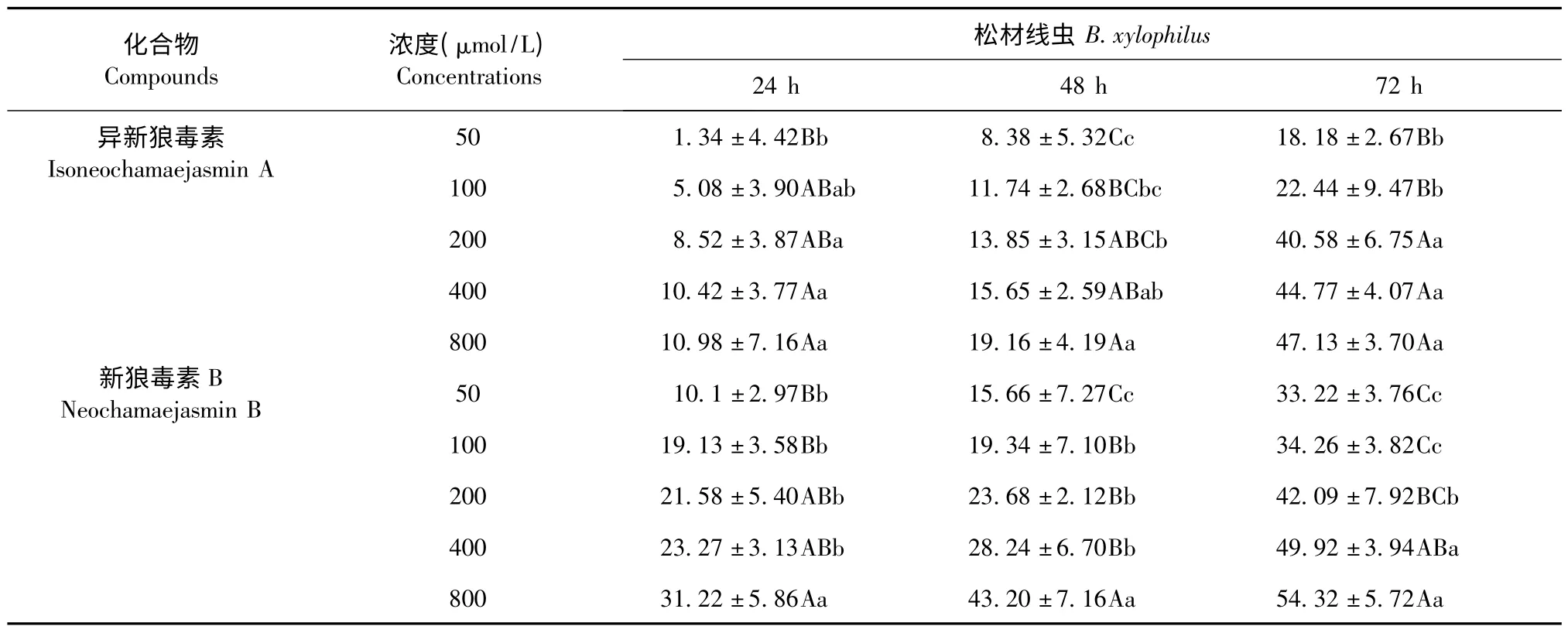
表1 瑞香狼毒根中活性物质对松材线虫的触杀活性影响Table 1 Effects of two isolated compounds from the roots of S.chamaejasme on the mortality of B.xylophilus
2.3 异新狼毒素A 和新狼毒素B 对拟松材线虫的室内触杀活性测定结果
试验方法同2.2,然后对拟松材线虫进行室内生物活性测定。异新狼毒素A 和新狼毒素B 对拟松材线虫的室内触杀活性试验结果见表2。处理24 h 后,800 μmol/L 浓度下异新狼毒素A 和新狼毒素B 对拟松材线虫的触杀活性分别为9.00% 和18.08%,此浓度下异新狼毒素A 对拟松材线虫的触杀活性与其他浓度下相比差异不显著,而新狼毒素B 在800 μmol/L 浓度下对拟松材线虫的触杀活性与50、100 和200 μmol/L 浓度下相比差异极显著(P <0.01)。随着处理时间和浓度的增加,两个化合物对拟松材线虫的触杀活性逐渐增强。处理72 h后,在最大浓度下异新狼毒素A 和新狼毒素B 对拟松材线虫的触杀活性分别达到了49.00% 和65.24%。

表2 瑞香狼毒根中活性物质对拟松材线虫的触杀活性影响Table 2 Effects of two isolated compounds from the roots of S.chamaejasme on the mortality of B.mucronatus
2.4 异新狼毒素A 和新狼毒素B 对松材线虫和拟松材线虫的触杀活性测定结果比较
异新狼毒素A 和新狼毒素B 对松材线虫和拟松材线虫的触杀活性试验比较结果见表3。
处理24 h 后,异新狼毒素A 对松材线虫和拟松材线虫的LC50值分别为39.15 和599.90 mmol/L,新狼毒素B 对松材线虫和拟松材线虫的LC50值分别为6.57 和12.49 mmol/L,处理72 h 后,异新狼毒素A 对松材线虫和拟松材线虫的LC50值分别为0.71 和0.76 mmol/L,新狼毒素B 对松材线虫和拟松材线虫的LC50值分别为0.48 和0.20 mmol/L,从表3 可以看出,在相同的处理时间下,新狼毒素B对两种线虫的触杀活性均强于异新狼毒素A 对二者的触杀活性。
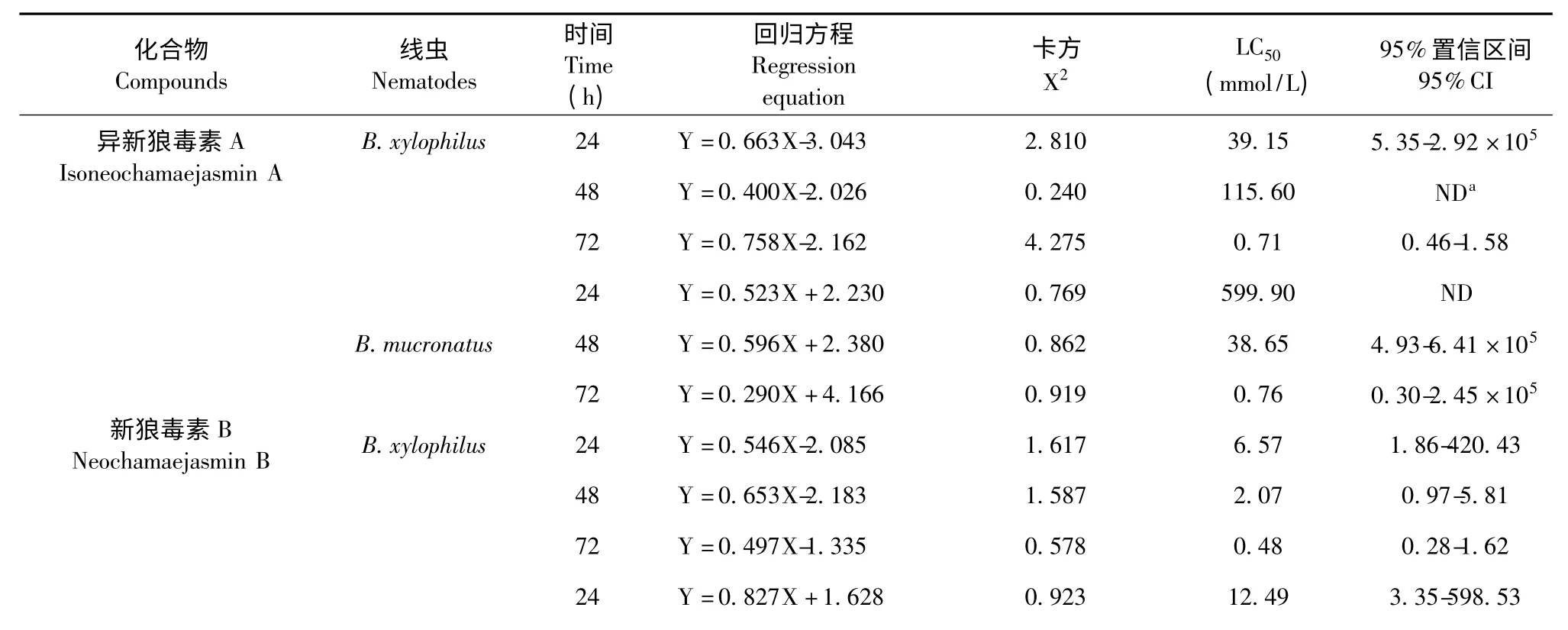
表3 瑞香狼毒根中活性物质对松材线虫和拟松材线虫的触杀活性影响Table 3 Nematicidal effect of the active compounds from the roots of S.chamaejasme on J2 of B.xylophilus and B.mucronatus

注:aND:未检测到;b阳性对照。Note:aND:Not detected;b Positive control.
3 讨论
通过对瑞香狼毒根乙醇提取物的乙酸乙酯萃取部位进行分离鉴定,得到了两个二氢黄酮类化合物,异新狼毒素A 和新狼毒素B,并研究了这两个二氢黄酮类化合物对林业上危害严重的松材线虫和与松材线虫形态相似的拟松材线虫的触杀活性。结果表明,两个二氢黄酮类化合物对松材线虫和拟松材线虫均显示出一定的触杀活性,且在相同的处理时间和浓度下,新狼毒素B 对两种线虫的触杀活性均强于异新狼毒素A。两个二氢黄酮类化合物的结构差别仅在于新狼毒素B 的相对构型是cis-trans,而异新狼毒素A 的相对构型则为cis-cis,说明两种化合物的活性差异可能与其立体构型有关。
瑞香狼毒是草原上广泛分布的一种毒草,与化学农药相比,它具有很多的优势如高效、低毒、无污染且对环境友好,如将其开发成植物源杀线虫剂具有一定的意义。再者将其变废为宝同时对于草原生态的建设也有一定的影响。本研究通过对瑞香狼毒根中活性物质的研究,为植物源杀线虫剂的开发提供了先导化合物,对我国林业线虫病的防治具有重要的意义。
1 Yang J(杨静),Li JJ(李敬君),Liu Q(刘强).Bioassay of methanol extracts from Cynanchum komarovii AL.iijinski on Bursaphelenchus xylophilus.Nat Prod Res Dev(天然产物研究与开发),2009,21:840-843.
2 Xu FY(徐福元),Xi K(席客),Xu G(徐刚),et al.Studyon the resistances of various year classes of Pinus massonian to pine wood nematode(PWN),Bursaphelenchus xylophilus.J Nanjing Fores Univ(南京林业大学学报),1994,3:27-33.
3 Wei SZ(魏素珍),Shi YM(史延梅),Chen FM(陈凤毛).Bursaphelenchus mucronatus and its pathogenicity.J Anhui Agri Sci(安徽农业科学),2010,38:20666-20667.
4 Gowen SR.Chemical control of nematodes:efficiency and side-effects.J Pestic Sci,2002,2:65-106.
5 Liu Y(刘英),Long RJ(龙瑞军),Yao T(姚拓).Research progress on Stellera chamaejasme L.in grassland.Pratac Sci(草业科学),2004,6:55-61.
6 Jiang ZH,Tanaka T,Sakamoto T,et al.Biflavanones,diterpenes and coumarins from the roots of Stellera chamaejasme L..Chem Pharm Bull,2002,1:137-139.
7 Jiangsu New Medical College(江苏新医学院).Dictionary Traditional Drugs(中药大辞典).Shanghai:Shanghai Scientific and Technical Publishers,1977.1898.
8 Cao H(曹挥),Liu SQ(刘素琪),Zhao LL(赵莉蔺),et al.The effects of the extracts from Stellera chamaejasme L.on the biological and enzyme activity of Tetranychus viennensis Zacher.Scientia Silvae Sinicae(林业科学),2003,1:98-102.
9 Hou TP(侯太平),Cui Q(崔球),Chen SH(陈淑华).New compounds against Aphides from Stellera chamaejasme L..Chin J Org Chem(有机化学),2002,1:67-70.
10 Guo X(郭霞),Ding WJ(丁文娇),Yang JY(杨甲月),et al.Studies on the nematicidal effective fraction of Stellera chamaejasme root extracts to Ditylenchus destructor.Plant Prot(植物保护),2011,1:128-131.
11 Feng BM(冯宝明),Pei YH(裴月湖),Zhang HL(张海龙),et al.Chemical constituents from roots of Stellera chamaejasme.Chin Tradit Herb Drugs(中草药),2004,35:12-14.
12 Niwa M,Tatematsu H,Liu GQ,et al.Isolation and structures of two new C-3/C-3″-biflavanones neochamaejasmin A and neochamaejasmin B.Chem Lett,1984,13:539-542.
