响应面法优化森林土磷脂脂肪酸的超声提取工艺
2014-01-09陈建中蒋小强
李 范,李 娜,陈建中,蒋小强,陈 怡,李 萍
1西南交通大学,成都 610031;2 中国科学院成都生物研究所,成都 610041
磷脂脂肪酸(phospholipid fatty acids,PLFAs)是活体生物细胞膜磷脂的重要成分,周转速率极快且随细胞死亡而迅速降解[1],脂肪酸结构与种类多样,对环境因素敏感,分析结果重复性较好[2]。既可用简单试剂和设备测定由PLFAs 转化的磷酸盐以确定微生物总量,也可以根据不同菌群的特定脂肪酸C 链长度、饱和度及羟基等取代基位置差异研究特殊功能菌群[1]。PLFAs 的稳定同位素分析联用技术可用于研究复杂土壤生态系统中微生物源有机质的代谢途径,并识别特定微生物种群特征,可将个别微生物种群与其相应的生物化学过程联系起来。因此,PLFAs 在土壤微生物学研究中极具潜力,PLFAs 技术已被用于细菌纯培养对外界胁迫的应答、根系排泄物对根际微生物影响、养分对泡囊丛枝菌的影响、农田土壤微生物区系特征以及诱导植物抗病性等领域[3];高寒湿地土壤微生物群落结构分析、重金属/有机物污染土壤植物修复、微生物对有毒底物降解过程、外加碳源利用等研究[4]。
脂肪酸分析方法在很大程度上依赖于标记脂肪酸来确定土壤微生物群落结构,因而标记上的变动,将导致群落估算上的偏差。如果脂肪酸的提取不完全,就会造成一些重要的信息丢失,所以应运用更好的实验方法尽可能地提取脂肪酸。已报道文献中,大部分用于提取土壤中脂质的方法是建立在Bligh和Dyer[5]的操作守则上的。根据这个操作方法所提取的总脂类,只能用于表征土壤总的微生物生物量。Tunlid 等[6]进一步发展了这个方法,通过提取和分离磷脂脂肪酸来确定土壤微生物的群落结构。此后,研究方法不断完善,但不同研究者选用的方法或多或少会有一些差异,如提取剂种类及使用量的不同、土样量以及提取时间的不同等。然而,只有少数的研究比较了不同提取方法对实验结果的影响。例如,Nielsen 和Pertersen[7]比较了提取剂(氯仿或二氯甲烷)、甲醇和缓冲液(pH7.4 的磷酸钾或pH4.0 的柠檬酸钠)四种不同组合方式对PLFAs 提取效果的影响,结果发现,氯仿+柠檬酸盐缓冲液对PLFA 的提取效率最高,而二氯甲烷+磷酸盐缓冲液的提取效率最低;同时指出,提取磷脂的颜色一般由黄色至棕色,它们主要是由腐殖酸引起的(占PLFAs 总量5%~10%)。Frostegård 等[8]评价了消化时间、消化方法、储存条件和提取液种类对土壤总脂类磷酸盐提取的影响。然而,总脂类磷酸盐分析与PLFAs 分析之间存在着很大的差异。目前尚未见采用响应面法超声辅助提取磷脂脂肪酸的报道,为此,本文以森林土为试验材料,通过对土壤PLFAs 提取过程中超声温度、超声时间及提取剂用量等因素的研究,使用响应面法[9]优化提取工艺,为PLFAs 技术分析复杂土壤微生物提供更精确的科学依据和数据参考。
1 材料与方法
1.1 材料
野外取样点位于四川省阿坝州茂县凤仪镇静州村大沟的中国科学院成都生物研究所茂县山地生态系统定位研究站(103°53'E,31°41'N),该区域地处青藏高原东缘横断山系北段高山峡谷地带的长江重要支流岷江上游中部,属暖温带亚高山季风气候,冬季寒冷干燥、夏季多雨。研究土壤为棕壤,植被类型为次生灌丛。年均温为8.9 ℃,年均降水量为919.5 mm。取土壤表层以下0~20 cm 处土壤,随机选择4 个点取土后混合作为一个土样,过2 mm筛,去掉石块、植物残根等杂物,装入塑封袋后置于放有冰袋的泡沫箱运回实验室,于-70 ℃下冷冻保存。正己烷、正十九烷酸甲酯(色谱纯,Sigma),C9-C20 脂肪酸混合标准品(批号112280,MIDI),甲醇、甲苯、氯仿、丙酮、乙酸等其他试剂均为分析纯。
1.2 仪器
1.3 实验方法
1.3.1 色谱分析条件
色谱柱为Agilent 19091B-102E(25 m ×0.2 mm×0.33 μm)石英毛细管柱;进样口温度250 ℃,进样口压力9.77 Psi,柱温箱温度170 ℃,汽化室温度250 ℃,检测器温度300 ℃。二阶程序升高柱温:170 ℃起始,5 ℃/min 室温升至260 ℃,而后40 ℃/min 升温至310 ℃,维持90 s;恒压模式,尾吹气N2(30 mL/min);进样量2 μL,进样分流比100∶1。
1.3.2 超声提取
称取8.0 g 冻干土(过2 mm 筛)置于特氟隆离心管中,加入21 mL 提取剂(氯仿∶甲醇∶柠檬酸缓冲液比为1∶2∶0.8)。在20 ℃下超声提取30 min,7200 rpm 离心5 min,收集上清液。原离心管中再加入21 mL 提取液,再次超声15 min,离心,合并上清液[5,6]。加入10 mL 柠檬酸缓冲液和10 mL 氯仿,静置过夜,分层。移去上层液体,37 ℃水浴N2吹干。采用购买的商品SPE 柱(天津艾杰尔公司),首先用5 mL 氯仿活化柱子,然后用1 mL 甲醇转移脂类到SPE 柱中。再分别加入5 mL 氯仿和10 mL 丙酮洗去中性脂和醣脂,最后用5 mL 甲醇淋洗磷脂,收集淋洗液并N2吹干。依次加入1 mL 甲醇甲苯混合液(1∶1)和1 mL KOH 甲醇溶液(0.2 mol/L),于37 ℃水浴15 min,加入2 mL 水、0.3 mL 醋酸(1 mol/L),再用正己烷(两次,2 mL/次)萃取磷脂脂肪酸甲酯,并N2吹干。样品溶解于100 μL 正十九烷酸甲酯(25 mg/L,溶剂为正己烷),转移到色谱瓶,上机检测。
1.3.3 PLFAs 含量标定与计算
PLFAs 含量标定与计算,以正十九烷酸甲酯(C19∶0)为内标,利用相关因子系数进行校正,计算土壤中的相应磷脂脂肪酸的浓度。

式中,ax为该磷脂脂肪酸甲酯在GC 图谱上的响应值(即积分面积);mi为内标磷脂脂肪酸甲酯的含量(单位:nmol/g);ai为内标磷脂脂肪酸甲酯在GC 图谱上的响应值。
所有试验重复3 次,以出现2 次以上的单体PLFAs 的浓度加和,计算总PLFAs 浓度(单位:nmol/g),视为衡量PLFAs 提取效率的参数。
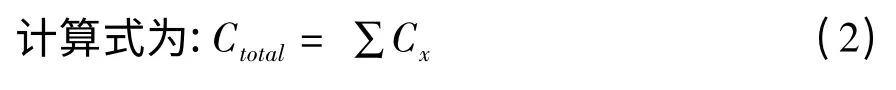
1.3.4 单因素实验
主要考察超声温度、超声时间、提取剂用量等因素对森林土PLFAs 提取效率的影响;本实验超声温度选取10、15、20、25、30 ℃五个水平;超声时间选择10、20、30、40、60 min 五个水平;提取剂用量选择17、19、21、23、25 mL/8 g 样品。按单因素分析方法进行实验。
1.3.5 响应面法优化PLFAs 提取条件
根据单因素实验结果,以超声温度(A)、超声时间(B)、提取剂用量(C)三个因素,以总PLFAs 提取率为响应值,选择Box-Behnken Design 响应面法优化分析方法进行设计和分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 温度对PLFAs 提取效率的影响
固定超声时间30 min,提取剂用量21 mL/8 g,选择超声温度分别为10、15、20、25、30 ℃,按照
1.3.2 进行实验。结果见图1(A)。
由图1 可见,总PLFAs 的含量随着温度的升高而提高,但是在25 ℃出现下降。温度的升高可促进溶液中分子的运动,有利于提高提取率,但由于大部分脂肪酸在20 ℃以下是稳定的,部分脂肪酸在超过25 ℃时易挥发,造成总PLFAs 含量降低,故选择超声温度为20 ℃。
2.1.2 提取时间对PLFAs 提取效率的影响
在超声温度20 ℃,提取剂用量21 mL/8 g,分别用不同的超声时间按照1.3.2 对森林土进行提取。提取时间对PLFAs 含量的影响如图1(B)所示。由图可知,随着超声作用时间的增加,森林土总PLFAs含量增加。但是超过40 min 后,总PLFAs 浓度有所下降,这可能是由于超声造成溶液温度的升高。据测量,超声时间每增加10 min,溶液温度上升3 ℃,超声时间越长温度上升越高,随着温度的上升,造成脂肪酸中不稳定的部分挥发损失。因此,选择提取时间30 min 左右较为合适。
2.1.3 提取剂用量对PLFAs 提取效率的影响
在超声温度20 ℃,提取时间30 min,森林土8 g,分别用17、19、21、23、25 mL 提取剂按照1.3.2 进行提取。提取剂用量对PLFAs 含量的影响如图1(C)所示。由图可知,随着超声作用时间的增加,总PLFAs含量上升;但当提取剂用量超过21 mL 后,总PLFAs 含量变化不明显,而且成本增加,不利于应用于大批量生态环境样品的处理,因此最佳提取剂用量为21 mL。

图1 超声温度(A)、提取时间(B)及提取剂用量(C)对总PLFAs 得率的影响Fig.1 Effect of ultrasonic temperature (A),extraction time (B)and amount of extraction solvent (C)on extraction yield of total PLFAs
2.2 响应面分析实验结果与数据分析

表1 响应面因素水平选取表Table 1 Factors and levels of response surface analysis
根据Box-Behnken Design 的原理,选取超声温度、超声时间、提取剂用量作为对森林土总PLFAs含量影响的主要因素,采用三因素三水平的响应曲面分析方法进行试验设计,试验自变量因素编码及水平见表1。
利用Design Expert 8.0 软件,通过表2 中总PLFAs 含量实验数据进行多元回归拟合,对实验结果进行响应面分析,得出回归模型方差分析表和响应曲线面图,分别见表3 和图2。

表2 Box-Behnken 中心组合设计方案及实验结果Table 2 Box-Behnken experimental design and results
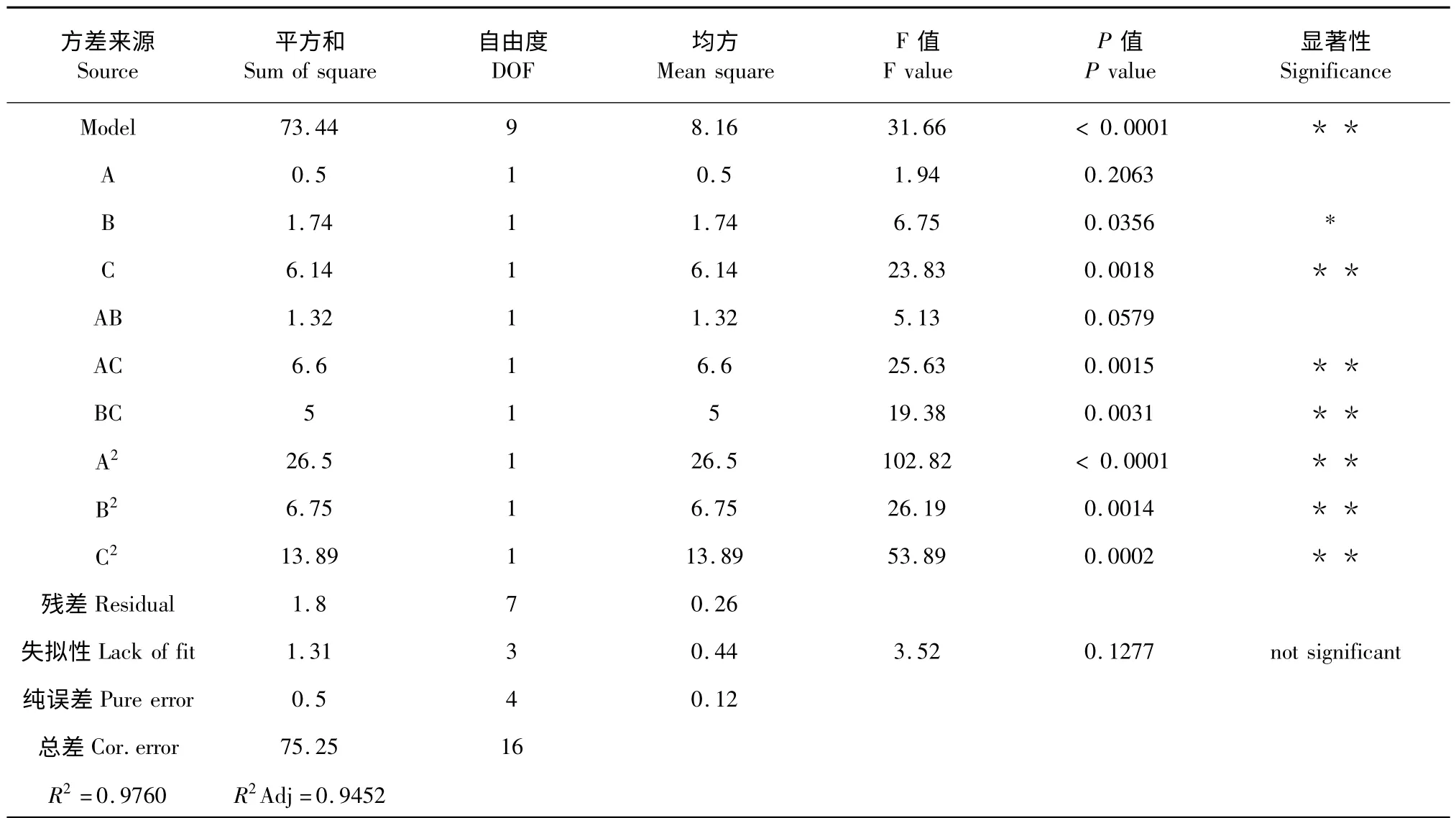
表3 拟合二次多项式模型的方差分析Table 3 Analysis of variance (ANOVA)for the fitted quadratic polynomial model

图2 各两因素交互作用对总PLFAs 提取效率影响的响应面图Fig.2 Response surface plots of mutual influences of extraction conditions on the extraction yields of total PLFAs
由方差分析结果可知:模型的F=31.66,P <0.0001,说明本实验所选用的二次多项模型具有高度的显著性。F失拟=3.52,失拟项P=0.1277 >0.05,失拟不显著。模型的决定系数R2Adj=0.9452,说明该模型能够解释94.52%的响应值变化。因此,该模型拟合程度较好,可以用此模型来分析和预测超声波辅助提取森林土中总PLFAs 的工艺条件。在总的作用因素中,回归方程一次项、二次项及交互项AC、BC 均具有较高的显著性,表明超声温度、超声时间、提取剂用量以及超声温度与提取剂用量、超声时间与提取剂用量的交互作用对森林土中总PLFAs 得率有较显著影响。
通过拟合可求出影响因素的一次效应、二次效应及其交互效应的关联方程,多元回归拟合分析得到森林土总PLFAs 提取效率Y 与各因素变量(A 超声温度,B 超声时间,C 提取剂用量)的二次方程模型为:
Y=46.33-0.25A +0.47B +0.88C +0.58AB +1.29AC+1.12BC-2.51A2-1.24B2-1.82C2
从表3 中方差分析结果可知方程一次项、二次项的影响均极显著,说明分析结果可靠;从试验所得的响应面分析结果可以找到它们在提取过程中的交互作用,如表3 和图2 可知超声温度与提取剂用量、超声时间与提取剂用量之间的交互作用显著,其余项间的交互作用不明显。根据Design Expert 8.0 软件对实验结果进行最优化分析,确定最佳的提取条件为:超声温度20.47 ℃,超声时间33.78 min,提取剂用量21.78 mL,在此条件下,预测提取总PLFAs浓度为46.5774 nmol/g。
2.3 验证实验
为了验证上述模型的可信度与合理性,根据模型预测结果进行近似验证实验。取8 g 森林土在温度20 ℃,提取时间30 min,提取剂用量21 mL 条件下,提取总PLFAs 浓度为45.57 nmol/g (n=3,单体PLFAs 个数35 个)。
3 讨论
用超声辅助法提取森林土中总PLFAs,根据单因素实验结果,采用Box-Behnken 试验设计及响应面分析对提取工艺进行优化,得出最佳提取条件为:超声温度20 ℃,超声时间30 min,提取剂用量21 mL/8 g 土壤样品。在此条件下,总PLFAs 浓度为45.57 nmol/g(n=3,单体PLFAs 个数35 个)。该研究结果对森林土中总磷脂脂肪酸的提取研究提供一定的参考价值,具有一定的实际应用前景。
1 Hill TC J,Mcpherson EF,Harris JA,et al.Microbial biomass estimated by phospholipid phosphate in soils with diverse microbial communities.Soil Biol Biochem,1993,25:1779-1786.
2 Bossio DA,Scow KM,Gunapala N,et al.Determinants of soil microbial communities:effects of agricultural management,season,and soil type on phospholipid fatty acid profiles.Microb Ecol,1998,36(1):1-12.
3 Eroshin VK,Dedyukhina EG.Effect of lipids from Mortierella hygrophila on plant resistance to hytopathogens.World J ofMicrob Biot,2002,18:165-167.
4 Banks ML,Kennedy AC,Kremer JR,et al.Soil microbial community response to surfactants and herbicides in two soils.Appl Soil Ecol,2014,74(2):12-20.
5 Bligh EG,Dyer WJ.A rapid method of total lipid extraction and purification.Can J Bio Physiol,1959,37:911-917.
6 Tunlid A,Barid BH,Trexler MB,et al.Determination of phospholipids ester-linked fatty acid and polyβ-hydroxybutyrate for the stimulation of bacterial biomass and activity in the rhizosphere of the rape plant Brassica napus (L.).Can J Microb,1985,31:1113-1119.
7 Drenovsky RE,Elliott GN,Graham KJ,et al.Comparison of phospholipids fatty acid (PLFA)and total soil fatty acid methyl esters (TSFAME)for characterizing soil microbial communities.Soil Biol Biochem,2004,36:1793-1800.
8 Frostegård Å,Tunlid A,Bååth E.Microbial biomass measured as total lipid phosphate in soils of different organic content.J Microb Meth,1991,14(3):151-163.
9 Zhang QL(张秋龙),Liang YX(梁永欣),Li WC(李文聪),et al.Optimization of ultrasonic-assisted extraction of total flavonoids from Hypecoum leptocarpum Hook.F.et Thoms by response surface analysis.Nat Prod Res Dev (天然产物研究与开发),2013,25:841-845.
