高活性玉米醇溶蛋白提取工艺的研究
2014-01-09王宇晓陶海腾徐同成刘丽娜斌刘刘振华杜方岭董海洲
王宇晓 陶海腾 徐同成 刘丽娜 邱 斌刘 玮 刘振华 杜方岭 董海洲
高活性玉米醇溶蛋白提取工艺的研究
王宇晓1,2陶海腾2徐同成2刘丽娜2邱 斌2刘 玮2刘振华2杜方岭2董海洲
(山东农业大学食品科学与工程学院1,泰安 271018)
(山东省农业科学院农产品研究所2,济南 250100)
为了得到活性最高的玉米醇溶蛋白(zein),以DPPH·清除率为指标,采用响应面法优化提取工艺。通过对提取时间、乙醇体积分数、温度进行单因素试验,进行多重比较后,采用Box-Behnken响应面设计进行优化。影响因素主次顺序为:乙醇体积分数>时间>温度。优化后的提取条件:提取时间50 min、乙醇体积分数55%、温度38℃。在此提取条件下,验证其自由基的清除率达到58.58%,同时提取率达到72.67%,优化的条件兼顾了抗氧化活性和提取率。
响应面法 玉米醇溶蛋白 自由基清除率 抗氧化
玉米醇溶蛋白(zein)是由平均相对分子质量为25 000~45 000的蛋白质组成的混合物,它受肽主链上的羟基与亚氨基的氢键作用,形成α-螺旋体;有底表面能,具有独特的成膜特性,并且对环境影响小,生产中应用越来越广泛。Gorham于1821年命名了zein,几乎所用的zein都在胚乳中,而谷蛋白分布在胚乳和胚芽之间[1]。玉米蛋白粉(CGM)为玉米淀粉生产的副产物,蛋白含量超过60%,是zein提取的主要原料。目前,zein的获得主要通过以乙醇、异丙醇等醇类溶剂法提取。Takahashi等[2]用95%乙醇,按料液比1∶8在70℃水浴下混合15 min从CGM提取zein,然后在-10℃下沉淀蛋白。Wu等[3]用88%异丙醇在pH 12.5从CGM中提取zein,然后冷冻沉淀,回收率21.3%~32.0%,纯度82.1%~87.6%,技术比较成熟。但以往的研究在关注得率和纯度的同时,却忽略了提取条件对生物活性的影响。
提取过程中的pH值、温度、溶剂浓度等因素都会对玉米醇溶蛋白的生物活性有一定的影响,Zhang等[4]研究了酸碱处理对α-zein结构、流变性和抗氧化活性的影响,发现在pH 2.7与12.5下其抗氧化活性比pH 3.3、6.5、10.5的要高,这可能是由于在pH 2.7和12.5下谷氨酰胺更容易脱酰胺形成谷氨酸,但是酸性条件下α-zein的结构已经改变。蛋白或者多肽的抗氧化活性与特定的氨基酸残基或短肽有关系[5-6],Saiga等[7]发现富含天冬氨酸和谷氨酸的短肽具有很强的抗氧化活性,zein的自由基清除能力与其含有的 His、Arg、Ala、Val、Met、Leu等有关系[8]。本研究从抗氧化活性入手,研究提取条件的改变对zein抗氧化活性的影响。试验对提取因素进行优化,以DPPH·清除率为指标,为高活性玉米醇溶蛋白的制备提供参考。
1 材料与方法
1.1 材料与试剂
CGM:西王集团;DPPH:Sigma公司;分析纯无水乙醇:天津科密欧化学试剂有限公司。
1.2 仪器与设备
754N紫外可见分光光度计:上海奥谱勒仪器有限公司;K9860全自动凯氏定氮仪:美国海能;CR22GⅢ高速冷冻离心机:日立公司;HJ-6A多头磁力加热搅拌器:常州国华电器有限公司;SHZ-DⅢ循环水式多用真空泵:巩义京华仪器责任有限公司;lab dancer涡旋:IKA。
1.3 方法
1.3.1 CGM脱色
因zein不溶于无水乙醇,因而采用无水乙醇进行超声脱色。按照1∶6料液比,脱色2次[9],得到充分脱色的玉米蛋白粉。
1.3.2 DPPH·清除率计算
0.1 mL提取溶剂加入 3.9 mL(0.04 mg/mL)DPPH·记为 B1,0.1 mL样品加入 3.9 mL(0.04 mg/mL)DPPH·记为 B2[10],混匀后避光反应 30 min,在517 nm下测定吸光度。
DPPH·清除率/% =(1-B2/B1)×100
1.3.3 单因素试验
准确称取脱色蛋白粉0.500 0 g,加入10 mL离心管中,加入料液比1∶6[9]的乙醇水溶液,然后涡旋充分,平行3次。在其他条件相同的情况下,对时间、乙醇体积分数、温度进行试验,研究各个因素对DPPH·清除率的影响。
1.3.4 响应面分析试验
在单因素试验的基础上,本试验选取的参数范围为:时间40~50 min,乙醇体积分数55%~65%,温度38~42℃,选用三因素三水平Box-Behnken响应面设计进行试验,其因素水平表见表1。

表1 响应面因素与水平
1.3.5 粗蛋白含量测定
称取0.500 0 g脱色蛋白粉,按照玉米类粗蛋白转化系数6.25[11],用凯氏定氮仪测定粗蛋白含量A1。用移液枪吸取1mL提取液,按转化系数6.25测定粗蛋白含量A2。
提取率/%=A2×离心液体体积÷(A1×0.500 0),因按1∶6料液比,其中离心液体体积按3 mL计算。
1.3.6 数据处理
单因素试验及粗蛋白含量测定进行3次平行试验,试验结果用SAS 9.2进行LSD法多重比较。
2 结果与分析
2.1 单因素试验结果
2.1.1 时间对DPPH·清除率的影响
在乙醇体积分数80%,温度45℃下,研究不同的提取时间对DPPH·清除率的影响,结果见图1。由图1可知,在0~45 min其自由基清除率快速上升,在45~90 min其自由基清除率依然上升但是上升速率减慢。尽管通过多重比较,75~90 min DPPH·清除率相对最高,但是耗时过长。60 min比45 min的清除率提高2.68%,尽管75 min自由基清除率高,但是考虑过长时间可能对蛋白产生不利影响且能耗高,因而选取时间为45 min。
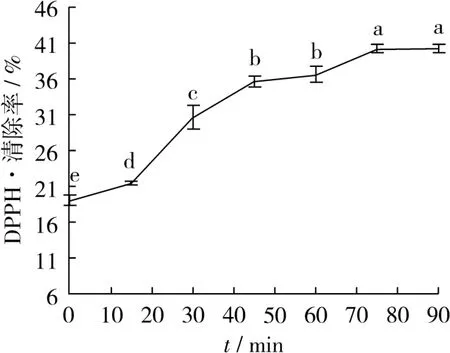
图1 时间对DPPH·清除率的影响
2.1.2 乙醇体积分数对DPPH·清除率的影响
在时间45 min,温度45℃下,研究不同的乙醇体积分数对DPPH·清除率的影响。通过图2可知,用60%的乙醇溶液,其DPPH·清除率最大。60%与70%的乙醇之间差异不大。但是90%的DPPH·清除率急速下降,这可能是因为zein在乙醇体积分数低于40%或者高于90%时,都产生沉淀和絮凝2个状态[12],其溶解度比较低[13]。
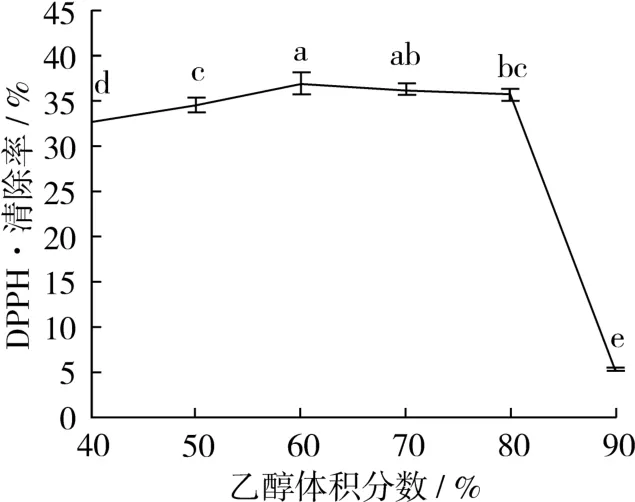
图2 乙醇体积分数对DPPH·清除率的影响
2.1.3 温度对DPPH·清除率的影响
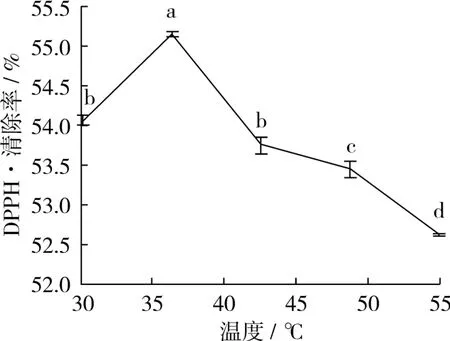
图3 温度对DPPH·清除率的影响
在时间45 min,乙醇体积分数60%下,研究不同的温度对DPPH·清除率的影响。通过图3,温度40℃时,DPPH·清除率最高,且不同温度对DPPH·清除率的差异显著。DPPH·清除率总体趋势在40℃达到最大,然后下降,因而选取温度40℃。
2.2 响应面分析结果
由表3主模型方差分析可看出,X2、X1X3、X2X3为显著性影响因素。其模型的显著性 P>F为0.016 3,达到显著水平。R2为0.936 2,说明响应值的变化有0.936 2来源于所选变量。上述结果表明模型能够较好反映响应值的变化,模型拟合程度较好。由表3可以看出,影响因素主次顺序为:乙醇体积分数>时间>温度。
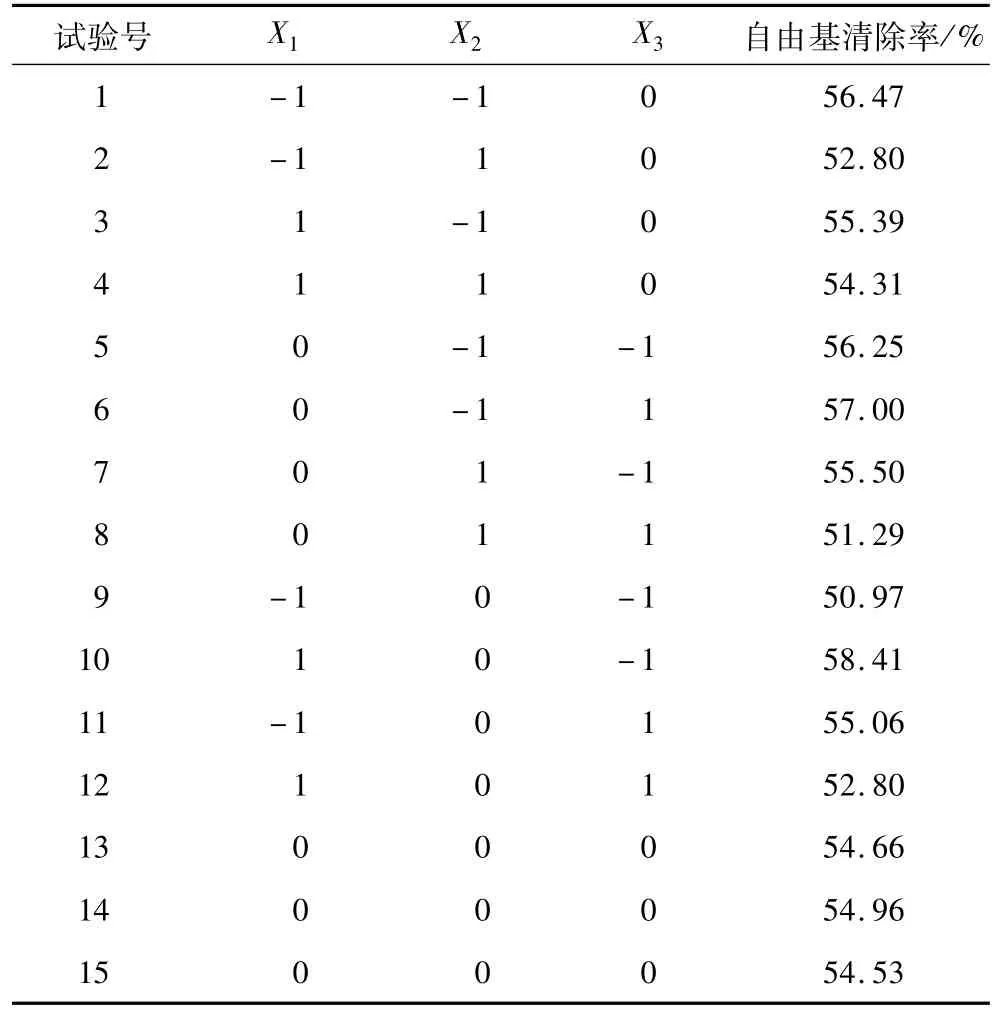
表2 响应面试验设计及结果
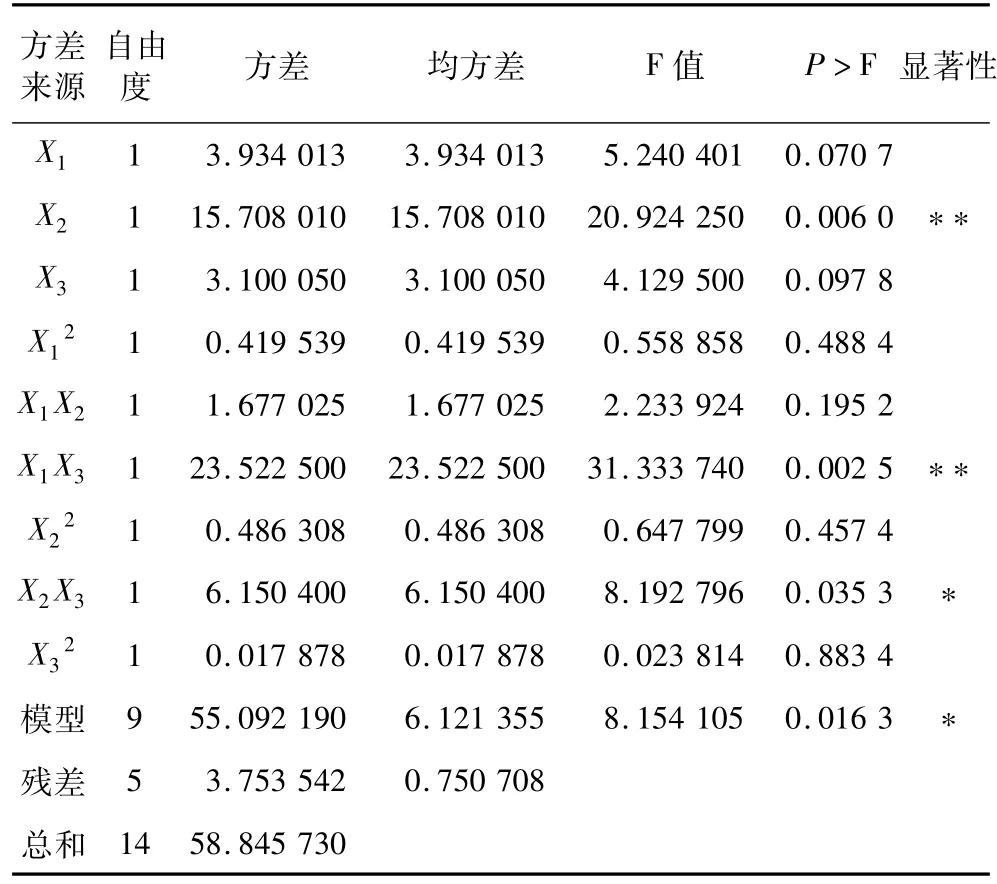
表3 主模型自由基清除率方差分析
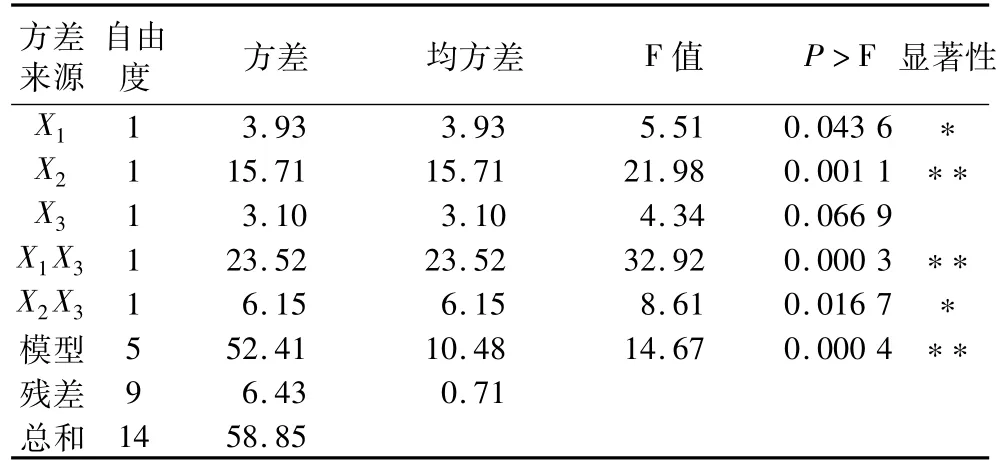
表4 预测模型自由基清除率方差分析
根据表3,选取显著性因素 X2、X1X3、X2X3和所选因素X1、X3进行预测模型拟合。表4可见,模型的P>F值为0.000 4,达到极显著水平。预测模型为Y1=54.69+0.70X1-1.40X2-0.62X3-2.43X1X3-1.24X2X3,其清除率优化结果为时间50 min,乙醇体积分数55%,温度38℃,此时DPPH·清除率达到58.60%。在最优条件下进行试验,实际DPPH·清除率为58.58%,模型可以较好预测DPPH·清除率。试验得到的zein的DPPH·清除率远比Zhang等[4]研究用的商品α-zein高,这与提取的zein中β与γ残基的存在有关。
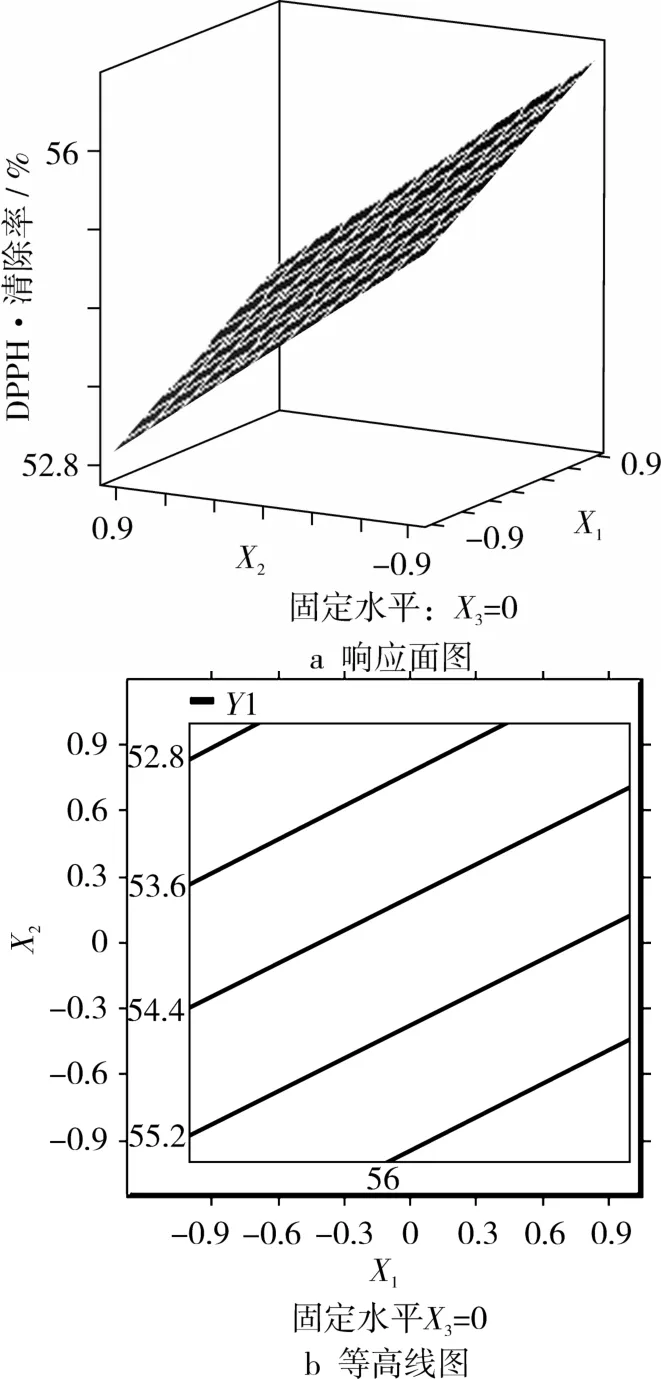
图4 时间(X1)和乙醇体积分数(X2)对DPPH·清除率的响应面图和等高线图
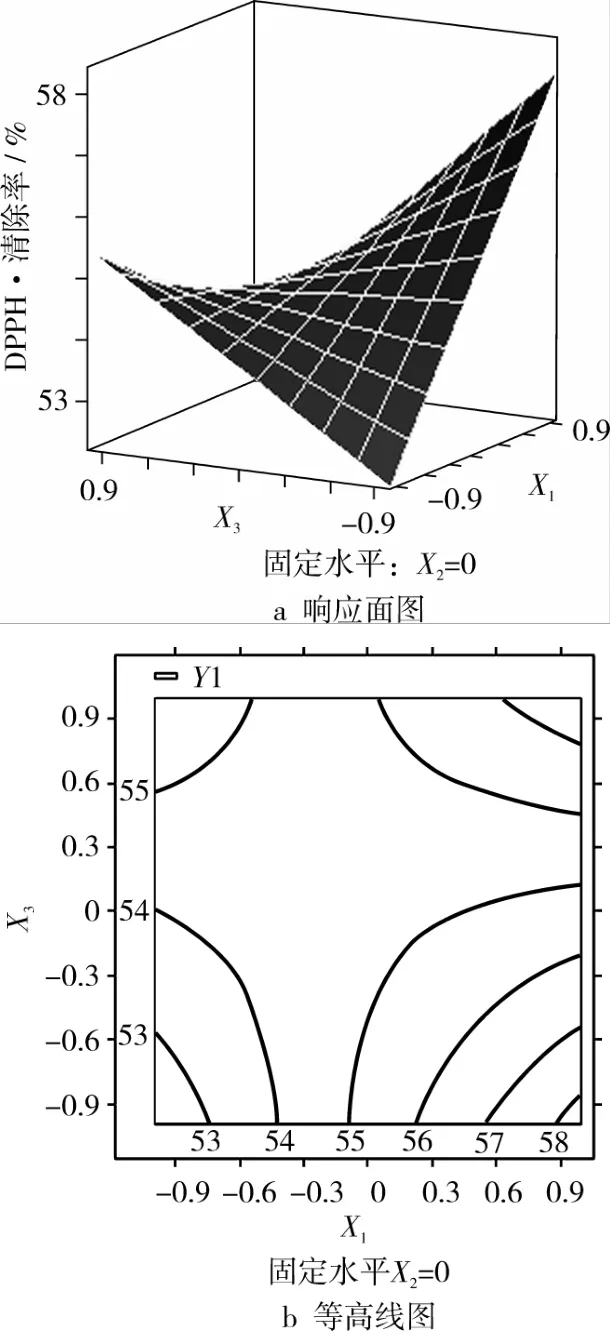
图5 时间(X1)和温度(X3)对DPPH·清除率的响应面图和等高线图
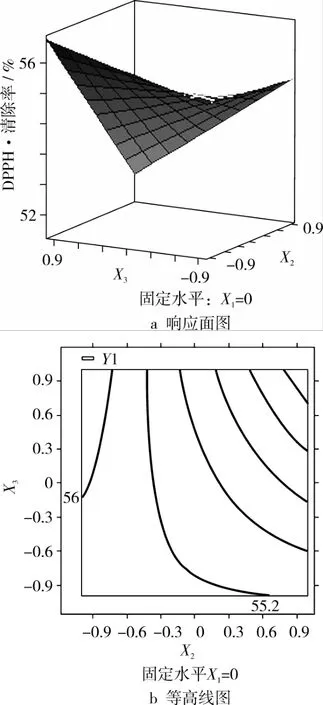
图6 乙醇体积分数(X2)和温度(X3)对DPPH·清除率的响应面图和等高线图
通过图4,可以看出时间与乙醇体积分数的交互作用不显著。图5中,通过等高线的疏密,可以看出时间与温度交互作用显著。图6中,乙醇浓度与温度的交互作用也显著。
2.3 醇溶蛋白含量
试验测得脱色蛋白粉粗蛋白含量63.98%,1 mL提取液醇溶蛋白含量7.75%。通过公式,提取率达到72.67%。
3 结论
试验以DPPH·清除率为指标,与以得率或纯度为指标的研究点不同。通过研究时间、乙醇体积分数、温度对DPPH·清除率影响,得到其影响因素主次顺序为:乙醇体积分数>时间>温度。
通过响应面优化确定参数为时间(X1)50 min,乙醇体积分数(X2)55%,温度(X3)38℃,DPPH·清除率达到58.58%。同时,提取率达到72.67%。本试验优化的条件兼顾了抗氧化活性和提取率。
[1]Shukla R,Cheryan M.Zein:the industrial protein from corn[J].Industrial Crops and Products,2001,13(3):171-192
[2]Takahashi H,Yanai N.Process for producing zein:U.S.Patent 5,510,463[P].1996-04-23
[3]Wu S,Myers D J,Johnson L A.Factors affecting yield and composition of zein extracted from commercial corn gluten meal[J].Cereal Chemistry,1997,74(3):258-263
[4]Zhang B,Luo Y,Wang Q.Effect of acid and base treatments on structural,rheological,and antioxidant properties ofαzein[J].Food Chemistry,2011,124(1):210-220
[5]Chen H M,Muramoto K,Yamauchi F,et al.Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1996,44(9):2619-2623
[6]Hernández-Ledesma B,Amigo L,Recio I,et al.ACE-inhibitory and radical-scavenging activity of peptides derived fromβ-lactoglobulin f(19-25).Interactions with ascorbic acid[J].Journal of Agricultural and Food Chemistry,2007,55(9):3392-3397
[7]Saiga A I,Tanabe S,Nishimura T.Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J].Journal of Agricultural and Food Chemistry,2003,51(12):3661-3667
[8]Chen H M,Muramoto K,Yamauchi F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46(1):49-53
[9]黄国平.玉米醇溶蛋白的超声波提取,改性与释药性能的研究[D].广州:华南理工大学,2004
[10]郭刚军,何美莹,邹建云,等.苦荞黄酮的提取分离及抗氧化活性研究[J].食品科学,2008,29(12):373-376
[11]王章存,姚惠源.凯氏定氮法测定大米蛋白质时蛋白系数的确定[J].食品科学,2004,25(1):158-160
[12]Wang Y,Padua GW.Formation of zein microphases in ethanol-water[J].Langmuir,2010,26(15):12897-12901
[13]Shukla R,Cheryan M,DeVor R E.Solvent extraction of zein from dry-milled corn[J].Cereal Chemistry,2000,77(6):724-730.
Extraction Technology of Zein with High Bioactivity
Wang Yuxiao1,2Tao Haiteng2Xu Tongcheng2Liu Lina2Qiu Bin2Liu Wei2Liu Zhenhua2Du Fangling2Dong Haizhou1
(College of Food Science and Engineering,Shandong Agricultural University1,Taian 271018)
(Institute of Agro-Food Science and Technology,Shandong Academy of Agricultural Sciences2,Jinan 250100)
In order to get the zein with higher activity,the DPPH radical scavenging rate was used as response value.Time,ethanol concentration and temperature were treated as the three single factors.After multiple comparisons,the conditions of DPPH radical scavenging rate were optimized by Box-Behnken response surface method.The order of primary factors:ethanol concentration>time>temperature.The conditions could be optimized as following:time 50 min,ethanol concentration 55%,temperature 38℃.The DPPH radical scavenging rate was 58.58%,and extraction rate reached 72.67%,the optimal condition guarantee both antioxidant activity and extraction rate.
response surface,zein,radical scavenging rate,antioxidant
TS253.1
A
1003-0174(2014)03-0047-05
863计划(2013AA102206)
2013-05-23
王宇晓,男,1989年出生,硕士,粮油加工
董海洲,男,1957年出生,教授,博士生导师,粮油食品加工
