棉籽油中DNA不同提取方法的比较研究
2014-01-09付晓华
付晓华 张 岩 张 薇 王 红, 吴 涛 周 巍,3
棉籽油中DNA不同提取方法的比较研究
付晓华1张 岩2张 薇2王 红1,2吴 涛2周 巍2,3
(河北师范大学生命科学院1,石家庄 050024)
(河北省食品安全监督检验研究院2,石家庄 050071)
(河北农业大学食品科技学院3,保定 071000)
在食用油DNA提取的SDS法和国标法基础上,设计5种不同方案对15种来自不同生产厂家及加工精度的棉籽油进行DNA的抽提,通过比较各来源DNA提取液中内源基因tRNALeu的PCR扩增结果判断DNA的提取效率;并对方案5获得的DNA样品进行外源基因FMV35S的PCR扩增以检测转基因成分。结果表明方案5提取棉籽油DNA的效率最高,而且方案5提取到的DNA能用于棉籽油的转基因成分定性检测。
棉籽油 DNA提取 富集 转基因物种
食用油安全是人们健康生活的保证。棉籽油多以棉籽浸制而成,在人体内的消化吸收率可达98%,其亚油酸含量高(44.0%~55.0%),可有效抑制血液中的胆固醇;此外还含棕榈酸、硬脂酸、油酸、花生酸等营养成分。过去由于粗制棉籽油中含有游离棉酚,限制了人们的大量食用。随着加工工艺的改进,精制棉籽油将棉酚有效去除,棉籽油的市场占有率呈现增长趋势。棉籽油已成为很多食用调和油的主要成分。
转基因作物的种植率近年来不断增加,转基因食用油的市场占有率也越来越高。2002年,《农业转基因生物标识管理办法》中要求对上市的大豆油、玉米油、油菜籽油、棉花种子进行转基因标识。2003年规定了对食用油脂中转基因植物成分定性PCR检测的方法[1-2]。这为油脂原料成分的鉴定和标签标识检验提供了技术保证,对保护消费者权益和确保食品安全具有重要意义。
目前转基因成分检测主要依靠蛋白质检测和核酸检测两方面。蛋白质检测常规方法主要
有ELISA法,即酶联免疫吸附测定法,其原理是利用表达的抗原与目标抗体间结合的特异性来检测特定蛋白的存在。核酸检测法则主要依赖聚合酶链式反应,其利用与靶序列两端互补的寡核苷酸引物对DNA序列进行检测,具有更高的检测灵敏度。由于特征基因已知,食用油脂中的转基因植物成分定性检测主要通过核酸检测技术鉴定[3-13]。简便高效的DNA提取方法,是进行核酸检测和转基因标签鉴定的基础。
DNA的提取方法已不断深入,发展较成熟的DNA提取方法有硅藻土法、磁珠法、离心柱法和试剂盒法等[14]。梅玲玲等[15]用蛋白酶 K裂解法提取出多种食品中的转基因成分,从中获得高浓度的食用油 DNA提取液;程红梅等[5]、袁建琴等[6]用中性磷酸盐缓冲溶液(PBS)和正己烷提取出大豆油中的DNA;杨冬燕等用CTAB直接抽提精炼植物油,得到了目的DNA。但由于精炼食用油中DNA含量本身很少,不能保证所有油中的DNA提取成功。因此,开发成本低、高效、稳定的方法是油类DNA检测研究的重点。
目前DNA的常用提取试剂有SDS和CTAB 2种。本试验用CTAB和SDS 2种常规提取液,采用5种方案对15种来自不同生产厂家及加工精度的棉籽油进行DNA的提取。通过扩增内源基因tRNALeu并进行琼脂糖凝胶电泳,对各方案的DNA提取效率进行评价,以期获得一种简便高效的DNA提取方法。
1 材料与方法
1.1 试剂及主要试剂的配制
三羟甲基氨基甲烷(Tris)、醋酸钠(NaAc):天津市博迪化工有限公司;乙二胺四乙酸二钠(Na2EDTA):北京鼎国昌盛生物技术有限责任公司;十六烷基三甲基溴化铵(CTAB):天津市科密欧化学试剂有限公司;十二烷基硫酸钠(SDS):北京拜尔迪生物公司;分析纯级三氯甲烷、异戊醇、异丙醇、无水乙醇、氯化钠(NaCl):天津市永大化学试剂有限公司;β-巯基乙醇:Amresco公司;100 bp DNA Ladder Marker,rTaq预混液、引物tRNALeu、FMV35S:大连宝生物技术公司合成。
担体:本单位自提非转基因大豆基因组DNA;TE缓冲液:Tris 0.010 mol/L,Na2EDTA 1.0 mmol/L,pH 8.0;CTAB提取液:CTAB 20 g/L,NaCl 1.4 mol/L,Tris 0.1 mol/L,Na2EDTA 0.02 mol/L,pH 8.0。
1.2 试验材料与仪器
试验仪器:恒温水浴锅:余姚市东方电工仪器厂;恒温震荡器:金坛市富华电器有限公司;MS3涡旋混匀器:IKA公司;水平电泳仪:北京市六一仪器厂;050-811 Tgradient96定性 PCR仪:Biometra TGradient公司;凝胶成像系统:Bio-Rad公司。
表1 棉籽油试验材料
1.3 棉籽油DNA的提取
本试验采用SDS和CTAB 2种常规提取液,以SDS法和国标法[1]为基础,并对国标法进行优化,最终确立SDS法、国标法、大量富集法、直接裂解法、上清重复离心法5种方案。由于5种方案遵循共同的DNA提取步骤,精简介绍如下:A.DNA富集:TE缓冲液中加入棉籽油,混匀后,13 000 r/min,室温离心3 min,弃油脂;重复多次使 DNA富集于水相。水相400μL/管分装于1.5 mL离心管。B.裂解:水相中加入SDS/CTAB提取液,65℃水浴30 min,每10 min轻微摇匀1次。C.纯化,分离有机相:SDS提取液裂解后加入醋酸钠溶液(NaAc),而用CTAB提取液裂解后加入等体积三氯甲烷:异戊醇(24:1);轻微混匀后静置,13 000 r/min,离心 5 min,转移上清;反复抽提1次;D.沉淀DNA:上清中加入担体及沉淀剂,轻微混匀后-20℃过夜;13 000 r/min,4℃,离心 10 min,弃上清;E.洗涤,干燥:用70%乙醇洗涤沉淀2次,干燥15 min;F.溶解 DNA:加入0.1×TE溶解 DNA,37℃保温1 h后,4℃保存。
在基本流程的基础上,5种DNA提取方案的优化流程不同,具体步骤如下:
1.3.1 SDS法
A.400μL TE缓冲液中加入1 mL棉籽油,上下颠倒混匀5 min,离心3 min;去上层油脂;重复20次,得约400μL水相;→B.水相中加入200μL 20%SDS,水浴;→C.加入 100μL 5 mol/L NaAc,轻轻摇匀,冰上放置30 min,离心10 min;→D.将上清移至新离心管,加入1μg担体、等体积无水乙醇和0.1倍体积3 mol/L NaAc(pH 5.2),颠倒混匀后,-20℃放置2 h;离心,弃上清;→E.沉淀用500μL 70%乙醇洗涤两次,干燥15 min;→F.加入30μL 0.1×TE。
1.3.2 国标法
A.DNA富集同1.3.1;→B→C→D.沉淀DNA时加入1μg担体,450μL异丙醇;→E.500μL 70%乙醇洗涤两次;→F.加30μL 0.1×TE溶解DNA。
1.3.3 大量富集法
A.50 mL离心管中加入5 mL TE和35 mL棉籽油,富集15次并400μL/管分装水相;→B→C.纯化后所有上清移至一个10 mL离心管;→D.沉淀DNA时加入10μg担体,0.6倍体积的异丙醇;→E.2 mL 70%乙醇洗涤2次;→F.用50μL 0.1×TE溶解DNA,37℃水浴1 h后移至1.5 mL离心管,4℃保存。
1.3.4 直接抽提法
A.50 mL离心管中加入5 mL含1%β-巯基乙醇的CTAB提取液(现用现配,65℃预热)和35 mL棉籽油,180次/min,45℃,振荡 30 min后,离心 5 min。去除油层,富集6次。水相按600μL/管加入1.5 mL离心管中;→C.每管加600μL三氯甲烷:异戊醇进行纯化,纯化后所有上清移至10 mL离心管;→后续步骤同1.3.3。
1.3.5 上清重复离心法
A.50 mL离心管中加入35 mL棉籽油和5 mL TE,平置于振荡仪,固定,180次/min,37℃,振荡 30 min,离心5 min,去油脂层;富集 10次并 400μL/管分装水相;→B→C.纯化同1.3.3;→D.沉淀DNA时加入10μg担体,0.6倍体积的异丙醇,-20℃过夜后离心15 min;并将上清轻轻移至另一10 mL离心管重复离心一次,弃上清;→E.2管均用2 mL 70%乙醇洗涤两次;→F.2管中各用30μL 0.1×TE溶解DNA,37℃水浴1 h后移至同一个1.5 mL离心管,4℃保存。
1.4 效果评估
由于各方案在沉淀DNA过程中都加入了担体,无法检测棉籽油DNA实际浓度和纯度,因此用PCR扩增结果比较各方案的DNA提取效率。本试验对小片段内源基因tRNALeu(180 bp)进行PCR扩增,以其产物的凝胶成像结果评估食用棉籽油DNA的提取效果,并对提取效率最高的方案中获得的DNA进一步用外源基因FMV35S(210 bp)进行扩增,验证DNA产物能否进行棉籽油转基因成分检测。
1.4.1 PCR引物序列

表2 PCR引物序列及产物大小
1.4.2 μL PCR反应体系
rTaq预混液12.5μL,10 mmol/L的上下游引物各1μL,DNA模板3μL,去离子水7.5μL。空白对照以无菌双蒸水代替样品提取DNA,阴性对照以担体DNA为扩增模板,阳性对照以转基因棉籽油为底物,在各方案中提取的DNA为扩增模板。
1.4.3 PCR扩增程序
tRNALeu扩增程序:变性阶段:95℃,4 min。扩增阶段:95℃,30 s;55℃,30 s;72℃,60 s;循环 30次。延伸阶段:72℃,5 min。4℃终止反应。
FMV35S扩增程序:变性阶段:95℃,5 min。扩增阶段:95℃,20 s;55℃,40 s;72℃,60 s;循环 40次。延伸阶段:72℃,5 min。4℃终止反应。
1.4.4 电泳检测
取10μL PCR扩增产物进行1.5%琼脂糖凝胶电泳,凝胶成像仪下观察电泳结果。
2 结果与分析
2.1 样品tRNALeu基因PCR检测结果
图1为以5种方案提取的DNA为模板,进行内源基因tRNALeu扩增产物电泳图。
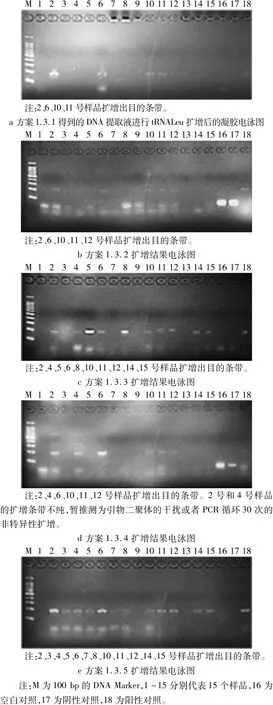
图1 5种方案提取的DNA产物进行tRNALeu扩增后的电泳结果
图1结果显示,SDS法扩增的目的条带最少,国标法次之,直接抽提法、大量富集法、上清液重复离心法提取效率依次增高,分别得到4、5、6、10、12个目的条带。其中2、6、10、11号样品在5种方案中都扩增出目的条带,2号和6号样品DNA扩增条带最亮,表明其DNA浓度高;1、9、13号样品均未扩增成功;其他样品DNA在部分方案中扩增出目的条带。
从加工程度分析,2号和6号样品为浸出三级棉籽油,10号和11号样品为半精炼棉籽油,DNA在5种方案中全部提取成功;1、9、13为全精炼棉籽油,5种方案均未提取成功。表明棉籽油精炼程度越深,DNA降解越严重,含量可能越少。从样品存放时间来看,3、9、13号样品的存放时间均超过6个月,其他样品的存放时间较短。食用油长期存放也可能加重DNA的降解程度。
DNA富集步骤中,方案SDS法和国标法的底物少,DNA提取效率低,后3种方案将样品大量富集后,DNA提取效率增高。其中大量富集法是国标法的直接改进,加大样品富集量后,提取DNA效率比国标法增高了1倍。从操作步骤进行分析,SDS法产物低也可能是沉淀过程中的pH不当,影响了DNA的完全沉淀,造成DNA流失。直接裂解法用CTAB进行富集和裂解处理,步骤简单,但结果提取效率偏低,可能由于富集过程油相和水相的交界面出现较多的膏状物质,形成了固体斜面,将其去除后水相产物减少;另外,该方案在CTAB提取液中加入1%β-巯基乙醇用于消泡、抗氧化及去除酚类,提取效率却没有提高,推测酚类物质可能极少,不会干扰DNA的提取效率。上清重复离心法是本试验的最优提取方案,在样品大量富集的基础上将离心管平置振荡,加大了DNA在水相的溶解程度;适当延长了离心沉淀的时间,并将异丙醇沉淀后的上清液重复离心,DNA提取效率最高。
2.2 外源基因检测结果
图2为以方案5提取到的12个DNA产物为模板,进行FMV35S外源基因扩增的凝胶电泳图,含转基因成分的 3、4、8、12、14、15号样品全部被检测出。
检测结果与产品标签一致,表明上清重复离心法得到的DNA提取液可用于转基因成分的定性检测。图中8号样品的转基因目的条带较模糊,是由于其DNA提取液的浓度偏低,这与图1 e中8号样品的扩增电泳条带较暗相一致。
3 讨论
作物的种子和其他组织含有丰富的DNA,但食用油经过多重加工后DNA含量极少,提取DNA的难度加大[15-18]。5种方案提取精炼棉籽油DNA的结果说明,棉籽油经过理化处理、加热等步骤后,精炼程度越深,油中的DNA含量越少,提取难度越大。此外,存放时间越长,DNA降解可能越严重。
PCR扩增进行效果评估时,目标片段的选择会影响检测结果[6]。植物油加工过程中会不同程度的断裂基因组DNA,本研究选用多拷贝小片段基因为引物,即180 bp的tRNALeu内源基因和210 bp的FMV35S外源基因,有效降低了扩增的假阴性率。引物的特异性强,可用于常规的核酸检测。
4 结论
本试验采用5种DNA提取方案,通过比较内源基因tRNALeu的扩增结果,确定上清重复离心法在本试验中的DNA提取效率最高。其获取的DNA提取液能进一步扩增外源基因FMV35S,用于棉籽油转基因成分的定性检验。该方法的优点总结如下:
4.1 先将油DNA溶于TE缓冲液,再用CTAB提取DNA的效率高;加大DNA与TE缓冲液的溶解程度有利于提高DNA的提取效率。
4.2 DNA大量富集是成功提取精炼棉籽油DNA的关键。
4.3 三氯甲烷:异戊醇(24∶1)反复抽提1次,可较大程度提高DNA纯度。
4.4 加入异丙醇后于-20℃沉淀过夜,使DNA沉淀彻底;将异丙醇沉淀后的上清液重复离心,收集沉淀,能有效减少人为操作引起的DNA损失,这对于提高DNA的提取效率至关重要。
[1]中华人民共和国国家质量监督检验检疫总局.SN/T 1203—2003食用植物油脂中转基因植物成分定性PCR检测方法[S].广州:中国标准出版社
[2]中华人民共和国出入境检验检疫局.SN/T1199—2003棉花种转基因成分定性PCR检测方法[S].北京:中国标准出版业,2003
[3]Gryson N,Ronsse F,Messens K,et al.Detection of DNA during the refining of soybean oil[J].Jouenal of American Oil Chemists’Society,2002,79(2):171-174
[4]邓鸿铃,覃芳芳,郭新东,等.食用大豆油中转基因成分的检测[J].中国油脂,2007,32(8):79-81
[5]程红梅,彭于发,金芜军,等.一种快速、简便提取大豆油DNA的方法及转基因大豆油的检测[J].中国农业科学,2007,40(5):1069-1072
[6]袁建琴,唐中伟,许冬梅,等.转基因棉子油的快速PCR检测研究[J].棉花学报,2009,21(2):153-155
[7]杨冬燕,邓汉超,杨永存,等.精炼食用植物油PCR检测技术研究[J].中国卫生检验杂志,2010,(4),700-702
[8]杨冬燕,杨永存,张海龙,等.核酸富集处理对精炼食用植物油DNA提取效率的影响[J].中国卫生检验杂志,2009,(12):2770-2772
[9]Testolin R,Lain O.DNA Extraction from Olive Oil and PCR Amplification of Microsatellite Markers[J].Journal of food science,2005,70(1):C108-C112
[10]Catherine B,Delphine C,Isabelle M,et al.Comparative study of methods for DNA preparation from olive oil samples to identify cultivar SSR alleles in commercial oil samples:possible forensic applications[J].Journal of agricultural and food chemistry,2004,52(3):531-537
[11]Wu Yajun,Chen Ying,Ge Yiqiang,et al.Detection of olive oil using the Evagreen real-time PCR method[J].European Food Research and Technology,2008,227(4):1117-1124
[12]何景,许文涛,黄昆仑.食用油DNA提取及检测技术的研究进展[J].食品工业科技,2012,33(12):382-386,391
[13]张秀丰,孙旭东,张伟,等.五重 PCR检测转基因大豆[J].中国粮油学报,2008,23(3):194-198
[14]Silvia D,Lee D.Development of sensitive crop-specific polymerase chain reaction assays using 5S DNA:Applications in food traceability[J].Journal of Agricultural and Food Chemistry,2007,55(12):4640-4644
[15]梅玲玲,徐艺珍,程苏云,等.转基因食品DNA提取技术研究[J].中国卫生检验杂志,2005,15(6):689-690,749
[16]Shahzadi I,Ahmed R,Hassan A,et al.Optimization of DNA extraction from seeds and fresh leaf tissues of wild marigold(Tagetesminuta)for polymerase chain reaction analysis[J].Genetics and Molecular Research,2010,9(1):386-393
[17]严明理,刘忠松,官春云,等.用于PCR分析的芥菜型油菜总DNA的快速提取[J].现代农业科技,2008(16):172-173
[18]覃文,董洁,邓鸿铃,等.PCR法定性检测食用油脂中转基因成分[J].中国油脂,2002,27(3):4-6.
A Comparative Study of Different Methods of DNA Extraction of Cottonseed Oil
Fu Xiaohua1Zhang Yan2Zhang Wei2Wang Hong1,2Wu Tao2Zhou Wei2,3
(College of Life Sciences,Hebei Normal University1,Shijiazhuang 050024)
(Hebei Institute of Food Quality Supervision Inspection and Research2,Shijiazhuang 050071)
(College of Food Science and Technology,Agricultural University of Hebei3,Baoding 071000)
The research has designed five different schemes to extract DNA of 15 cottonseed oil samples with different machining accuracy from different manufacturers,which based on the SDSmethod as well as national standard method for DNA extraction of edible oil.The research estimated the DNA extraction efficiency by comparing PCR amplification results of the endogenous gene tRNALeu of DNA extract from different sources.Amplified the exogenous gene FMV35S from the obtained DNA of the fifth scheme to detect genetically modified ingredients.The results showed that the fifth method made the higher DNA-extracting efficiency than the other methods;the DNA extracted by the fifth method can also be adopted for the qualitative detection of genetically modified ingredients in cottonseed oil.
cottonseed oil,DNA extraction,enrichment treatment,genetically modified organisms(GMO)
TS221
A
1003-0174(2014)03-0042-05
河北省质量技术监督局科研项目(2011ZD06)
2013-04-25
付晓华,女,1984年出生,硕士,应用微生物
周巍,男,1983年出生,工程师,农产品加工与储藏工程
