新疆塔城地区绵羊细粒棘球蚴流行株基因分型研究
2014-01-07宋雪梅程子兵王辉胜刘田莉孟庆玲张金生陈创夫
宋雪梅,程子兵,王辉胜,刘田莉,乔 军,孟庆玲*,张金生,陈创夫
(1.石河子大学 动 物科技学院,新疆 石 河子832003;2.新疆塔城地区动物疾控与诊断中心,新疆 塔 城834700;3.新疆沙湾县乌兰乌苏镇兽医站,新疆 沙 湾,832100)
细粒棘球蚴病是由细粒棘球绦虫(Echinococcus granuloses,Eg)的中绦期幼虫-棘球蚴(Echinococcus)寄生在宿主体内所致的一种严重的人畜共患性疾病[1-2]。该病主要在以畜牧业为主的国家或地区流行,细粒棘球绦虫存在着大量内部变异的虫株,基因的多样性导致其对不同类型的宿主的感染性不同,在不同的地理环境中,其传播动力学、致病性、抗原反应等也不同,从而影响疫苗及诊断试剂的研制[7-8]。所以,从遗传学角度研究其种群结构有重大意义。利用分子生物学技术可了解细粒棘球绦虫基因组成及结构上的差异,为虫种及不同地理株的鉴定提供依据,而线粒体DNA细胞色素C氧化酶亚单位1(Cytochrome c oxidase subunit 1,CO1)是线粒体基因组中进化速率较慢且无重组,常作为物种遗传多样性、遗传分化、起源进化研究的最适遗传标记,被研究者们广泛采用。近年来,许多学者以细粒棘球绦虫基因组特征作为鉴别的依据,将其分为10种不同的基因型(G1~G10)[9-11]。为了弄清新疆塔城地区绵羊细粒棘球蚴流行株基因型,本研究选择了序列短易于扩增的线粒体DNA 12S r RNA基因对新疆塔城地区的细粒棘球蚴进行PCR检测鉴定,再对CO1基因进行序列测定和分析,研究塔城地区绵羊细粒棘球蚴流行株基因型,将为该地区绵羊细粒棘球蚴病的防控提供科学依据。
1 材料与方法
1.1 主要试剂
组织DNA提取试剂盒、Taq plus DNA聚合酶、d NTP、琼脂糖凝胶回收试剂盒、琼脂糖、DNA Marker及其他生化试剂购自上海生物工程公司。p MD18-T Vector载体购自大连Ta Kara公司。宿主菌E.coli DH5α由本实验室保存。
1.2 病料的采集及DNA的提取
从新疆塔城地区各县屠宰场收集感染细粒棘球蚴绵羊的肝脏,以一个包囊为一个包虫病灶,共分离到61个包虫包囊,抽取囊液于1.5 m L的EP管中,12 000 rpm/m离心10 min,将上清液置于-20℃保存,将有原头蚴的样品用TIANamp Genomic DNA Kit提取基因组DNA,-20℃保存备用。
1.3 引物设计及合成
根据GenBank中已公布的细粒棘球蚴线粒体DNA 12S r RNA(FR666874)基因序列和CO1基因序列(GU951512),应用primer 5.0分别设计其上、下游引物,引物合成及测序服务由北京华大生物工程有限公司完成。12S rRNA基因引物:P1:5′-GTATTTTGTAAAGTTGTTCTA-3′;P2:5′-CTAAATCACAT-CATCTTACAAT-3′。CO1 基 因 引 物:P3:5′-TTTTTTGGGCATCCTGAGGTTTAT-3′。P4:5′-TAAAGAAAGAACATAATGAAAATG-3′。
1.4 感染细粒棘球蚴的绵羊肝脏PCR检测
以提取的基因组DNA为模板,加特异性12S r RNA引物,扩增细粒棘球蚴12S r RNA基因片段。采用50μL反应体系:DNA模板4μL,10×PCR buffer 5μL,引物 P1(25 pmol/μL)、P2(25 pmol/μL)各1μL,2.5 mmol/L d NTP 4μL,水34.7μL,Taq DNA聚合酶0.3μL(5 U/μL)混匀。反应条件为:95℃预变性3 min;94℃变性30 s,57℃退火1 min,72℃延伸40 s,35个循环;72℃延伸5 min。扩增产物在1.5%琼脂糖凝胶电泳。
1.5 CO1基因的PCR扩增与克隆
将12S rRNA基因检测阳性样品再进行CO 1基因扩增测序。以12S rRNA基因检测阳性样品的基因组DNA为模板,加特异性CO1引物,扩增细粒棘球蚴CO1基因片段。PCR反应采用50 u L反应体系:DNA模板4μL,10×PCR buffer 5μL,引物P3(25 pmol/μL)、P4(25 pmol/μL)各1μL,2.5 mmol/L d NTP 4μL,水34.7μL,Taq DNA聚合酶0.3μL(5 U/μL)混匀。反应条件:95℃预变性5 min;94℃变性50 S,45℃退火50 S,72℃延伸50 S,35个循环;72℃延伸10 min。用上海生工生产的DNA gel Extraction Kit回收扩增的CO1基因目的DNA片段。将回收片段与p MD18-T Vector载体于4℃过夜连接,次日转化感受态细胞E.coli DH5α,挑取单菌落,用菌液PCR筛选阳性转化子。
1.6 测序与基因分型分析
将鉴定正确的阳性转化子送北京华大生物工程有限公司测序,用DNAMAN软件对所测塔城地区细粒棘球蚴CO1基因序列进行同源性分析,以GenBank中细粒棘球绦虫的CO1基因序列AF297617(G1)[11]、FJ796205(G1) 、M84662(G2)、M84663(G3)、FJ796207(G6)[12]作为标准序列(表1),统计绵羊细粒棘球蚴CO1基因序列变异位点,确定在塔城地区流行的细粒棘球蚴CO1基因的基因型。
2 结果与分析
2.1 细粒棘球蚴原头节的分离结果
通过对分离得到的61个细粒棘球蚴的包虫病灶离心发现58份样品中有原头蚴,3份样无原头蚴,对这3份样品进行显微镜观察,同样未观察到原头蚴,确定这3个包囊样品为不育囊,不育囊占4.9%。
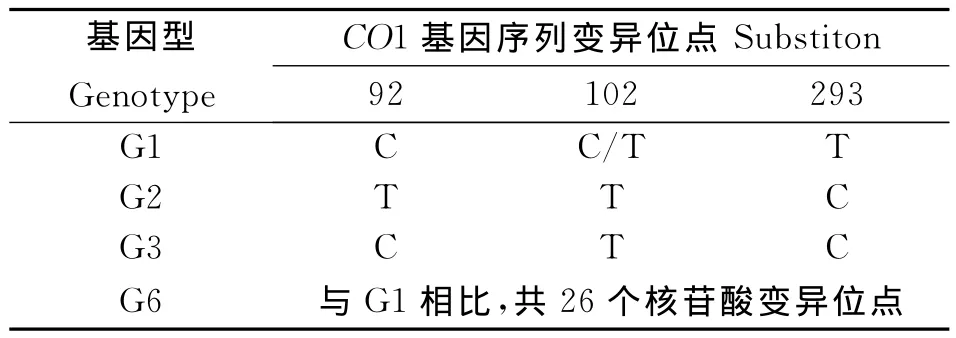
表1 细粒棘球蚴CO1基因序列的核苷酸变异位点Table 1 Substition in the CO1 gene for the Echinococcus granulosus G1 genotype
2.2 细粒棘球蚴12S rRNA基因的PCR检测结果
以分离得到的58个细粒棘球蚴基因组DNA为模板,利用特异性引物对12S rRNA基因进行扩增,得到了大小与预期值254 bp相符的目的条带(图1),且条带清晰,说明PCR扩增产物可信。且检测发现58个样品均为阳性扩增。

图1 细粒棘球蚴12S rRNA基因的PCR扩增结果Fig.1 Amplification of Echinococcus granulosus 12S rRNA gene M.Marker DL-2000;1-7.细粒棘球蚴12S rRNA基因的PCR扩增产物;1-7.PCR products of Echinococcus granulosus 12S r RNA gene
2.3 细粒棘球蚴CO1基因的PCR扩增结果
利用特异性引物对阳性样品CO1基因进行扩增,得到了大小与预期值444 bp相符的目的条带(图2),且条带清晰,说明PCR扩增产物可信。同时检测发现58个样品均为阳性扩增。连接、转化后,挑取单菌落,通过PCR成功筛选到了阳性转化子(图3)。
2.4 细粒棘球蚴CO1基因的序列比对分析

图2 细粒棘球蚴CO1基因的PCR扩增结果M.Marker DL-2000;1-7.细粒棘球蚴CO1基因的PCR扩增产物Fig.2 Amplification of Echinococcus granulosus CO1 gene 1-7.PCRproducts of Echinococcus granulosus CO1 gene
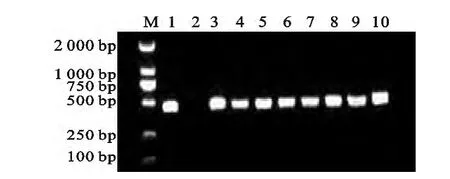
图3 细粒棘球蚴CO1基因重组菌液PCR的鉴定结果M.Marker DL-2000;1,3-10.细粒棘球蚴CO1基因菌液PCR阳性鉴定结果,2为阴性Fig.3 Amplification of Echinococcus granulosus CO1 gene recombinant bacteria1,3-10.PCR positive for Echinococcus granulosus CO1 gene recombinant bacteria,2 is negative
经测序,塔城地区细粒棘球蚴线粒体DNA CO1基因片段长度为444 bp。对58个绵羊细粒棘球蚴流行株的CO1基因序列分析发现,新疆塔城地区绵羊细粒棘球蚴流行株基因型均为G1型。序列进行比较分析发现(图4),18个核苷酸变异位点,约占分析位点总数的4%,碱基的变异为转换、颠换和缺失,未见有插入。核苷酸变异位点见表2。同时,发现有14种不同的基因单倍体,XJ1占8.6%、XJ2占6.8%、XJ3占6.8%、XJ4占36.2%、XJ5占5.1%、XJ6占1.7%、XJ7占1.7%、XJ8占5.1%、XJ9占13.8%、XJ10占1.7%、XJ11占5.1%、XJ12占1.7%、XJ13占3.4%、XJ14占5.1%。

表2 新疆塔城细粒棘球蚴G1型各分离株CO1基因核苷酸变异位点Table 2 Substition in the CO1 gene for the Echinococcus granulosus G1 genotype investigated in Tacheng Xinjiang
3 讨 论
细粒棘球绦虫具有广泛的中间宿主适应性,在不同的地理生态环境和宿主种群中,存在不同的细粒棘球绦虫虫株[12-14]。在土耳其,发现G1型基因在绵羊体内广泛存在,且存在基因多态性,同时发现G 3型基因均存在于绵羊和骆驼体内[15]。在对欧洲四个不同国家棘球绦虫遗传变异的研究中,共检测到G1、G2、G3和G4四种基因型,31个基因单倍体,其中7个不同的基因单倍体来自意大利[16]。G3基因型最早发现于印第安水牛体内,此后,有研究发现G3基因型在绵羊、山羊、骆驼、人等中间宿主均有感染。在肯尼亚和利比亚,G1和G6两种不同的基因型在骆驼群中流行,而在伊朗,G1、G3和G6三中不同的基因型在骆驼体内被发现[12]。在北非国家,G1和G6基因型共存,G1、G2、G5、G6和G7存在于阿根廷,G1、G4和G6型存在于吉尔吉斯,在这些地区的同一宿主体内存在不同基因型的协同感染[17]。在青藏高原地区,发现G1型基因为主要流行株,共检测到28个基因单倍体,也发现了G3型基因感染人群[18]。由于新疆地区存在适合细粒棘球绦虫寄生的多种中间宿主,同时存在细粒棘球绦虫发生变异的多种因素,故细粒棘球绦虫可能发生变异,存在新的基因型或变异株。
养羊业是新疆塔城地区畜牧业的主要经济支柱,绵羊养殖量较大,且以放牧为主,该地区是人畜包虫病的高发区。然而,到目前为止,尚不清楚该地区细粒棘球蚴流行株的遗传背景。本研究共检测了采自塔城地区各屠宰场绵羊的58个细粒棘球蚴包囊分离株,通过对CO1基因序列测定及分析,发现该地区绵羊感染细粒棘球蚴的基因型均为G1型,且存在18个不同的核苷酸变异位点,约占分析位点总数的4%。碱基的变化包括转换、颠换和缺失,未见有插入。同时,发现有14种不同的基因单倍体,且发现同一宿主的分离株基因序列变异位点不同,存在不同的G1基因单倍体,分析其原因,可能是由于绵羊在采食过程中食入了不同基因型的虫卵而感染引起的。本研究同时证实新疆塔城地区绵羊细粒棘球蚴具有较丰富的遗传多态性及遗传差异,这为该地区绵羊包虫病分子流行病学调查和防控工作提供了科学依据,对掌握细粒棘球绦虫的分子生物学特征、寻找和追踪传染源、确定棘球绦虫的致病性、指导包虫的疫苗研制和临床治疗、制定科学有效的防控措施具有重要意义。
[1] 金宁一,胡仲明,冯书章.新编人兽共患病学[M].北京:科学卫生出版社,2007:833-843.
[2] Debas E,Ibrabim N.Prevalence and Economic Importance of Hydatidosis in Cattle Slaughtered at North Gonder Elfora Abattoir[J].European Journal of Applied Sciences,2013,5(1):29-35.
[3] Sotiraki S,Chaligiannis I.Cystic echinococcosis in Greece.Past and present[J].Parasite,2010,3(17):205-210.
[4] Zibaei M,Azargoon A,Ataie-Khorasgani M,et al.The serological study of cystic echinococcosis and assessment of surgical cases during 5 years(2007-2011)in Khorram Abad,Iran[J].Nigerian journal of clinical practice,2013,2(16):221-225.
[5] 贾万忠.我国包虫病的防治现状[J].兽医导刊,2011,6:30-31.
[6] 王立英,伍卫平,朱雪花.2004-2008年全国包虫病疫情分析[J].中国人畜共患病学报,2010,7(26):699-702.
[7] Mcmnus D P,Thompson R C.Molecular Epidemiology of cystic echinococcusis[J].Parasitology,2003,127:37-51.
[8] Jacob S S,Cherian S,Sumithra T G,et al.Edible vaccines against veterinary parasitic diseases-Current status and future prospects[J].Vaccine,2013,31(15):1 879-1 885.
[9] Balbiotti H,Guiherme B,Badaraco J,et al.Echinococcus ortleppi(G5)and Echinococcus granulosus sensu stricto(G1)loads in cattle from Southern Brazil[J].Veterinary Parasitology,2012,188 (4):255-260.
[10] Abdi J,Kazemi B,Karimfar M H,et al.Evaluation of rabbit antibody response against 8 and k Da recombinant subunits of antigen B from Echinococcus granulosus[J].Asian Pacific Journal of Tropical Medicine.2012,5(5):355-357.
[11] 马秀敏.新疆细粒棘球绦虫基因多形态及实验诊断学研究[D].乌鲁木齐:新疆医科大学,2007:9-12.
[12] Sharbatkhori M,Fasihi Harandi M,Mirhendi H,et al.Sequence analysis of cox1 and nad1 genes in Echinococcus granulosus G3 genotype in camels(Camelus dromedarius)from central Iran[J].Parasitology Research,2011,108(3):521-527.
[13] Taha H A.Genetic variations among Echinococcus granulosus isotates in Egypt using RAPD-PCR[J].Parasitology Research,2012,111(5):1 993-2 000.
[14] Saccone C,Gisssi C,Lanave C,et al.Evolution of the mitochondrial genetic system:an overview[J].Gene,2000,2611:153-159.
[15] Vural G,Baca A U,Gauci C G,et al.Variability in the Echinococcus granulosus Cytochrome C oxidase1 mitochondrial gene sequence from livestock in Turkeyand a re-appraisal of the G1-3 genotype cluster[J].Veterinary Parasitology,2008,154(3-4):347-350.
[16] Casulli A,Interisano M,Sreter T,et al.Genetic variability of Echinococcus granulosus sensu stricto in Europe inferred by mitochondrial DNA sequences[J].Infection,Genetics and Evolution,2012,12(2):377-383.
[17] Boubaker G,Macchiarli N,Parda L,et al.A Multiplex PCR for the Simultaneous Detection and Genotyping of the Echinococcus granulosus Complex [J].PLOS Neglected Tropical Disease,2013,7(1):e2017.
[18] Yan N,Nie H M,Jiang Z R,et al.Genetic variability of E-chinococcus granulosus from the Tibetan plateau inferred by mitochondrial DNA sequences[J].Veterinary Parasitology,2013,196(1-2):179-183.
