山羊瘤胃和粪便中厌氧真菌的分离及发酵粗饲料能力初探
2014-01-02毛胜勇姚文陈勇
毛胜勇,姚文,陈勇
(1.南京农业大学动物科技学院,江苏 南京210095;2.新疆农业大学动物科学学院,新疆 乌鲁木齐830052)
自Orpin[1]首次报道反刍动物瘤胃内存在有厌氧真菌,迄今为止,已在许多反刍动物及单胃草食动物的消化道及粪便中分离到多种厌氧真菌,共计5个属10余个种之多[2]。大量研究表明,瘤胃真菌不仅可以通过假根以机械方式刺穿植物细胞壁,而且可分泌高活性的纤维素酶、半纤维素酶和木聚糖酶,并以化学方式作用于一些难降解的植物组织,如坚固的厚壁组织和维管束组织等,提高其消化率[3-4]。瘤胃真菌这种能产生高活性酶的特点,已引起包括酶制剂产业在内的研究人员的广泛兴趣。但要对其进行系统的研究,必须在获取大量菌种的前提下才能进行,而在此方面,目前国内外许多实验室还是以瘤胃瘘管的方式通过采集瘤胃内容物进行分离,以获取菌种,这种方式对动物的生产性能和健康带来的严重伤害是显而易见的,相比而言,以粪便作为菌源来分离厌氧真菌可消除这些弊端,因而一直为众多学者所推崇。但迄今为止,有关粪便中的厌氧真菌是否具有与瘤胃内厌氧真菌相似的降解粗饲料的能力却未见报道。为阐明该问题,作者分离鉴定了本地(南京郊区)山羊瘤胃液及其粪便中的厌氧真菌,并以本地(南京郊区)稻草、麦秸及玉米秸为底物,对其降解粗饲料的能力进行了比较。
1 材料与方法
1.1 实验动物与培养器材
本实验于2012年1-12月进行,实验重复3次。试验选用2头装有永久性瘤胃瘘管的本地山羊[(25±3.4)kg]。山羊日粮为青干草,单栏饲喂,自由采食与饮水。CO2气源采用高纯度CO2。培养管及发酵瓶选用特制耐压玻璃试管,配有丁基胶塞和铝盖,密封良好。
1.2 培养基配制
基础培养基、液体培养基与固体培养基参照Orpin[1]方法配制。其中厌氧真菌分离纯化所用液体培养基以1%(w/v)葡萄糖为碳源,配制滚管用的固体培养需加入2%(w/v)的琼脂。所有培养基均经高压灭菌(121℃,15 min)。
1.3 瘤胃液及粪便的采集与制备
饲喂前1h用真空负压装置采集瘤胃液200mL左右,4层纱布过滤后置于充满CO2的发酵瓶中,而后置于39℃的温水中;实验同时收集新鲜粪便,装入充满CO2的发酵瓶中带回。
1.4 瘤胃及粪便中厌氧真菌的分离
取瘤胃内容物10mL及20g新鲜粪便,分别在含有抗生素(青霉素,1600单位/mL;链霉素,1600单位/mL)的液体厌氧培养基中系列稀释至10-8,用吸液泵于各稀释度分别吸取7mL注入经高压灭菌(121℃,15min)后的厌氧液体培养管中(稻草浓度为0.5%,40℃预热),每稀释度为3管,将各培养管放入恒温箱中,39℃培养2周。将制好的固体培养基煮沸融化后置于40℃水浴中,选取在瘤胃及粪便厌氧真菌计数期间已用稻草浮起的培养管,用注射器分别吸取0.05,0.10mL的培养液注入液化固体培养基(抗生素浓度与计数时相同)中,迅速摇匀后于冰水中滚管,再放入39℃的恒温培养箱中培养。经3d培养后,用无菌特制接种针挑取滚管中带有琼脂的单个典型菌落迅速移入5mL液体培养管中(39℃预热),39℃下培养3~4d后,再次滚管,如此多次重复,直至滚管中所有菌落形态一致。
1.5 厌氧真菌的形态观察
采用倒置显微镜,根据菌丝体形成的孢子囊的个数,区分单中心、多中心真菌的单个菌落,同时取典型菌落的培养液置于载玻片上,用相差显微镜直接观察瘤胃液及粪便中厌氧真菌的菌丝、孢子囊及孢子形态,照相。
1.6 分离菌株的发酵培养
根据Zhu[5]的方法,准确称取1.0g粉碎的稻草、麦秸及玉米秸(直径小于5mm),放入容量为160mL的血清瓶中,厌氧条件下装入90mL无氧液体培养基,以丁基塑塞和铝圈密封,121℃下灭菌15min。试验前,每瓶按预定比例(青霉素,1600单位/mL;链霉素,1600单位/mL)注入抗生素,39℃下预热过夜,每3瓶(3个重复)为1个处理,每处理接种1种已生长3d的菌种混合悬浮液,接种量为10mL。以不接种厌氧真菌菌液的发酵瓶为对照;对照组的底物与培养基和处理组相同,但对照瓶注射10mL无菌厌氧蒸馏水。所有处理和对照在39℃下静止培养196h。
1.7 发酵时产气量及发酵后培养物处理及干物质测定
产气量测定参照艾丽霞等[6]的方法。发酵结束后,各培养瓶中的培养液转移至已称重的过滤坩锅,经真空抽滤后,放入已预热至105℃的烘箱内,烘至恒重;而后以对照作校正,确定稻草、麦秸及玉米秸的降解率。
1.8 数据处理
所得数据经Excel初步整理后,利用SPSS(15.0)单因子方差分析中LSD法进行统计分析。数据以平均值±标准差表示,显著性水平置于0.05。
2 结果与分析
2.1 厌氧真菌的分离鉴定
利用一系列严格的厌氧技术,经过反复多次的分离纯化,从山羊瘤胃液中分离到30株厌氧真菌,这些菌归为4类;从粪便中分离到15株厌氧真菌,这些菌株归属2类;归类参照Ho和Barr[2]厌氧真菌分类法。从各类菌中选择具有代表性的菌株,在倒置显微镜及常规光学显微镜下观察所得的菌落、细胞形态和菌丝体发育状况,结果分述如下(图1)。
F1:粪便厌氧真菌。单中心类型。菌落呈放射状,菌丝略有弯曲,较稀疏、有分叉,菌体较大;孢子多为椭圆形,多鞭毛,鞭毛12~14根,孢子在固体培养基中以同心圆状形式扩散开来;孢子囊有球形、椭圆形、圆柱形;囊柄长,与假根相连,假根系统发达,为Neocallimastix属菌。
F2:粪便厌氧真菌。单中心类型。菌落明显小于F1菌株,菌丝直、密;孢子呈椭圆形或球形,单鞭毛,孢子在固体培养基中以放射状形式扩散开来;孢子囊呈球形,囊柄长,与假根相连,假根系统不发达,为Piromyces属菌。
R1:瘤胃厌氧真菌。单中心类型。菌落呈放射状,菌丝直、较细、有分枝、在菌体周围分布均匀;孢子多为椭圆形,多鞭毛,鞭毛7~8根,成熟孢子囊呈球形;有一明显的主根与假根相连,假根系统非常发达,为Neocallimastix属菌。
R2:瘤胃厌氧真菌。单中心类型。菌落小、无明显孢子囊;菌丝稀、较细、弯曲、有分枝,由中心处生长多处假根;孢子为椭圆形,多鞭毛,鞭毛5~7根;成熟孢子囊呈球形,有一明显的主根与假根相连,假根系统较发达,为Orpinomyces属菌。
R3:瘤胃厌氧真菌。单中心类型。菌落呈放射状,菌丝直、有分枝,菌丝中有明显的主根,且较R1丰富;孢子为圆形,单鞭毛,鞭毛2~4根,成熟孢子囊呈球形;有一明显“主根”直接与假根相连,由“主根”逐渐分枝,依次形成各级较细的假根,为Piromyces属菌。
R4:瘤胃厌氧真菌。多中心类型。孢子球形,单鞭毛,孢子囊未成熟时椭圆形、球形,成熟孢子囊呈梭形,囊顶端有一尖端突起。菌丝体多分枝,菌丝体有粗细之分,粗菌丝含多个细胞核,菌丝呈分明分节现象。为Anaeromyces属菌。
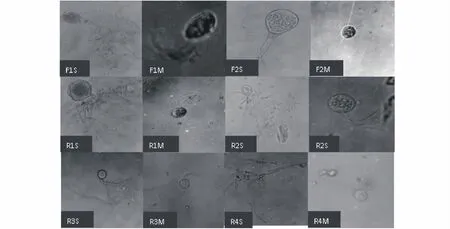
图1 所分离厌氧真菌菌株的形态与游动孢子形态Fig.1 The morphology of the isolates or zoospore
2.2 山羊瘤胃及粪便中厌氧真菌对稻草、麦秸和玉米秸降解能力的比较
选择上述各属的代表性菌株进行发酵,结果见表1。瘤胃厌氧真菌株对上述3种底物的降解能力显著高于粪便中的厌氧真菌(P<0.05)。各菌株对不同底物的降解能力不尽相同,其中4株瘤胃真菌发酵稻草后的表观干物质降解率无显著差异(P>0.10);但R2菌株对麦秸的降解能力最低,显著低于其余3株瘤胃真菌(P<0.05);R4菌株对玉米秸的降解能力最低,仅19.6%。各菌株发酵稻草的总产气量均值在161~202mL之间,其中以R3的总产气量最高,F1最低;各菌株发酵麦秸的总产气量均值在147~180mL之间,其中以R3的总产气量为最高,F2最低;各菌株发酵玉米秸的总产气量在115~151mL之间,其中以R1的总产气量为最高,F1最低。
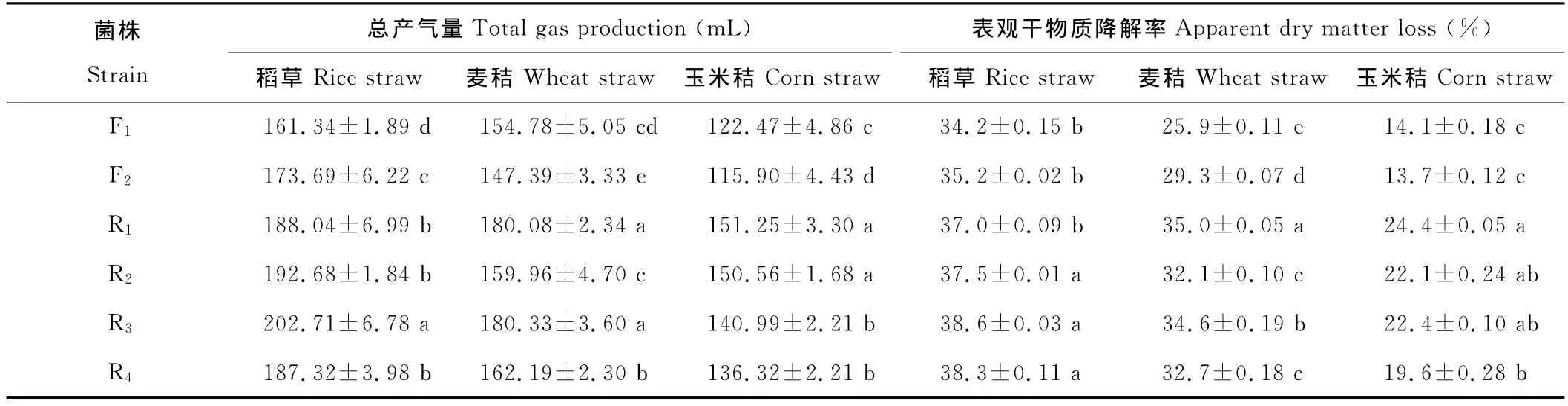
表1 分离菌株对稻草、麦秸及玉米秸发酵活力的比较Table 1 The activity of fermentation to the rice straw,wheat straw and corn straw for the isolates
3 讨论
由于厌氧真菌的核糖体数据库信息不足,因而当前对厌氧真菌的分类依据仍主要基于孢子鞭毛数目、孢子囊形态、菌丝和孢子囊柄的特征,而这种分类法一般仅能鉴定到属,因而本文对所分离的厌氧真菌仅鉴定到属[7-8]。Theodorou等[9]从荷斯坦奶牛粪便中分离所得的厌氧真菌皆属单中心厌氧真菌,主要包括Neocallimastix、Piromyces和Caecomyces属。Orpin和Joblin[10]从山羊瘤胃也分离到类似于Neocallimastix、Piromyces、Orpinomyces菌株。Ho等[11]从山羊瘤胃内分离到一株Piromycesspiralis。本试验从饲喂青干草的山羊粪便中分离到2类厌氧真菌,皆为单中心,归属Neocallimastix和Piromyces,从瘤胃液中分离到4类厌氧真菌,分属Neocallimastix、Piromyces、Orpinomyces和Anaeromyces。各厌氧真菌的生长特性、孢子鞭毛数目、孢子囊形态、菌丝和孢子囊柄的特征基本与上述报道相似。
厌氧真菌对底物的降解能力除与菌株本身有关外,还受培养条件、发酵底物等多种因素的影响。对菌株自身而言,厌氧真菌的来源及地区性能影响厌氧真菌降解底物植物片段的能力[5,12]。本试验结果表明,从粪便中分离到的厌氧真菌对稻草、麦秸及玉米秸的降解率皆低于从瘤胃中分离所得的厌氧真菌,该结果也进一步佐证了上述报道。其原因可能在于瘤胃真菌处于高度竞争的瘤胃微生态环境中,一直保持着较强的活力,而粪便中厌氧真菌孢子处于休眠期,活力相对较弱,这种活力上的不同也最终导致两者在发酵底物能力上的相异。本研究表明,分离所得的厌氧真菌对不同底物的降解率不一致,这种不一致可能与底物的结构组成及菌株自身分泌的酶类型有关。本实验所有3种底物中,玉米秸的木质素含量最高。而有报道表明,厌氧真菌发酵不同底物时分泌的多糖降解酶的活性与菌株本身及底物种类有关[13]。同时其他报道也表明,许多多糖降解酶的分泌量取决于其基因型与底物组成两方面因素[14]。因而当同一株厌氧真菌发酵不同底物时,其产生的降解该底物的酶的活力与数量不一致,由此出现本研究中所观察到的同一株厌氧真菌对不同底物的降解能力不一致的现象。
综上所述,本研究从山羊瘤胃与粪便中分离获得4类厌氧真菌,所获菌株对稻草具有较强的降解能力,但对玉米秸的降解能力较低。但由于本研究主要侧重于这些菌株的分离报道与发酵粗饲料能力的初步探索,这些菌株的酶学特性及其基因组信息等尚需进一步研究。
[1]Orpin C G.Studies on the rumen flagellateNeocallimastixfrontalis[J].Journal of General Microbiology,1975,91:249-262.
[2]Ho W Y,Barr S J D.Classification of anaerobic gut fungi from herbivored with emphasis on rumen fungi from Malaysia[J].Mycologia,1995,87(5):655-677.
[3]Akin D E,Borneman W S,Lyon C E.Degradation of leaf blades and stems by monocentric and polycentric isolates of ruminal fungi[J].Animal Feed Science and Technology,1995,31:205-221.
[4]Borneman W S,Hartley R D,Morrison W H,etal.Feruloyl and P-coumaroyl esterase from anaerobic fungi in relation to plant cell wall degradation[J].Applied Microbiology and Biotechnology,1990,33:345-351.
[5]Zhu W Y.Growth and survival of anaerobic fungi in batch culture and continuous-flow culture[J].Anaerobe,1996,2:29-37.
[6]艾丽霞,苏勇,朱伟云.梅山与长白母猪粪样微生物体外发酵八种纤维底物的特性比较[J].草业学报,2013,22(3):99-107.
[7]Theodorou M K,Gill M,King-Spooner C,etal.Enumeration of anaerobic chytridiomycetes as thallus forming units:a novel method for the quantification of fibrolytic fungal populations from the digestive tract ecosystem[J].Applied and Environmental Microbiology,1990,56:1073-1078.
[8]Davies R D,Theodorou M K,Lawrence M I G.Distribution of anaerobic fungi in the digestive tract of cattle and their survival in faeces[J].Journal of General Microbiology,1993,139:1395-1400.
[9]Theodorou M K,Davies R D,Jordan C G,etal.Comparision of anaerobic fungi in faeces and rumen digesta of newly born and adult ruminants[J].Mycology Research,1993,97(10):1245-1252.
[10]Orpin C G,Joblin K N.The Rumen Microbial Ecosystem (2nd ed.)[M].London:Elsevier Applied Science Press,1988.
[11]Ho Y W,Abdullah N,Jalaludin S.Piromycesspiralis,a new species of anaerobic fjungus from the rumen of goat[J].Mycotaxon,1993,48:59-68.
[12]Borneman W S,Akin D E,Ljungdahl L G.Fermentation products and plant cell wall degrading enzymes produced by monocentric and polycentric anaerobic ruminal fungi[J].Applied and Environmental Microbiology,1989,55:1066-1073.
[13]Ho Y W,Wong N,Abdullah H,etal.Fermentation activities of some new species of anaerobic rumen fungi from Malaysia[J].Journal of General Microbiology,1996,42:51-59.
[14]William A G,Orpin C G.Polyxaccharide degrading enzymes formed by three species of anaerobic rumen fungi grow on a range of carbohydrate substrates[J].Canadian Journal of Microbiology,1987,33(5):418-426.
