葎草幼苗光合生理特性对铬胁迫的响应
2014-11-08王碧霞胥晓李霄锋
王碧霞,胥晓,李霄锋
(1.西华师范大学生命科学学院 西南野生动植物资源保护教育部重点实验室,四川 南充637009; 2.张家口市农业环境与农产品质量管理站,河北 张家口075000)
铬在自然界中约占地壳总量的0.02%,常存在于土壤、大气、水及各类生物体内[1]。然而随着经济全球化进程的加快,铬被广泛应用于化工、冶金、机械等行业,它在环境中的排放速度显著增加,逐渐成为土壤污染的5种主要重金属之一[2],据统计,我国每年新排放铬渣约60万t,历年累积存铬渣近600万t,受铬严重污染的土壤已达1250多万t[3]。一般而言,自然土壤中适量浓度的铬对种子萌发和植物生长是有利的[4-5],但含量过高却会导致植物叶绿素分解,光合作用下降[4-6],细胞内活性氧累积,产生氧化胁迫[7],对植物生长具有抑制作用。因此,研究不同铬浓度下植物的光合生理特性变化,对了解植物对不同程度铬污染土壤的适应以及修复植物的筛选具有实际意义。目前,有关土壤铬污染修复植物的研究仅集中在少数几种超富集植物上,如李氏禾(Leersiahexandra)、Dicomaniccolifera和Suterafodina[8-9],但这类植物通常生长慢、植株小、周期长、经济效益低,导致其在植物修复工程中应用较少。因此,选用生长快、周期短、具有经济价值的普通植物用于重金属铬污染土壤的修复具有重要意义。
葎草(Humulusscandens)为桑科(Moraceae)葎草属(Humulus),一年生或多年生草本,在我国青海、新疆、甘肃、西藏等省、市广泛分布,其嫩茎和叶可用于畜禽饲料和添加剂,还可全草入药,具有医疗、保健等功效。葎草生性强健、抗逆性强,不仅是工程矿地、裸露地和弃耕地的先锋物种,而且在控制水土流失、改善生态环境方面也具有明显优势。鉴于葎草在中药材方面的大量运用,近年来多数研究主要集中在其化学成分、药用成分,遗传育种等生理生化方面[10-12],同时也偶见葎草在水分、增温胁迫下具有性别差异的文献[13-14],但重金属胁迫对葎草生理生态的影响尚未见报道。故本研究以常见的葎草为试材,研究不同铬浓度对葎草幼苗叶片的气体交换、丙二醛(MDA)含量、叶绿素含量和叶绿素荧光参数等生理生态指标的影响,以期揭示铬胁迫环境下葎草的抗逆性及该类植物对胁迫环境的响应机制,为葎草进一步用于重金属铬污染土壤的修复植物研究提供理论依据。
1 材料与方法
1.1 试验材料与设计
2012年10月中下旬采集南充市本地葎草野生种子,于2013年2月15日播种,待生长1个月后,选择长势基本一致的50株幼苗移栽到体积为10 L的塑料盆内,每盆装入均质土壤7.5 kg,河沙1.5 kg,每盆1株,缓苗20 d。于4月8日进行铬胁迫实验,重金属试剂为Cr3+。参照王爱云等[5]的方法,设Cr3+浓度为0,50,200,300,500 mmol/L共5个处理,将Cr3+按相应浓度配成1000 mL的溶液缓慢均匀浇灌于土壤中,每处理分别10株,对照组(10株)浇施等量清水。为防止溶液渗漏,对照组和处理组塑料盆内均套有塑料袋(土壤置于塑料袋内)。
1.2 测量方法
1.2.1气体交换参数测定 于2013年4月28日,随机选取不同处理下的植株各5株,采用LI-6400便携式光合测定仪(Li-Cor公司,美国)测定气体交换特征。每个处理随机选择5株,测定植株上部第5或6片全展向阳叶片。测定时间为上午8:00-11:30,测定指标为净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等。瞬时水分利用效率(WUEi)为Pn与Tr之比,气孔限制值(Ls)[Ls=(Ca-Ci)/Ca]采用Berry和Downton[15]的方法计算。测定时的环境温度为(28.0±1.0)℃;大气相对湿度为40%~43%;大气CO2浓度为(370±10) mmol/mol;光照强度为(1400±50) mmol/(m2·s)。
1.2.2丙二醛(MDA)含量及叶绿体色素含量测定 MDA含量的测定采用硫代巴比妥酸(TBA)比色法[16],叶绿素含量的测定采用丙酮提取法[17]。
1.2.3叶绿素荧光参数测定 采用便携式调制叶绿素荧光仪(Junior-Pam,Heinz Walz,Effeltrich, Germany),测量前使功能成熟叶片经过充分的暗适应后,测定葎草成熟叶片的光下最大荧光(Fm′)、 光下最小荧光(Fo′)、初始荧光(Fo)、最大荧光(Fm)、表观光合电子传递速率(ETR)、最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)和非光化学淬灭系数(qN),均由仪器自动测得,依次计算出PSⅡ潜在活性(Fv/Fo),可变荧光(Fv)(Fv=Fm-Fo)。
1.2.4统计分析 利用SPSS 17.0统计软件进行数据分析。平均值间的比较采用单因素方差分析方法(One-Way ANOVA);不同处理间的差异用Duncan多重比较检验(Duncan’s Multiple Range Test)。显著性水平设定为P=0.05。
2 结果与分析
2.1 Cr3+胁迫下葎草幼苗气体交换参数的变化
由图1可以看出,Cr3+为50 mmol/L时,Pn和WUEi比对照显著增高(图1A和F),Gs、Ci、Tr、Ls与对照无显著差异;而200 mmol/L时,Pn则下降至与对照相近,Gs、Ci和Tr也大幅度下降,但Ls和WUEi相反,比对照显著增加;同时,300 mmol/L时,与对照相比,Pn、Gs、Ci、Tr下降幅度更加显著,Ls和WUEi仍然上升;然而,500 mmol/L时,Ci、Ls和WUEi却突然下降(图1B、E和F),接近对照,但Pn、Gs、Tr仍大幅度降低(图1A、C和D)。由此可见,葎草幼苗叶片的Pn、Gs、Ci、Tr、Ls、WUEi受到了Cr3+胁迫的显著影响(P=0.000,P=0.000,P=0.003,P=0.000,P=0.000,P=0.000),Pn、Gs、Ci、Tr随着Cr3+胁迫的加重而降低,呈下降趋势,Ls和WUEi呈上升趋势。
2.2 Cr3+胁迫下葎草幼苗叶绿体色素含量的变化
由表1可以看出,Chl a和Chl b含量随Cr3+胁迫的增加而逐渐降低,具有显著差异(P=0.013,P=0.011),其中,Cr3+为50 mmol/L时,二者分别比对照下降16.55%和15.09%,500 mmol/L时二者又减少40.00%和33.96%。同时,Chl a+b和Chl x含量也随Cr3+胁迫的加重而降低,差异显著(P=0.009,P=0.002);当Cr3+为50 mmol/L时,二者分别比对照下降16.67%和15.09%,500 mmol/L时二者下降幅度较大,分别为37.88%和43.43%。因此,Cr3+胁迫对葎草幼苗叶片的叶绿体色素含量具有较大影响,Chl a、Chl b、Chl a+b、Chl x含量随Cr3+胁迫的加剧而逐渐降低,呈下降趋势,尤其是Cr3+为500 mmol/L时叶绿体色素含量显著下降。
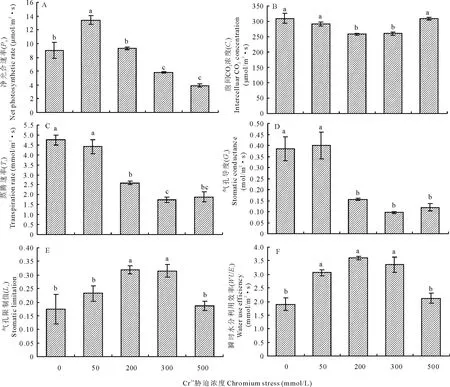
图1 铬胁迫下葎草幼苗叶片的气体交换特征
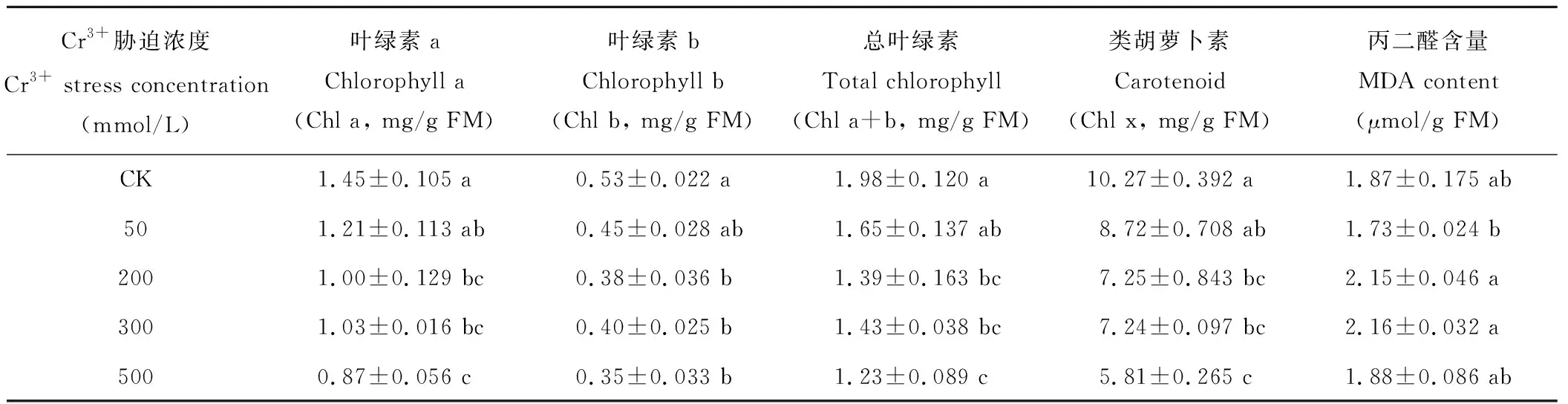
表1 铬胁迫对葎草幼苗叶片叶绿体色素和丙二醛(MDA)含量的影响
注:测定值以平均值±标准误表示,同列不同字母表示差异显著(P<0.05),下同。Note: Each value is the mean±standard error, different letters in the same column mean significant difference atP<0.05, the same below.
2.3 Cr3+胁迫下葎草幼苗丙二醛(MDA)含量的变化
从表1可以看出,Cr3+为50 mmol/L时,MDA含量比对照下降7.49%,而200和300 mmol/L时MDA含量显著上升,比对照高14.97%和15.51%,500 mmol/L时却降低,虽比对照略高,但差异不显著。从总体上来看,在不同Cr3+胁迫下,葎草幼苗叶片MDA含量存在差异(P=0.020),随Cr3+浓度的加剧呈上升的变化趋势。
2.4 Cr3+胁迫下葎草幼苗叶绿素荧光参数的变化
从表2可以看出,在不同Cr3+胁迫下,葎草幼苗叶片叶绿素荧光参数存在显著差异。50 mmol/L时,Fo′、Fm′、Fo、Fm和Fv均比对照显著降低,在200和300 mmol/L胁迫时其变化不显著,但仍然大幅度下降,且出现最小值,而500 mmol/L时,Fo′、Fm′、Fo、Fm和Fv虽比对照仍显著降低,但均有所增高。另外,ETR截然相反,50 mmol/L时最低(3.10 μmol/m2·s),随着Cr3+胁迫的加重,ETR逐渐升高,而在300 mmol/L浓度时出现最大值(27.35 μmol/m2·s)。从总体上来看,Cr3+胁迫导致葎草幼苗的Fo′、Fm′、Fo、Fm、Fv和ETR具有显著影响(P=0.000,P=0.000,P=0.013,P=0.011,P=0.000,P=0.009),Cr3+浓度越高,葎草叶片的Fo′、Fm′、Fo、Fm、Fv逐渐降低,呈下降趋势,ETR却逐渐增高,呈上升趋势。
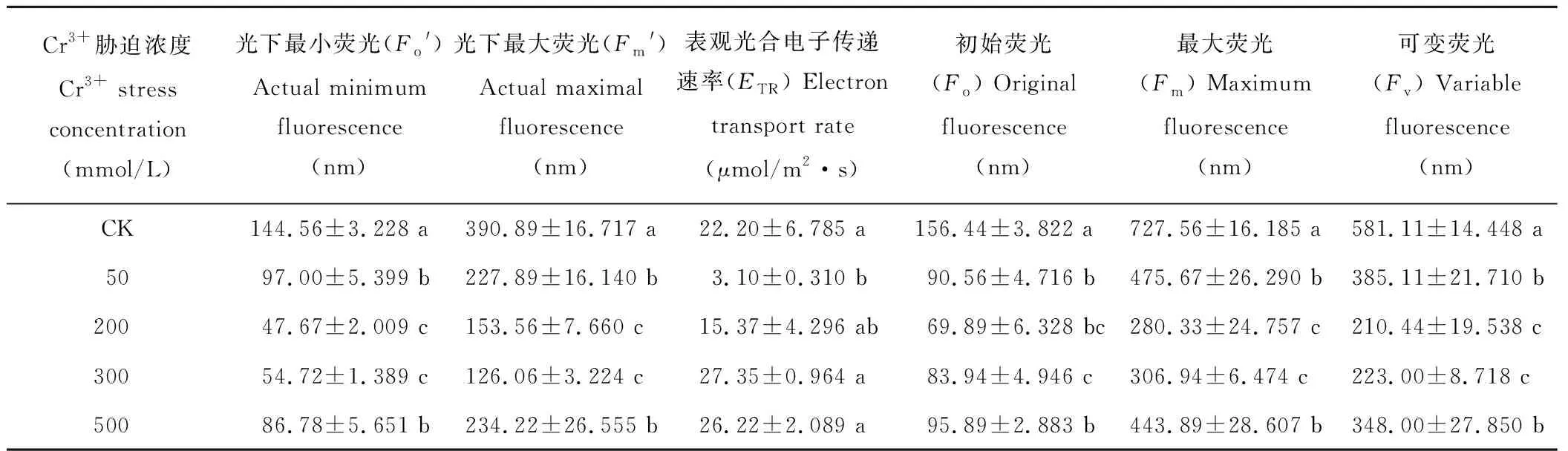
表2 铬胁迫对葎草幼苗叶片叶绿素荧光参数的影响
2.5 Cr3+胁迫下葎草幼苗光系统Ⅱ反应中心的变化
从图2可以看出,Cr3+为50 mmol/L时,Fv/Fo、Fv/Fm、qP、qN均比对照增高,但Fv/Fo、Fv/Fm增幅不显著,而200 mmol/L时,四者却均比对照降低,其中Fv/Fo和Fv/Fm下降显著(图2C和D),且300 mmol/L时,Fv/Fo和Fv/Fm仍然大幅度减少,qP也显著降低,但qN增幅明显(图2A和B);然而500 mmol/L时却与之相反,Fv/Fo、Fv/Fm、qP、qN均与对照相近,没有显著差异,其中Fv/Fo、Fv/Fm、qP突然升高,而qN则又下降。由此可以看出,Cr3+胁迫对葎草幼苗叶片光系统Ⅱ反应中心具有较大影响,其Fv/Fo、Fv/Fm、qP、qN差异显著(P=0.002,P=0.003,P=0.003,P=0.006),Fv/Fo、Fv/Fm、qP随Cr3+胁迫的加剧呈下降趋势,qN变化无规律,但重度胁迫(500 mmol/L)时,Fv/Fo、Fv/Fm、qP、qN均与对照接近。
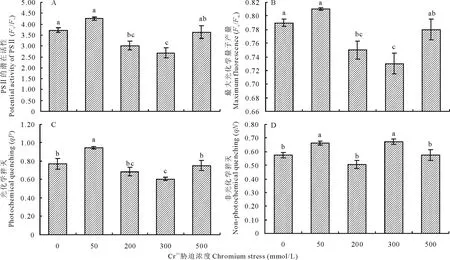
图2 铬胁迫下葎草幼苗叶片的光系统Ⅱ反应中心特征
3 讨论
3.1 低浓度Cr3+胁迫对葎草幼苗光合生理特性的影响
植物叶片净光合速率(Pn)的大小是衡量植物光合作用能力强弱的重要指标。本试验结果表明,葎草幼苗在低浓度(50 mmol/L)Cr3+下Pn和WUEi显著增高,而Gs、Ci、Tr和Ls均没有变化。Ci和Gs是反映气孔开张程度的重要指标,其值的变化反映了叶肉细胞内外CO2浓度的变化状况。在本研究中,低浓度Cr3+(50 mmol/L)处理下葎草幼苗的光合速率显著增加,而Gs和Ci均无显著变化。因此,我们推测低浓度Cr3+胁迫下葎草净光合速率的增高与气孔行为无关,而极可能与光合色素、光系统中的电子传递能力和酶的活性增强有关。进而,我们对叶片色素含量以及叶绿素荧光参数的测定结果发现,低浓度Cr3+胁迫下葎草叶绿素a、b以及总色素含量均无显著变化,而qP和qN均比对照显著增加。根据陈建明等[18]的解释,光化学淬灭系数qP反映了PSⅡ原初电子受体QA的还原状态,qP愈大,PSⅡ的电子传递活性愈大;而qN反映的是P天线色素吸收的不能用于光合电子传递而以热形式耗散掉的光能部分,是反映光合机构自我保护机制的指标。由此证实了低浓度Cr3+胁迫可能通过促进了PSⅡ电子传递活性来增加了净光合速率。因此,我们的研究结果表明了低浓度的Cr3+对植物的生长具有一定的刺激作用。该结论与许建光等[19]认为微量铬能提高植物体内某些酶的活性而促进植物生长的观点完全一致。
3.2 中浓度Cr3+胁迫对葎草幼苗光合生理特性的影响
在中浓度(200~300 mmol/L)Cr3+胁迫下,我们发现随着Cr3+胁迫的加重,Pn、Gs、Ci和Tr均下降,Ls上升。根据Farquhar和Sharkey[20]的观点:当Pn下降,Ci也减小,而Ls增大,可以认为Pn的下降主要是由于Gs的降低;如果Pn下降,Ci升高,而Ls减少,便可以肯定叶肉细胞光合活性的降低是Pn下降的决定因素。因此,我们可以确定在中度Cr3+胁迫下Pn显著下降的原因可能与气孔限制所引起CO2进入叶片受阻有关。然而,Ls与WUEi变化趋势却相似,随着Cr3+浓度的增加而增加,其原因可能是气孔减少对H2O分子的影响比CO2更大,受到胁迫时气孔部分关闭,导致水分利用效率提高。此外,光合色素以及叶绿素荧光参数的测定结果表明,在中浓度(200~300 mmol/L)Cr3+胁迫下,与对照相比葎草叶片的叶绿素a、叶绿素b、总色素含量、类胡萝卜素含量以及光系统Ⅱ的潜在活性(Fv/Fo)、最大光化学量子产量(Fv/Fm)、光化学淬灭系数(qP)和非光化学淬灭系数(qN)均显著下降。Fv/Fm是开放的PSⅡ反应中心捕获激发能的效率,是反映植物PSⅡ受伤害程度的重要参数[21]。在中浓度Cr3+胁迫下,Fm、Fv、Fv/Fo下降反映了葎草幼苗的PSⅡ反应中心开放程度减弱,光合电子传递速度减慢,不仅碳同化速率降低,而且Rubisco和PSI与PSⅡ间的电子传递位点还可能遭到破坏[22]。
此外,Pandey和Sharma认为[23],Cr3+在植物体内没有一定的转运途径,而是通过和铁竞争转运蛋白才能到达植株上部,这样叶片中的铁含量会减少,造成叶绿素合成量减少[19]。所以,我们的研究结果进一步证实了中浓度的Cr3+胁迫可以对叶绿素合成产生严重影响,使得叶绿素含量显著降低,导致光化学反应过程中PSⅡ的酶和电子传递也受到显著影响。
3.3 高浓度Cr3+胁迫对葎草幼苗光合生理特性的影响
在高浓度(500 mmol/L)Cr3+胁迫下,我们发现葎草植株的Pn、Gs、Tr与对照相比显著降低,尤其是光合色素Chl a、Chl b、Chl a+b和Chl x的含量随浓度越高其值显著降到最低,而气孔限制值(Ls)与胞间CO2浓度(Ci)却无显著变化。由此反映出随Cr3+浓度的加重,Cr3+与铁竞争转运蛋白的现象加剧[23],叶绿素合成量不仅受到影响,甚至影响其光合功能,从而导致了Pn的显著下降。葎草光合色素含量的这种变化趋势,与二月兰(Orychophragmusviolaeeus)、玉米(Zeamays)的叶绿素含量的变化规律完全吻合[24-25]。另一方面,我们却发现叶绿素荧光参数Fv/Fo、Fv/Fm、qP和qN以及反映膜脂过氧化程度的MDA含量与对照相比却无显著变化(表1,图2),这可能是大量Cr3+干扰原有离子间的平衡系统,致使PSⅡ反应中心不可逆失活,引起Fo增加,QA处于氧化还原状态,Fv随光合活性而变化,为了保护PSⅡ免遭破坏,非辐射能量耗散也随之增强,因此qP上升,qN下降,我们猜测也许是防御PSⅡ过量激发或结构严重损伤的某种机制,或是细胞内积累的Cr3+通过其他方式影响植物的生理生化活动,与部分大分子物质结合,取代了某些必需的特定元素,使其变性或活性降低,这也可从较低水平的MDA得到印证。作为检测植物受逆程度的重要指标,多数的研究结果表明,胁迫环境下植物的MDA含量常常高于正常生境中的植物。然而,在极高胁迫环境下 MDA含量的变化规律研究尚少。在本实验过程中,我们发现当Cr3+胁迫下的浓度升至500 mmol/L时,MDA含量与对照组的含量相比并没有显著变化,这与前人的结果似乎并不一致[4-6]。
另一方面,部分研究也发现了植株MDA含量在高胁迫下呈现降低现象。如高丽萍等[26]在猕猴桃(Actinidiachinensis)的衰老试验中,观察到MDA 含量先升后降。此外,覃鹏等[27]的研究也证实了在干旱胁迫下各个烟草(Nicotianatabacum)品种(系)的MDA含量总体上随着干旱胁迫的不断加重而呈现出先升后降的趋势,其原因估计是高胁迫程度下植株严重受害,叶片全部萎蔫而不能进行正常的生物合成,反而不断消耗干物质,导致MDA不仅不能产生,甚至处于持续的降解之中,所以随着干旱处理的加重而呈现下降趋势。多数的研究认为,铬可引起永久性的质壁分离并使植物组织失水,高浓度的铬对线粒体的伤害是不可逆转的,将造成呼吸作用降低,甚至植物细胞死亡[28-30]。因此,我们推测高浓度铬胁迫导致植株根部细胞发生永久性的质壁分离并使植物组织失水,植物体内的代谢过程发生紊乱,化学成分发生改变,引起部分细胞的死亡,最终导致MDA含量不仅没有随胁迫加强而继续增高,而是相应地发生了降解,造成含量降低。在实验中我们观测到高浓度铬胁迫下植株在7 d内很快出现萎蔫的现象,这也间接地证明了推测的合理性。
综上所述,低浓度Cr3+胁迫可以通过促进PSⅡ电子传递活性来增加葎草幼苗的净光合速率,从而在一定程度上促进植株生长。中等浓度Cr3+胁迫则严重影响了植株气孔的扩张行为,降低了光合色素含量,同时减弱了PSⅡ反应中心开放程度以及光合电子的传递速度,从而导致葎草幼苗的净光合速率显著下降,植株生长受到抑制。高浓度Cr3+胁迫则能导致植物体内的代谢过程发生紊乱,引起部分细胞的死亡,光合色素含量下降,净光合速率降到最低,植株生长受到严重影响。此外,由于Cr3+毒害是多方面的,其抗性机理十分复杂,Cr3+胁迫影响植株生长的关键途径及因素还有待进一步深入研究。
