半滑舌鳎促黄体激素基因克隆和表达分析及其血清浓度测定
2014-01-02柳学周王珊珊徐永江李晓晓
柳学周,史 宝,王珊珊,徐永江,李晓晓
(中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,青岛市海水鱼类种子工程与生物技术重点实验室,山东青岛266071)
1 前言
脊椎动物生殖活动主要受下丘脑—脑垂体—性腺轴(HPG)3个不同层次的内分泌系统调控。促性腺激素(GTH)是由垂体合成和分泌的一类糖蛋白激素,在鱼类的性腺发育、性类固醇及多肽类激素调控中起着至关重要的作用。脑垂体GTH包括促滤泡激素(FSH)和促黄体激素(LH),它们是异源二聚体,都是由α和β亚基以非共价键相连组成的二聚体结构,其中α亚基氨基酸组成相同,而β亚基明显不同,具有特异的生物学作用。
通过对大马哈鱼(Oncorhynchusketa)GTH生物学功能的研究,发现两种GTH在表达模式及生殖周期不同发育阶段的水平有所不同[1]。生理学研究表明,LH主要调控性腺成熟及排精/排卵[2~4]。LH由脑垂体前叶细胞分泌,通过血液循环到达性腺及其他组织,鱼类LH相应生物学功能及水平的变化规律已有报道。用放射免疫法测定虹鳟鱼(Oncorhynchus mykiss)[5]的GTH,发现LH在排精及卵母细胞最终成熟和排卵时大量分泌并达到最高峰,促使卵母细胞和精子最终成熟并刺激排卵排精。
半滑舌鳎(Cynoglossus semilaevis Günther)是重要的海水养殖经济鱼类,属秋季产卵型鱼类[6],自然繁殖季节为9—10月份,卵巢内卵母细胞发育不同步,是分批成熟多次产卵类型鱼类[7]。近年来,半滑舌鳎生殖调控及规模化人工繁育技术的研究获得重大突破[8]。目前,国内外多种硬骨鱼类的LH cDNA序列已成功克隆,包括鲤形目[9]、鲈形目[10]、鳗鲡目[11]和鲑形目[12]等,但关于半滑舌鳎LH的研究尚未见报道。本文应用分子生物学和碘(125I)放射免疫分析法(RIA),克隆得到半滑舌鳎LH的全长cDNA序列,对其mRNA组织表达及繁殖周期表达特征进行分析,并检测血浆LH在雌性半滑舌鳎繁殖周期的变化规律,揭示其可能的生理功能,以期为鱼类促性腺激素及生殖内分泌调控的研究提供科学依据,为提高半滑舌鳎全人工育苗和转季节育苗的生殖调控效率提供理论参考。
2 材料与方法
2.1 实验材料
实验用半滑舌鳎于2011年6月—2012年1月采自青岛忠海水产有限公司。实验鱼为野生亲鱼自然产卵后,人工育苗得到的健康苗种,经室内人工养成达到性成熟年龄的F1代亲鱼。研究用15尾雌性亲鱼全长53~66 cm,体重1 266.3~2 271.0 g。亲鱼培育条件:全年开放流水培育,人工调控亲鱼发育及产卵过程,产卵前2个月左右进行亲鱼强化培育。水温由20℃逐渐提高到25℃,并使用遮光幕和白炽灯进行光照强度和光照节律的调节,控制光强200~300 lx,光照时间由8 h/d逐渐增加到12 h/d[13]。将半滑舌鳎各组织样品取出,迅速于液氮中冻存,并转入-80℃冰箱保存备用,取样操作要避免各样品间的交叉污染。Davidedsons液固定卵巢组织用于组织学观察。
2.2 药品和试剂
RNA提取试剂RNAiso Plus、Taq酶、DNaseⅠ(RNasefree)、RNasin、SYBR Prem ix Ex TaqTMⅡ试剂盒购自TaKaRa公司,SMARTTMRACE cDNA扩增试剂盒、Advantage 2 PCR试剂盒购自Clontech公司,E.Z.N.AGelExtraction Kit普通琼脂糖凝胶DNA回收试剂盒购自OMEGA公司,pEASY-T1载体、Trans1-T1 Phage Resistant感受态细胞购自全式金公司,其余均为国产分析纯。所有PCR引物由TaKa-Ra公司合成,序列由北京华大基因公司测定。血浆中LH含量的测定,试剂盒Iodine[125I]-LH RIA Kit购自天津九鼎医学生物工程有限公司。
2.3 卵巢组织学分析
卵巢组织经常规梯度乙醇脱水后,二甲苯透明,石蜡包埋。LEICA RM 2235型切片机(德国)切片,厚度为5~7μm,H.E染色,中性树胶封片,LEICA DW 4000B型显微镜(德国)下观察及显微摄影。参考半滑舌鳎卵巢发育组织学研究中的分类标准[14],确定卵巢发育情况。
2.4 总RNA的提取和cDNA的合成
取-80℃保存的半滑舌鳎各组织:脑、垂体、鳃、心、头肾、肾、肝、脾、胃、肠、卵巢、肌肉各50~100 mg,用RNAiso Plus抽提总RNA,通过1%琼脂糖凝胶电泳检测RNA完整性,采用Nanodrop2000(美国Thermo公司)测定总RNA浓度。各组织RNA经反转录合成cDNA第一链,于-20℃保存备用。
2.5 半滑舌鳎LH基因克隆
-20℃保存的cDNA作为PCR模板,通过RTPCR反应获得半滑舌鳎LH基因的保守片段,所用引物为LHF和LHR。PCR产物经2%琼脂糖凝胶电泳分离后,切下目的条带,使用E.Z.N.A Gel Extraction Kit回收纯化PCR产物(操作步骤严格按照OMEGA公司胶回收试剂盒说明书)。回收产物与pEASY-T1克隆载体连接,重组子转化至Trans1-T1 Phage Resistant感受态细胞,在含氨苄青霉素的LB平板上37℃培养过夜,挑取阳性克隆送至北京华大公司测序。
根据扩增得到的序列设计特异性引物LHGSP1、LHNGSP1(5’RACE)和 LHGSP2(3’RACE),应用SMARTTMRACE cDNA扩增试剂盒克隆半滑舌鳎LH cDNA全长。提取新鲜垂体组织总RNA,用于5’-RACE及3’-RACE cDNA第一链合成,合成的cDNA第一链分别用Advantage 2 PCR试剂盒(Clontech公司)进行PCR扩增。PCR反应体系25μL,反应条件为94℃ 30 s,68℃ 30 s,72℃2 m in,共25个循环。取5μL产物于1%琼脂糖凝胶电泳检测后,再次对目的条带进行回收、与载体连接、转化、筛选阳性克隆并测序。实验中所用的引物见表1。
2.6 序列分析
Dnastar软件分析蛋白分子量和等电点;所得序列在NCBI数据库中进行BLAST比对,分析半滑舌鳎LH与其他物种的LH同源性高低;从GenBank中选择脊椎动物哺乳纲和鱼纲的物种的LH序列,鱼纲分类到目,具体见表2。这些序列用于同源性比较及进化树构建。运用Clustal X2进行多重序列比对;系统进化树构建使用MEGA4.0软件中Neighbor-joining法(自展值为1 000)。

表1 实验所用引物及其序列Table 1 Sequencesof the primersused for the PCR analysis
2.7 实时荧光定量PCR检测m RNA组织及周期表达差异
根据克隆得到的半滑舌鳎LH cDNA的序列,设计并合成引物LHF1和LHR1,同时合成18S F和18SR作为内参引物。对繁殖周期半滑舌鳎表达分析,每个发育阶段分别取3条半滑舌鳎,并且每个实验鱼设定3个平行。取半滑舌鳎组织,合成cDNA第一链,应用实时定量PCR(qRT-PCR)方法检测LHmRNA在不同组织及繁殖周期的相对表达量。反应体系参考SYBR Prem ix Ex TaqTMⅡ(宝生物工程(大连)有限公司)试剂盒说明书,使用2-Step法,反应条件为:95℃预变性30 s,95℃预变性5 s,60℃预变性22 s,共40个循环。
实时荧光定量PCR反应在Eppendorf公司的Mastercycler eprealplex上进行,并收集反应信息。程序运行完成后进行熔解曲线分析以确定引物及反应是否正常。为保证结果的可靠性,进行三次平行试验。所得数据采用SPSS(13.0)统计进行单因素方差分析(one-way ANOVA)和Duncan’s多重比较分析,P<0.05表示差异显著。最后依据2-△△Ct方法[15],制作出mRNA相对表达量的关系图表。

表2 同源性比较及进化树中引用的基因序列号Table2 Genbank accession number of genesused for homologue and phylogenesis analysis
2.8 血浆LH繁殖周期浓度测定
实验用鱼同2.1节实验材料。即在每次取样时都对半滑舌鳎进行抽血,12 000 r/m in、4℃离心10 min,吸取上清液。血清于-20℃保存备用。采用碘(125I)RIA法测定血浆中LH含量,先制作标准曲线,当相关系数R接近于1时,曲线理想,如图1所示。然后,每个样品双管平行上样于FJ-2008PSγ放射免疫计数器进行检测,样品间再设两个平行。实验数据表示为平均数±标准差(Mean±SD),使用SPSS16.0软件进行显著性检验分析。
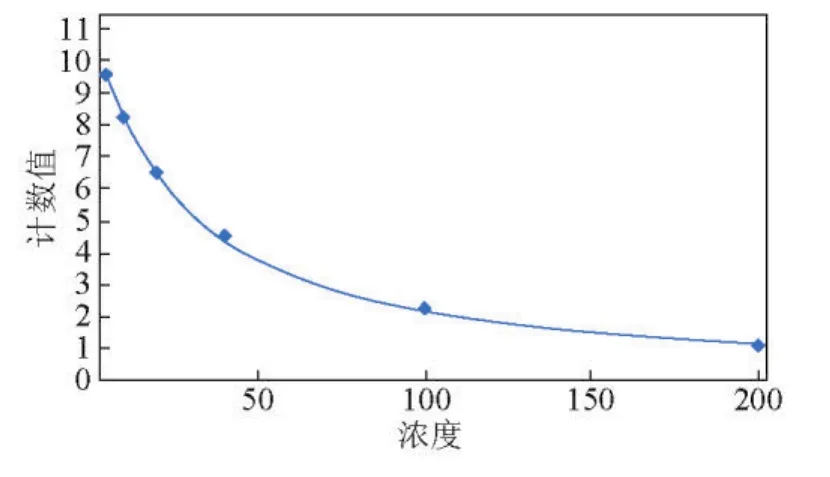
图1 血浆LH测定标准曲线(R=0.999 7)Fig.1 The determination stand and curve of plasma LH(R=0.999 7)
3 结果
3.1 LH序列分析
通过实时荧光定量PCR方法,使用引物LHF和LHR获得长度为197 bp的保守片段。经RACE反应后克隆测序,将5’-RACE和3’-RACE所得片段与所获得保守序列拼接得到LH基因cDNA全长,其长度为670 bp,开放阅读框为477 bp,编码158个氨基酸,其分子量为18 kD,等电点为5.9;第1到第25个氨基酸为信号肽,成熟肽序列包含12个保守的半胱氨酸残基(Cys)。且此序列3’端非编码区含有一个加尾信号AATAAA(见图2),该序列已提交至GenBank(序列号JQ277934)。图3为半滑舌鳎LH氨基酸与其他物种的比较。
3.2 LH氨基酸序列比对及同源性分析

图2 半滑舌鳎LH全长以及推断的氨基酸序列分析Fig.2 cDNA sequence and putative amino acid sequence of the LH of C.semilaevis

图3 半滑舌鳎LH氨基酸与其他物种LH氨基酸序列的比较Fig.3 Alignment amino acid of C.semilaevis LH with other species
半滑舌鳎LH成熟肽与鲽形目鱼类LH成熟肽的相似性分别为塞内加尔鳎(Solea senegalensis)66%、庸鲽(Hippoglossus hippoglossus)69%和牙鲆(Paralichthys olivaceus)67%。半滑舌鳎LH成熟肽与鲈形目鱼类LH成熟肽的相似性分别为斜带石斑鱼(Epinephelus coioides)74%、真鲷(Pagrusmajor)74%和尼罗罗非鱼(Oreochromis niloticus)73%。半滑舌鳎LH成熟肽与鲤形目鱼类LH成熟肽的相似性分别为金鱼(Carassius auratus)58%和斑马鱼(Danio rerio)54%。
半滑舌鳎的LH成熟肽与其他硬骨鱼类和人类的LH进行多序列比对时发现,半滑舌鳎LH氨基酸具有糖蛋白激素保守的12个半胱氨酸残基。在半滑舌鳎的LH成熟肽的氨基酸序列中,发现了一个N-糖基化位点:19~21 NQT;该糖基化位点在大多数硬骨鱼类是保守的。在半滑舌鳎成熟肽序列中存在与其他动物高度保守的特征基序如LH的第4个半胱氨酸残基位点和第5个半胱氨酸残基位点之间存在着硬骨鱼类特异性的Cys-Ser-Gly-His(CSGH)区域。
3.3 LH系统进化分析
通过MEGA4.0软件Neighbor-Joining法构建NJ系统进化树(见图4),置信度检验1 000次,获得的进化树表明硬骨鱼类LH聚类,亲缘关系较近;而与哺乳类和鸟类等亲缘关系较远。不同物种LH氨基酸序列比较发现:半滑舌鳎LH与鲽形目和鲈形目的LH相似性(58%~68%)比鲑形目(48%~50%)、鲤形目(47%~51%)、鳗鲡目(47%)、鲇形目(48%)和高等脊椎动物人类(34%)LH同源性高。但是半滑舌鳎LH与鲽形目中的其他鱼类LH同源性相对低(58%~64%),与鲈形目LH同源性较接近(64%~68%);这可能是导致鲽形目LH不能聚为一簇的原因。
3.4 LHm RNA在不同组织的表达分析
采用实时荧光定量PCR法,检测LH在半滑舌鳎的脑、垂体、鳃、心、头肾、肾、肝脏、脾脏、胃、肠、卵巢、肌肉12种组织中的表达。结果如图5所示,LH在所有组织中都有表达,在垂体相对表达量最高,在脑和卵巢中表达量相对较丰富,分别比垂体低约78 740倍和5 180倍。另外,在鳃、心、头肾、肾、肝脏、脾脏、胃、肠、肌肉这9个组织中,LH mRNA虽然表达量非常小,但仍可检测到表达。单因素方差分析结果显示,LHmRNA在垂体的表达与其他组织中的表达量差异显著(P<0.05)。
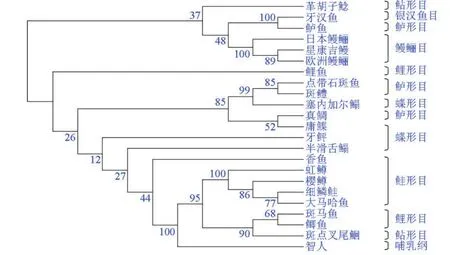
图4 基于MEGA4.0中的NJ方法的半滑舌鳎LH与其他物种分子进化树聚类分析Fig.4 Phylogenetic tree of the LH from C.semilaevis and other vertebrates in M EGA4.0
3.5 半滑舌鳎组织学
对实验用鱼的卵巢进行组织切片和H-E染色,并进行半滑舌鳎卵巢发育分期(见图6)。Ⅱ期卵巢:几乎全为Ⅱ时相卵母细胞;胞质嗜碱性,可见数个核仁(见图6a)。Ⅲ期卵巢:排列紧密,以Ⅲ时相卵母细胞为主,也有Ⅱ时相卵母细胞存在。细胞体积增大,呈规则的椭圆形。胞质嗜碱性,胞核内可见大量核仁(见图6b)。Ⅳ期卵巢:以Ⅳ时相卵母细胞为主,可见少量Ⅱ时相和Ⅲ时相卵母细胞。体积显著增加,辐射带增厚,胞质内卵黄颗粒充满,偏嗜酸性(见图6c)。Ⅴ期卵巢:以Ⅴ时相卵母细胞为主,体积继续增大,胞质中充满粗大的卵黄颗粒,并逐渐融合成块状;细胞核偏位,核膜逐渐模糊(见图6d)。Ⅵ期卵巢:可见正在退化的卵母细胞,有少数Ⅱ和Ⅲ时相的卵母细胞,放射膜厚,卵黄颗粒、胞核模糊消失,可见闭锁空泡(见图6e)。
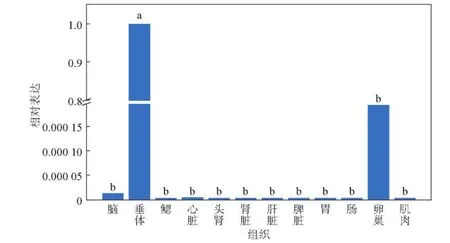
图5 半滑舌鳎LHmRNA在不同组织中的表达水平Fig.5 Expression level of LH m RNA in different tissues of C.semilaevis tissues
3.6 LH m RNA在雌性半滑舌鳎繁殖周期的表达模式
采用实时荧光定量PCR方法检测雌性半滑舌鳎LHmRNA在繁殖周期Ⅱ~Ⅵ期的脑、垂体、卵巢3个组织中的表达水平,表明LHmRNA在Ⅱ~Ⅵ各繁殖周期的脑、垂体、卵巢3个组织都有表达,但表达水平有差异,具体结果见图7。
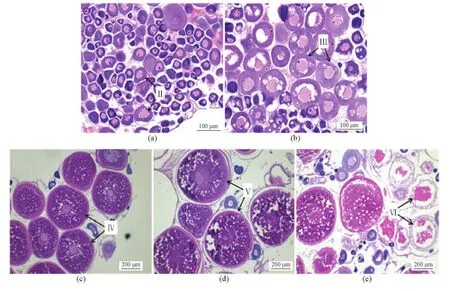
图6 半滑舌鳎卵巢不同发育时期的组织切片Fig.6 The stained sections for each of ovarian development stageof C.semilaevis Günther
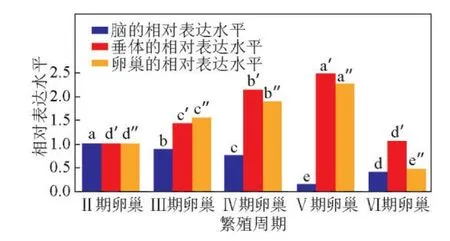
图7 LH m RNA在雌性半滑舌鳎繁殖周期的表达水平Fig.7 Expression level of LHm RNA in reproductive cycles of female C.semilaevis
脑组织中,LH mRNA在Ⅱ~Ⅴ期表达水平下降,Ⅳ期急剧下降,到Ⅴ期时达最低水平,并明显低于其他发育期水平,Ⅵ期时又有所回升。由SPSS16.0软件显著性检验分析得出,LH mRNA在各繁殖周期脑组织的表达水平差异显著(P<0.05)。垂体组织中,LHmRNA的表达水平在Ⅱ~Ⅴ期稳步上升,Ⅴ期达最高水平,Ⅵ期下降基本与Ⅱ期表达水平相同。显著性检验分析表明,垂体LH mRNA在Ⅱ、Ⅵ发育期的表达处于同一低水平,差异不显著(P>0.05),并与Ⅲ、Ⅳ、Ⅴ发育期的高表达水平差异显著(P<0.05)。说明垂体组织的LH在性腺成熟及排卵时期(尤其Ⅴ期)水平高,而卵巢发育前期和排卵后水平较低。卵巢组织中,LHmRNA的表达水平在Ⅱ~Ⅴ期逐渐上升,到Ⅴ期时达最高水平,Ⅵ期急剧下降,达最低值。显著性检验分析表明,卵巢LHmRNA各发育期的表达水平差异显著(P<0.05)。推测卵巢LH主要对卵母细胞最终成熟及卵子排出的卵巢起作用,Ⅴ期卵巢已完全成熟;Ⅵ期卵巢退化,此时卵巢除含有很多退化的卵母细胞外,一部分卵母细胞退化至Ⅱ、Ⅳ时相,此时卵巢LH发挥相对较弱的生理作用。
3.7 血清LH在雌性半滑舌鳎繁殖周期的变化规律
雌性半滑舌鳎繁殖周期血清LH浓度变化呈现明显的周期性变化规律,即呈先上升后下降的趋势。Ⅱ期时浓度最低,均值为3.24m IU/m L;之后上升,Ⅴ期时达到最大浓度,均值为4.80m IU/m L,说明LH在卵巢发育至Ⅴ期(即卵母细胞成熟及排卵)时发挥最大作用,LH主要参与卵子的成熟及排放过程;Ⅵ期浓度明显下降(P<0.05),均值只有3.55 m IU/m L,说明卵母细胞退化时LH作用有所减弱;但浓度高于Ⅱ期,此时卵巢内存在退化的Ⅱ、Ⅲ、Ⅵ时相卵母细胞(见图8)。
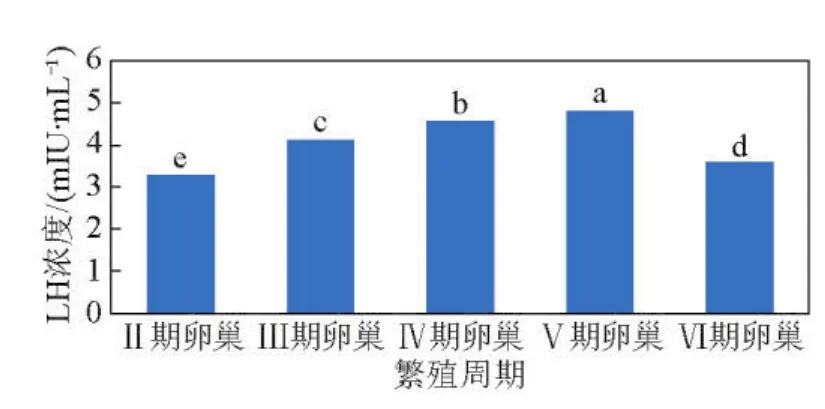
图8 雌性半滑舌鳎繁殖周期血浆LH的浓度Fig.8 Concentration of plasma LH in reproductive cycles of female C.semilaevis
雌性半滑舌鳎繁殖周期,采用碘(125I)RIA法测定血浆LH变化规律与实时荧光定量PCR方法检测到的LHmRNA水平在垂体及卵巢组织的变化规律基本一致。
4 讨论
4.1 半滑舌鳎LH基因克隆及序列分析
本实验克隆了半滑舌鳎LH cDNA的全长序列,并对半滑舌鳎的LH与其他脊椎动物氨基酸序列的同源性进行比较,结果显示半滑舌鳎LH同鲽形目、鲈形目的LH相似性较高,而同哺乳动物LH的相似性相对低。半滑舌鳎LH成熟肽序列包含12个半胱氨酸残基Cys,与所比对的各物种中完全保守(见图4),并与GTHα亚基交联形成二硫键,参与蛋白折叠及配体受体相互作用[16],因此,硬骨鱼类LH结构的变化会影响到与受体结合能力及异源二聚体的稳定性。四足类及硬骨鱼类的LHβ存在与GTHα结合相关的某些重要的氨基酸残基,比如一些硬骨鱼类第4个和第5个Cys位点之间就存在着特异性的Cys-Ser-Gly-His(CSGH)区域[17],半滑舌鳎的这一结构(见图4)也能反映LH在进化中高度的保守性。另有研究发现,鳎目鱼LH多肽一级结构有一个N-糖基化位点,与其他硬骨鱼类和高等脊椎动物保持高度保守性,这一结构可能与有机体的生物合成及激素调控有关[18]。本研究发现半滑舌鳎LH也有1个N-糖基化位点Asn(19~21 NQT)(见图4),具体生理机能有待进一步探究。依据Neighbor-Joining方法构建系统进化树,发现半滑舌鳎LH与鲽形目中的其他鱼类LH同源性(58%~64%)比鲈形目(64%~68%)相对较低,这可能是导致鲽形目LH不能聚为一簇的原因。
4.2 LH基因在繁殖季节半滑舌鳎的组织表达
利用实时荧光定量PCR方法检测LH基因在半滑舌鳎各组织的表达,结果发现:所有组织中均有表达,垂体表达量最丰富,其他组织表达量都很小,脑和性腺相对表达量较高。在尼罗罗非鱼(Oreochromis niloticus)、红大马哈鱼(Oncorhynchus nerka)[19]、金头鲷(Sparusaurata)[20]和斑马鱼(Danio rerio)[21]的研究中,利用半定量实时PCR方法和免疫细胞化学检测方法,检测到LHmRNA在非垂体组织中亦有表达,与本研究结果相似。但有关LH mRNA在非垂体组织中广泛表达的生理机制尚未明确,推测半滑舌鳎LH可能具有更加广泛的垂体外的生理功能,对此进行深入研究具有重要意义。
4.3 雌性半滑舌鳎LHmRNA周期表达模式分析
本研究表明半滑舌鳎卵巢发育至Ⅱ期,LH mRNA表达量相对低,之后mRNA水平逐渐稳步上升;直到Ⅳ~Ⅴ期mRNA表达量急剧增大。说明LH主要促进卵母细胞最终成熟及排卵。有研究利用原位杂交、放射免疫、Northern blot、实时荧光定量PCR等方法,检测虹鳟鱼[22~24]、许氏平鲉(Sebastes schlegeli)[25]、斑点叉尾鮰[26]的LH,发现卵巢最终成熟及排卵时LHmRNA水平急剧上升,并起主导作用。与本实验结果一致。
各时期LH不同的表达水平可能与其受体时空表达的差异性相关。斑点叉尾鮰的研究表明,垂体LH水平同卵巢LHR水平的变化规律基本一致,推测LH与其受体结合具有高度的特异性。但陈晓燕[27]对半滑舌鳎LHRmRNA进行相关研究,显示LHR在Ⅲ期卵巢和脑中表达量最丰富,与本研究结果有所不同。因此,半滑舌鳎LH与其受体结合的高度特异性有待进一步研究。
4.4 雌性半滑舌鳎血清LH周期变化及其与LH基因表达关系
实验采用RIA方法,检测半滑舌鳎血清LH在卵母细胞生长、卵黄生成、卵子成熟及排卵等各时期的表达水平。结果显示:性腺发育早期(即卵黄生成作用),血清LH浓度逐渐稳步上升,直到排卵时(Ⅴ期卵巢)浓度最大。揭示卵黄生成阶段垂体内LH大量合成并积累,从而排卵时血清LH浓度达到最高。由此可见,半滑舌鳎血清LH激素分泌的变化规律与卵巢发育、卵母细胞生长、成熟及退化基本一致,在卵子成熟及排卵时期起主导作用。这与早期虹鳟的研究结果相一致。虹鳟LH垂体合成及其血清浓度不同步,LHmRNA先在垂体合成,之后LH激素进入血液循环[28],发挥相应生理学作用。本研究同时发现,雌性半滑舌鳎繁殖周期,血浆LH浓度的变化规律同LHmRNA水平在垂体及卵巢组织的变化规律基本一致。但对于半滑舌鳎LH垂体合成及血浆浓度是否同步,应进一步进行科学实验研究。
GtH的合成及释放受各种因素制约,其中性类固醇激素作用最大。许多研究表明,虹鳟[29]、欧洲鳗鲡[30]及银大马哈鱼[31]血清LH的含量及mRNA水平与性类固醇激素有关。在血清FSH及E2[32]水平已达最高值的卵黄生成后期,LH浓度才急剧上升,说明雌激素能刺激LH垂体内合成,从而血浆LH浓度增大。半滑舌鳎GtH的合成释放与性类固醇激素的相互作用关系有待进一步研究证实。
[1] Kajimura S,Yoshiura Y,SuzukiM,etal.cDNA cloning of two gonadotropin-β subunits(GTH-Ⅰβ and Ⅱ-β)and their expression profilesduring gametogenesis in the Japanese flouder(Paralichthys olivaceus)[J].General and Comparative Endocrinology,2001,122(2):117-129.
[2] Schulz RW,Viseher H F,Cavaco JEB,etal.GonadotroPins,their receptors,and the regulation of testicular functions in fish[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,129(2-3):407-417.
[3] Schulz RW,M iura T.Spermatogenesis and its endocrine regulation[J].Fish Physiology and Biochem isty,2002,26(1):43-56.
[4] Swanson P,Dickey JT,Campbell B.Biochemistry and physiology of fish gonadotropins[J].Fish Physiology and Biochem istry,2003,28(1-4):53-59.
[5] Prat F,Sumpter JP,Tyler C R.Validation of radioimmunoas say for two salmon gonadotropins(GTHⅠ and GTHⅡ)and their plasma concentrations throughout the reproductivecycle in male and female rainbow trout(Oncorhynchus mykiss)[J].Biology of Reproduction,1996,54(6):1375-1382.
[6] 柳学周,庄志猛,马爱军,等.半滑舌鳎繁殖生物学及繁育技术研究[J].海洋水产研究,2005,26(3):15-24.
[7] 柳学周.半滑舌鳎繁殖及养殖技术(中)[J].科学养鱼,2006(11):14-15.
[8] 柳学周,庄志猛,马爱军,等.半滑舌鳎苗种生产技术的开发研究[J].海洋水产研究,2006,27(2):17-24.
[9] 周 毅.草鱼促性腺激素及其受体基因的克隆及表达分析[D].湖南:湖南师范大学,2009.
[10] Rosenfeld H,Levavi-Sivan B,Melamed P,et al.The GTH β subunit of tilapia:Gene cloning and expression[J].Fish Physiology and Biochemistry,1997,1(1-6):85-92.
[11] 张 勇,黄 海,李水生,等.花鳗鲡促性腺激素cDNA克隆与其在激素诱导性腺发育过程中的作用[R].2008.
[12] Kato Y,Gen K,Maruyama O,etal.Molecular cloning of cDNAs encoding two gonadotropin β subunits(GTH-Ⅰ βand GTH-Ⅱβ)from the masu salmon(Oncorhynchus masou):Rapid divergence of the GTH-Ⅰβgene[J].Journal of Molecular Endocrinology,1993,11:275-282.
[13] 柳学周,孙中之,马爱军,等.半滑舌鳎亲鱼培育及采卵技术的研究[J].海洋水产研究,2006,27(2):25-32.
[14] 柳学周,徐永江,刘乃真,等.半滑舌鳎卵巢发育的组织学和形态数量特征研究[J].渔业科学进展,2009,30(6):25-35.
[15] Livak K J,Thomas D Schm ittgen.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25(4):402-408.
[16] Hearn M T,Gomme PT.Molecular architecture and biorecognition processes of the cystine knot protein superfam ily:PartⅠ.The glycoprotein hormones[J].Journal of Molecular Recognition,2000,13(5):223-278.
[17] Power M E,Carolsfeld J,WallisG P,et al.Isolation and characterization of a cDNA for gonadotropinⅡ-βof Pacific herring,an ancient teleost[J].Journal of Fish Biology,1997,50:315-323.
[18] Ulloa-Aguirre A,Timossi C,Damian-Matsumura P,et al.Role of glycosylation in function of follicle-stimulating hormone[J].Endocrine,1999,11(3):205-215.
[19] Parhar IS,Soga T,Ogawa S,etal.FSH and LH-β subunits in the preoptic nucleus:ontogenic expression in teleost[J].Genral and Comparative Endocrinology,2003,132(3):369-378.
[20] Wong T T,Zohar Y.Novel expression of gonadotropin subunit genes in oocytes of the gilthead seabream(Sparus aurata)[J].Endocrinology,2004,145(11):5210-5220.
[21] So W K,Kwok H F,GeW.Zebrafish gonadotropins and their receptors:Ⅱ.Cloning and characterization of zebrafish follicle stimulating hormone and luteinizing hormone subunits-their spatial-temporal expression patterns and receptor specificity[J].Biology of Reproduction,2005,72(6):1382-1396.
[22] Natio N,Hyodo S,Okumoto N,et al.Differential production and regulation of gonadotropins(GTHⅠand GTHⅡ)in the pituitary gland of rainbow trout,Oncorhynchus mykiss,during ovarian development[J].Cell and Tissue Research,1991,266(3):457-467.
[23] Prat F,Sumpter JP,Tyler C R.Validation of radioimmunoassay for two salmon gonadotropins(GTHⅠand GTHⅡ)and their plasma concentrations throughout the reproductivecycle in male and female rainbow trout(Oncorhynchus mykiss)[J].Biology of Reproduction,1996,54(6):1375-1382.
[24] Gomez JM,Well C,Ollitrault M,et al.Grow th hormone(GH)and gonadotropin subunit gene expression and pituitary and plasma changes during spermatogenesis and oogenesis in rainbow trout(Oncorhynchus mykiss)[J].Generaland Comparative Endocrinology,1999,113(3):413-428.
[25] Kim D J,Cho Y C,Sohn Y C.Molecular characterization of rockfish(Sebastes schlegeli) gonadotropin subunits and their mRNA expression profiles during oogenesis[J].General and Comparative Endocrinology,2005,141:282-290.
[26] Kumar R S,Trant JM.Hypophyseal gene expression profiles of FSH-β,LH-β,and glycoprotein hormone-α subunits in Ictalurus punctatus throughout a reproductive cycle[J].General and Comparative Endocrinology,2004,136:82-89.
[27] 陈晓燕.促性腺激素受体在半滑舌鳎繁殖周期中的作用研究[D].青岛:中国海洋大学,2010.
[28] Gomez JM,Well C,Ollitrault M,et al.Grow th hormone(GH)and gonadotropin subunit gene expression and pituitary and plasma changes during sperma to genesis and oogenesis in rainbow trout(Oncorhynchus mykiss)[J].General and Comparative Endocrinology,1999,113(3):413-428.
[29] Trinh K Y,Wang N C,Hew C L,etal.Molecular cloning and sequencing of salmon gonadotropinβsubunit[J].European Journal of Biochemistry,1986,159(3):619-624.
[30] Querat B,Hardy A,Fontaine Y A.Regulation of the type-Ⅱgonadotropin α and β subunitm RNAsby estradiol and testosterone in the European eel[J].Journal of Molecular Endocrinology,1991,7:81-86.
[31] Dickey JT,Swanson P.Effects of sex steroids on gonadotropin(FSH and LH) regulation in coho salmon(Oncorhynchus kisutch)[J].Journal of Molecular Endocrinology,1998,21(3):291-306.
[32] Scott A P,Sumpter JP,Hardiman PA.Hormone changes during ovulation in the rainbow trout(Salmo gairdneri Richardson)[J].Gen Comp Endocrinol,1983,49:128-134.
