大菱鲆神经肽Y基因克隆及其在工厂化养殖饥饿-投喂策略中的表达特征分析
2014-01-02姜志强穆小生雷霁霖
韩 建,刘 滨,姜志强,穆小生,雷霁霖
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,青岛市海水鱼类种子工程与生物技术重点实验室,山东青岛266071;3.中国科学院动物研究所计划生育生殖生物学国家重点实验室,北京100101)
1 前言
神经肽Y(NPY)属于胰多肽家族,此家族还包括多肽YY(PYY)、胰多肽(PP)和多肽Y(PY)等,NPY与由G蛋白偶联受体构成的Y受体家族密切相关[1]。并且NPY与生物体的生长发育以及生活行为有很大的关系[2],尤其是动物的摄食,是一种内源性的促进摄食的非常保守的神经递质。NPY第一次在猪的脑部分离提取出来[3],之后相继在哺乳动物、鸟类、两栖动物和鱼中被鉴定检测出来[4,5]。
NPY在心血管功能、生殖及应激和免疫反应中都发挥着生理效应[6~12],其最重要的作用是促进摄食,这不仅在哺乳动物、鸟类和两栖动物中得到证明[13~15],在鱼类中同样得到了证明[16],由此可推断出NPY能够反映各物种的摄食情况。
起初,NPY在硬骨鱼类中的功能仅是作为促垂体激素释放激素来研究的[17~20],直至1998年,开始进行NPY在鱼类摄食和能量平衡上的研究。Silverstein等[21]对大鳞大麻哈鱼和银大麻哈鱼进行2~3周的饥饿实验后导致其下丘脑中的NPY相似信使核糖核酸(mRNA)的表达量升高。López-Patiño等[22]对金鱼进行了研究,证明NPY可促进金鱼的摄食。之后,该观点相继在斑点叉尾鮰[16]、美洲拟鲽[23]和大西洋鳕[24]等中得到证明。
大菱鲆属于鲆科、菱鲆属,是原产于欧洲北海、波罗的海和地中海沿岸的一种名贵比目鱼,1992年由黄海水产研究所引进我国[25]。大菱鲆耐低温、生长速度快、肉质鲜美,是重要的工厂化养殖经济鱼类之一。鱼类摄食一直是研究的重点内容,大菱鲆作为典型工厂化养殖鱼类,适宜的投喂不仅节约饵料,而且可避免过量的饵料对水质的污染。而NPY作为控制摄食和能量平衡的相关基因,对其结构和表达特征的研究很有必要。
本文以大菱鲆作为研究对象,克隆出NPY的全长互补脱氧核糖核酸(cDNA)序列并对其结构进行分析;同时进行NPY的组织特异性表达,并对大菱鲆进行饥饿和再投喂实验,从而研究NPY在摄食调控中的表达情况。本文为进一步研究NPY基因和大菱鲆摄食的关系奠定了基础,同时为进一步阐明鱼类摄食调控的分子机理提供了理论依据,并且建立了一个可用来研究大菱鲆摄食的分子方法,以此为基础在分子水平上研究鱼类最适于摄食的环境因素并研发可促进大菱鲆摄食和生长的相关技术与产品。
2 材料与方法
2.1 材料与试剂
本文所用的健康大菱鲆取自烟台天源水产有限公司。克隆及组织表达所用大菱鲆的平均体重为(553.35±5.15)g,平均体长为(32.50±1.31)cm。活体带回实验室后,采用乙醚对其进行麻醉,置于冰上进行解剖,迅速分离脑组织各部分和肝脏等各组织,用RNAstore样本保存液保存后,在4℃的冰箱中保存12 h后,放入80℃的冰箱中长期保存。
饥饿和再投喂实验所用的大菱鲆为60日龄稚鱼,平均体重为(5.5±0.02) g,平均体长为(2.6±0.5)cm,养殖水温为15℃,正常光照,每天7点和17点各投喂1次微颗粒饲料,实验前驯养2周。
2.2 方法
2.2.1 克隆策略和引物设计
利用美国国立生物技术信息中心(NCBI)Gen-Bank数据库中已有的大西洋鳕鱼、点带石斑鱼、牙鲆和美洲拟鲽等鱼类的NPY序列保守区域,并结合Primer Primer 5.0,设计出扩增核心片段的一对引物F1和R1。并根据所得的核心片段设计5′末端快速扩增技术(RACE)所用的特异引物GSP1和进行巢式聚合酶链式反应(PCR)的引物NGSP1;用同样的方法设计出3′RACE所用的特异引物GSP2和巢式引物NGSP2。
将所得到全长cDNA序列设计用于实时定量PCR的特异引物(qF1和qR1),并根据大菱鲆内参基因β-actin的基因序列设计引物(βf1和βr1),用于表达分析。所有引物由铂尚生物技术(上海)有限公司合成。以上引物具体序列见表1。
2.2.2 大菱鲆NPY基因的克隆
使用TRIzol Reagent(Ambion)从大菱鲆下丘脑中提取出总RNA。使用超微量紫外分光光度计测定RNA的浓度,并用1.2%的琼脂糖凝胶电泳确定总RNA的完整性,利用Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit(Thermo)进行反转录合成cDNA第一链。使用引物F1和R1进行中间片段的扩增,PCR程序为:94℃预变性5m in;94℃变性30 s,56℃退火45 s,72℃延伸45 s,运行35个循环;72℃延伸10m in。使用普通琼脂糖凝胶DNA回收试剂盒(天根生化科技(北京)有限公司)对扩增所得片段进行分离纯化,送到北京六合华大基因科技股份有限公司进行测序。使用SMARTer™RACE cDNA Amplification Kit(Clonetech)进 行5′RACE和3′RACE,反应程序如下:94 ℃变性30 s,68℃退火30 s,进行25个循环;72℃延伸3m in。进行巢式PCR后获得目的片段,经胶回收后,克隆到pMD™ 18-TVector(TaKaRa)上,进行菌落PCR验证后,对阳性克隆进行测序。
2.2.3 序列分析
使用DNAman 6.0对开放阅读框(ORF)进行分析并推导出氨基酸序列,利用Prot Param工具(http://www.expasy.org/tools/protparam.htm l)预 测NPY蛋白的基本理化性质,运用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)对所推导出的氨基酸序列进行信号肽预测。运用ClustalX 1.83对不同物种的NPY氨基酸序列进行同源性比对,并用DNAstar中的MegA lign计算同源性,用MEGA4.0通过最大似然法构建NPY的系统进化树。
2.2.4 大菱鲆NPY基因组织特异性表达
从大菱鲆的前脑、中脑、后脑、延髓、下丘脑、垂体、腮、心脏、肝脏、头肾、肾、脾脏、肌肉、胃、肠及胆囊等16个组织,使用TaKaRa MiniBEST Universal RNA Extraction Kit提取总RNA,使用用于实时定量PCR的反转录试剂盒TaKaRa Prime ScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)进行反转录,产物稀释25倍后参照TaKaRa SYBR®Premix Ex TaqTMⅡ(TliRNaseH Plus)说明书进行实时定量PCR。使用两步法,反应程序如下:95℃预变性30 s;95 ℃ 变性5 s,62 ℃退火26 s,40个循环。反应结束进行溶解曲线分析以确定对目的片段是否进行特异性扩增。对每个样品设置3个平行实验,NPY基因和内参基因β-actin使用相同的模版量。
2.2.5 大菱鲆的饥饿和再投喂实验
实验用鱼进行2周的驯养后,最后一次投喂后进行饥饿实验,共分为两组,第一组在喂食中(0 h)及喂食后2 h、4 h、6 h、8 h、12 h、18 h、24 h、48 h和72 h进行取样,饥饿72 h后再次投喂并且于投喂中(0 h)和喂食后2 h进行取样;第二组在饥饿48 h后进行再投喂,并同样在投喂中(0 h)和喂食后2 h进行取样(在喂食中取样时允许在喂食15m in后再取样)。取大菱鲆的下丘脑,实时定量PCR的方法如第2.2.4节所述。
2.2.6 数据分析
所得的Ct值通过2-ΔΔCt法计算NPY基因的相对表达量,并且使用SPSS18.0的one-way ANOVA进行差异显著性分析(P<0.05为差异显著,P>0.05为差异不显著)。
3 结果
3.1 大菱鲆NPY基因全长cDNA序列分析及结构特征
采用PCR技术获得NPY基因的核心片段,再通过RACE方法得到两端序列,进行拼接后得到的全长cDNA序列经tblastx分析确认为大菱鲆NPY序列。大菱鲆NPY基因cDNA全长729 bp,含有70 bp 的5′非翻译区(5′-UTR)和359 bp的3′非翻译区(3′-UTR),其中3′-UTR含有加尾信号ATTAAA及PolyA尾。ORF长300 bp,编码含99个氨基酸的蛋白质,N端28个氨基酸为信号肽,信号肽后是由36个氨基酸组成的NPY成熟肽,后接蛋白质水解加工位点Gly-Lys-Arg,剩余32个氨基酸为NPY的羧基末端旁侧肽段(CPON)(见图1)。NPY蛋白的分子质量为11 301.9 Da,等电点p I为5.26,分子式为C516H799N131O150S2,脂肪系数(AI)为101.52,总平均输水指数(GRAVY)为-0.284,不稳定系数(Ⅱ)为79.96,推断此NPY蛋白不稳定。NPY蛋白的二级结构由48.48%的α-螺旋、45.45%的无规卷曲、3.03%的延伸链和3.03%的β转角组成。
使用DNAstar软件对大菱鲆NPY蛋白与其他物种的同源性进行比较,结果显示大菱鲆NPY与其他物种的同源性在53.9%~98%,其中与牙鲆的同源性最高,为98%。使用ClustalX 18.3对序列进行比对,比对结果如图2所示。进一步使用MEGA4.0构建NPY蛋白的系统进化树(见图3),根据所得进化树分析可知,大菱鲆NPY蛋白与鲽形目(牙鲆和美洲拟鲽)和鲈形目(欧洲狼鲈和黑棘鲷)等一同位于硬骨海水鱼类这一簇上,并且大菱鲆NPY蛋白与鲽形目(牙鲆和美洲拟鲽)基本处于同一分支;鲤形目(锦鲤和斑马鱼)和鲶形目(斑点叉尾鮰)处在硬骨淡水鱼类这一簇上;软骨鱼类(石纹电鳐)、两栖类(非洲爪蟾)、鸟类(红原鸡)及哺乳动物聚合为另一簇。大菱鲆NPY的分子进化地位与其生物学分类地位基本一致。

图1 大菱鲆NPY的全长cDNA序列及所推导出的氨基酸序列Fig.1 The full-length cDNA sequence and deduced amino acid sequence of NPY from turbot

图2 大菱鲆与其他物种NPY蛋白的氨基酸序列对比Fig.2 Contrast of the amino acid sequences of NPY from turbot and other species
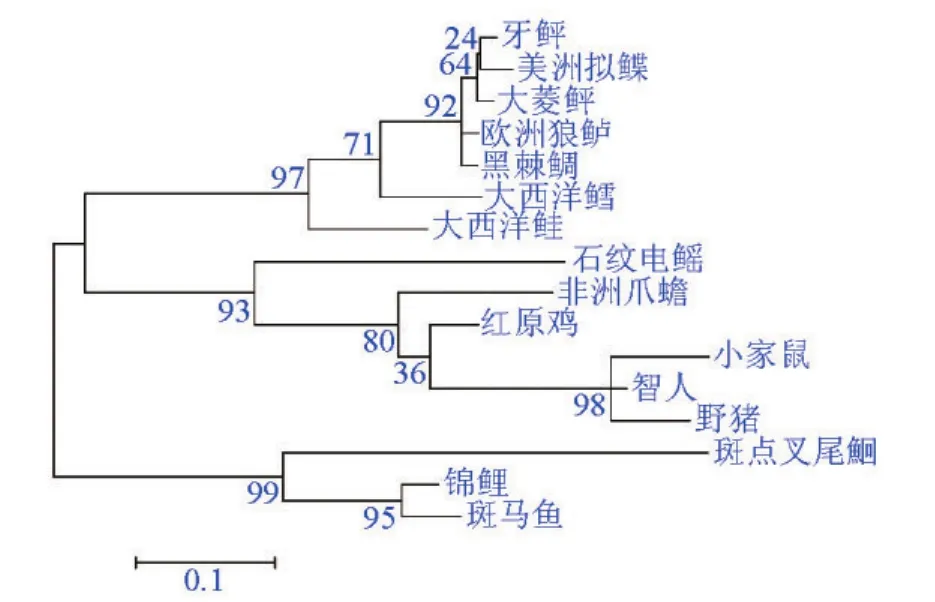
图3 根据NPY氨基酸序列使用最大似然法构建的系统进化树Fig.3 Maximum-likelihood phylogenetic tree constructed with the amino acid sequences of NPY
3.2 大菱鲆NPY基因的组织表达
采用实时定量PCR对大菱鲆16个组织中NPY的表达量进行检测。结果显示,大菱鲆NPY基因分布广泛,在16个组织中均有不同程度的表达(见图4),在脑中的表达量相对较高,其中在下丘脑中的表达量最高,并与其他15个组织的表达差异显著(P<0.05),在肌肉、胃、肠及胆囊中的表达量相对较低,而在垂体、腮、心脏、肝脏、肾脏及脾脏中的表达量最低。

图4 大菱鲆NPY基因的m RNA在不同组织中的表达Fig.4 Expression of NPYm RNA in different tissues of turbot
3.3 饥饿与投喂策略对大菱鲆NPY基因的表达影响
在饥饿实验及再投喂实验中,以饥饿实验开始时(0 h)NPY基因的mRNA表达量作为对照,设为1。饥饿实验的结果显示,在0~4 h内,随着实验的进行,mRNA的表达量升高;在4~8 h内,随着饥饿时间的延长,mRNA表达量呈现下降的趋势;在8~48 h内,NPY基因的mRNA表达量又再次显著升高,并且远远超过饥饿实验前期(0~8 h)的mRNA表达量;然而在48~72 h内,NPY基因的mRNA表达量再次显著下降(见图5)。

图5 饥饿对大菱鲆NPY基因的m RNA表达量的影响Fig.5 Effects of starvation on the expression of NPYm RNA in turbot
再投喂实验结果显示,饥饿48 h及72 h后再投喂,NPY基因的mRNA表达量相对于正常投喂组显著升高,但同时又于投喂2 h后呈现显著的下降趋势(见图6)。

图6 饥饿后再投喂对大菱鲆NPY基因的m RNA表达量的影响Fig.6 Effects of refeeding after starvation on the expression of NPYm RNA in turbot
4 讨论
本文通过使用逆转录PCR(RT-PCR)和RACE技术,从大菱鲆的脑组织中得到全长为729 bp的NPY cDNA序列,编码99个氨基酸组成的NPY蛋白,其中36个氨基酸组成NPY的成熟肽,这与其他物种的结果一致[3]。大菱鲆NPY的氨基酸序列跟其他鱼类相比,表现出较高的同源性,特别是与同属于鲆鲽鱼类的牙鲆及美洲拟鲽的同源性高达97%~98%。并且根据所得进化树分析可知,大菱鲆NPY蛋白位于硬骨海水鱼类这一分支上,与鲽形目(牙鲆和美洲拟鲽)和鲈形目(欧洲狼鲈和黑棘鲷)等的关系较近;与鲤形目(鲤鱼和斑马鱼)、鲶形目(斑点叉尾鮰)、软骨鱼类(石纹电鳐)、两栖类(非洲爪蟾)、鸟类(红原鸡)及哺乳动物的关系较远,这与同源性分析基本一致。在大菱鲆NPY成熟肽中不含半胱氨酸(C),只在信号肽第21个氨基酸位点上有一个半胱氨酸(C),并且在序列比对结果中,信号肽的第21个氨基酸位点上都为半胱氨酸(C)。比对结果显示,NPY成熟肽的36个氨基酸中有26个高度保守,这说明NPY是一种进化十分保守的神经肽。
通过实时定量PCR技术研究发现,NPY基因在大菱鲆神经组织特别是下丘脑中的表达量较高,这与其他物种的研究结果一致。下丘脑外侧区(LHA)为摄食中枢(也称饥饿中枢),起着决定发动摄食活动的作用;腹内侧核(VMH)为饱食中枢,起着决定停止进食活动的作用[26]。NPY基因mRNA在下丘脑中的表达最高,说明NPY可能与摄食和能量平衡的调节有关。NPY在神经组织中的表达量较高,在外周组织中也有表达,但不同物种间外周组织中NPY的表达量略有不同。在大菱鲆外周组织中NPY在肌肉、胃、肠及胆囊中的表达量相对于在垂体、腮、心脏、肝脏、肾脏及脾脏中的表达量较高,由此可推断在大菱鲆中NPY可能是脑-肠肽,这在其他鱼类中已得到相应的证明[24,27~29]。在肾脏中也检测到了NPY的存在,由此可得出NPY有可能与大菱鲆的渗透调节有关。大菱鲆NPY基因在消化系统(胃和肠)中的表达是除中枢系统(脑部等)外表达量最高的,这与其他物种的研究结果相一致[6]。
饥饿实验中,随着饥饿的进行,NPY的表达量显著变化(P<0.05),呈现先升高再降低,再显著升高并维持一段高水平表达后,再次下降的趋势,说明NPY跟大菱鲆的摄食相关,并且饥饿只能暂时提高NPY的表达量;在再投喂实验中,饥饿后再投喂会使NPY的表达量升高,并且饥饿时间越长,再投喂后NPY的表达水平越高,但是再投喂2 h后表达量还会再次下降至相似的水平,这都预示着NPY对摄食的调控可能是一种短期的调控机制。大菱鲆饥饿12 h后,NPY基因的表达水平开始显著上升;而金鱼饥饿72 h后,NPY基因的表达量才开始显著升高;鲶鱼则需要至少三周的时间,NPY基因的表达水平才会出现变化[16,21],这说明可能不同鱼类的耐饥饿程度及NPY的对摄食调节的强度不同。摄食0 h后和摄食2 h后的NPY的表达量会发生显著变化,这说明可能NPY不参与摄食后的消化过程,只是起到了刺激食欲的作用。NPY基因对饥饿的生理效应与其他摄食刺激因子相一致,如Orexin[30]、AgRP[31]和ghrelin[32],与其他摄食抑制因子的生理效应相反,例如 CART[24,33]和 POMC[34,35]。
这些结果表明,NPY参与大菱鲆的摄食调控,并且可能起到促进摄食的作用。
5 结语
本文首次克隆了大菱鲆的NPY基因并对其结构和表达特征进行了初步研究。大菱鲆NPY基因在神经组织中的表达水平较高,并且在下丘脑中有最大表达量,这与其他脊椎动物的实验结果相一致,但NPY在不同物种的外周组织中的表达量有所变化。在饥饿和再投喂实验中,初步得出大菱鲆NPY是一种促进摄食的食欲刺激因子,与其他物种的研究结果相一致。但是,NPY促进摄食的相关分子机制还有待进一步研究。
[1] Larhammar D,Wraith A,Berglund M M,et al.Origins of the many NPY-family receptors inmammals[J].Peptides,2001,22(3):295-307.
[2] 胡春燕,李英文.神经肽Y(NPY)的生理功能研究进展[J].生物学杂志,2011,28(2):66-68.
[3] Tatemoto K.Neuropeptide Y:Complete amino acid sequence of the brain peptide[J].Proceedings of the National Academy of Sciences of the United States of America,1982,79(18):5485-5489.
[4] Cerdá-Reverter JM,Martínez-Rodríguez G,Zanuy S,et al.Molecular evolution of the neuropeptide Y(NPY)fam ily of peptides:Cloning of three NPY-related peptides from the sea bass(Dicentrarchus labrax)[J].Regulatory Peptides,2000,95(1):25-34.
[5] Cerdá-Reverter JoséM iguel,Anglade Isabelle,Martı́nez Rodrı́ Guez Gonzalo,et al.Characterization of neuropeptide Y expression in the brain of a perciform fish,the sea bass(Dicentrarchus labrax)[J].Journal of Chemical Neuroanatomy,2000,19(4):197-210.
[6] Dumont Y,Martel JC,Fournier A,et al.Neuropeptide Y and neuropeptide Y receptor subtypes in brain and peripheral tissues[J].Progress in Neurobiology,1992,38(2):125-167.
[7] Peng C,Gallin W,Peter R E,et al.Neuropeptide-Y gene expression in the goldfish brain:Distribution and regulation by ovarian steroids[J].Endocrinology,1994,134(3):1095-1103.
[8] Preston E,Jönsson A C,M cManus CD,et al.Comparative vascular responses in elasmobranchs to different structures of neuropeptide Y and peptide YY[J].Regulatory Peptides,1998,78(1-3):57-67.
[9] Shahbazi F,Holmgren S,Larhammar D,et al.Neuropeptide Y effects on vasorelaxation and intestinal contraction in the Atlantic codGadusmorhua[J].American Journalof Physiology.Regulatory,Integrative and Comparative Physiology,2002,282(5):R1414-R1421.
[10] Volkoff H,Peter R E.Characterization of two forms of cocaine and amphetamine-regulated transcript(CART)peptide precursors in goldfish:Molecular cloning and distribution,modulation of expression by nutritional status,and interactions with leptin[J].Endocrinology,2001,142(12):5076-5088.
[11] Doyon C,Gilmour K M,Trudeau V L,et al.Corticotropinr eleasing factor and neuropeptide Y mRNA levels are elevated in the preoptic area of socially subordinate rainbow trout[J].General and Comparative Endocrinology,2003,133(2):260-271.
[12] Doyon Christian,Leclair Jason,Trudeau Vance L,et al.Corticotropin-releasing factor and neuropeptide Y mRNA levels are modified by glucocorticoids in rainbow trout,Oncorhynchus mykiss[J].General and Comparative Endocrinology,2006,146(2):126-135.
[13] Clark JT,Kalra PS,Crow ley W R,etal.Neuropeptide Y and human pancreatic polypeptide stimulate feeding behavior in rats[J].Endocrinology,1984,115(1):427-429.
[14] Boswell T,Dunn IC,Corr SA.Hypothalamic neuropeptide Y mRNA is increased after feed restriction in grow ing broilers[J].Poultry Science,1999,78(8):1203-1207.
[15] SchwippertW W,Ewert JP.Effect of neuropeptide-Y on tectal field potentials in the toad[J].Brain Research,1995,669(1):150-152.
[16] Silverstein Jeffrey T,Plisetskaya Erika M.The effects of NPY and insulin on food intake regulation in fish[J].American Zoologist,2000,40(2):296-308.
[17] Kah O,Pontet A,Danger JM,et al.Characterization,cerebral distribution and gonadotropin release activity of neuropeptide Y(NPY)in the goldfish[J].Fish Physiology and Biochemistry,1989,7(1-6):69-76.
[18] Breton B,M ikolajczyk T,Danger JM,et al.Neuropeptide Y(NPY)modulatesinvitrogonadotropin in release from rainbow trout pituitary glands[J].Fish Physiology and Biochemistry,1989,7(1-6):77-83.
[19] Peng C,Chang JP,Yu K L,et al.Neuropeptide-Y stimulates grow th hormone and gonadotropin-Ⅱ secretion in the goldfish pituitary:Involvement of both presynaptic and pituitary cellactions[J].Endocrinology,1993,132(4):1820-1829.
[20] Peng C,Humphries S,Peter R E,et al.Actions of goldfish neuropeptide Y on the secretion of grow th hormone and gonadotropin-Ⅱ in female goldfish[J].General and Comparative Endocrinology,1993,90(3):306-317.
[21] Silverstein JT,Breininger J,Baskin D G,et al.Neuropeptide Y-like gene expression in the salmon brain increases with fasting[J].General and Comparative Endocrinology,1998,110(2):157-165.
[22] López-Patiño M A,Guijarro A I,Isorna E,et al.Neuropeptide Y has a stimulatory action on feeding behavior in goldfish(Carassius auratus)[J].European Journal of Pharmacology,1999,377(2/3):147-153.
[23] MacDonald Erin,Volkoff Hélène.Cloning,distribution and effects of season and nutritional statuson the expression of neuropeptide Y(NPY),cocaine and amphetamine regulated transcript(CART)and cholecystokinin(CCK)in winter flounder(Pseudopleuronectes americanus)[J].Hormones and Behavior,2009,56(1):58-65.
[24] Kehoe Amy S,Volkoff Hélène.Cloning and characterization of neuropeptide Y(NPY)and cocaine and amphetamine regulated transcript(CART)in Atlantic cod(Gadusmorhua)[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2007,146(3):451-461.
[25] 雷霁霖,刘新富.大菱鲆(Scophthalmus maximusL.)引进养殖的初步研究[J].现代渔业信息,1995,10(11):1-3.
[26] 赵 玫,袁锦虹,李 嘉,等.针刺对实验性肥胖大鼠下丘脑摄食中枢的影响[J].中国针灸,2001,21(5):305-307.
[27] Bjenning C,Hazon N,Balasubramaniam A,et al.Distribution and activity of dogfish NPY and peptide YY in the cardiovascular system of the common dogfish[J].American Journal of Physiology.Regulatory,Integrative and Comparative Physiology,1993,264(6):R1119-R1124.
[28] Karila P,Messenger J,Holmgren S.Nitric oxide synthase-and neuropeptide Y-containing subpopulations of sympathetic neurons in the coeliac ganglion of the Atlantic cod,Gadus morhua,revealed by immunohisto chemistry and retrograde tracing from the stomach[J].Journal of the Autonomic Nervous System,1997,66(1/2):35-45.
[29] Gómez-Visus I,Garcı́a-Hernández M P,Lozano M T,et al.Glucagon-and NPY-related peptide-immunoreactive cells in the gut of sea bass(Dicentrarchus labraxL.):A light and electron microscopic study[J].General and Comparative Endocrinology,1998,112(1):26-37.
[30] 陈文波,王 鑫,周雅璐,等.尼罗罗非鱼Orexin前体基因的克隆、组织分布及其在摄食调控中的表达[J].动物学研究,2011,32(3):285-292.
[31] Volkoff H,Canosa L F,Unniappan S,etal.Neuropeptides and the control of food intake in fish[J].General and Comparative Endocrinology,2005,142(1/2):3-19.
[32] Unniappan S,Canosa L F,Peter R E,etal.Orexigenic actions of ghrelin in goldfish:Feeding-induced changes in brain and gutm RNA expression and serum levels,and responses to central and peripheral injections[J].Neuroendocrinology,2004,79(2):100-108.
[33] Volkoff Hélène,Peter Richard Ector.Effects of CART peptides on food consumption,feeding and associated behaviors in the goldfish,Carassius auratus:Actions on neuropeptide Y-and orexin A-induced feeding[J].Brain Research,2000,887(1):125-133.
[34] Arends R J,Vermeer H,Martens G J,et al.Cloning and expression of two proopiomelanocortin mRNAs in the common carp(Cyprinus carpioL.)[J].Molecular and Cellular Endocrinology,1998,143(1/2):23-31.
[35] Loh Y P,Gritsch H A,Chang T L.Pro-opiocortin processing in the pituitary:Amodel for neuropeptide biosynthesis[J].Peptides,1982,3(3):397-404.
