牙鲆连续三代减数分裂雌核发育家系的遗传特征分析
2014-01-02侯吉伦王桂兴张晓彦孙朝徽王玉芬姜秀凤刘海金
侯吉伦,李 超,王桂兴,张晓彦,孙朝徽,王玉芬,姜秀凤,刘海金
(1.中国水产科学研究院北戴河中心实验站,河北秦皇岛066100;2.上海海洋大学,上海201306;3.中国水产科学研究院,北京 100141)
1 前言
在一般情况下,硬骨鱼类排出体外的成熟卵子处于第二次减数分裂中期。鱼类的这种繁殖特征为鱼类的细胞工程育种,例如:多倍体诱导、雄核发育诱导以及雌核发育诱导。人工诱导雌核发育是一种快速固定母本性状、生产单性化苗种以及建立纯系的有效手段。根据原理的不同,人工诱导雌核发育又可进一步被分为减数分裂雌核发育(Meiogynogenesis)和有丝分裂雌核发育(M itogynogenesis)。减数分裂雌核发育比有丝分裂雌核发育更易操作,有更高的诱导率,目前已经成功地应用于上百种鱼类[1~3]。
牙鲆(Paralichthys olivaceus)是一种重要经济鱼类,雌性个体生长速度明显比雄性快。中国水产科学研究院北戴河中心实验站运用雌核发育诱导技术,选育的全雌牙鲆新品种“北鲆1号”和“北鲆2号”,具有雌性比例高、生长快、规格整齐、容易饲养等特点。关于牙鲆雌核发育的研究,已经有众多论文报导[4~6]。王桂兴等[7]采用微卫星技术,研究了牙鲆连续两代减数分裂雌核发育家系的遗传特征,结果显示,第二代减数分裂雌核发育家系的纯合度、个体间平均相似度以及亲子间的平均相似度要略高于第一代雌核发育家系,显著高于对照家系。
本研究在王桂兴等[7]技术的基础上,对性成熟的第二代雌核发育个体再度诱导减数分裂雌核发育,获得三个连续三代减数分裂雌核发育家系,并利用 30对微卫星引物分析了该三个家系的纯合度和遗传相似度,旨在探讨牙鲆连续多代雌核发育过程对等位基因纯合进程的影响,为牙鲆通过连续多代减数分裂雌核发育方法建立纯系以及优良品种选育提供相应的数据支持。
2 材料和方法
2.1 连续三代减数分裂雌核发育家系的构建
本实验在中国水产科学研究院北戴河中心实验站开展。2007年,以真鲷精子作为异源精子,经紫外线照射灭活,激活一尾雌性野生牙鲆所产卵子,并在激活后3m in,施以3℃,45m in的冷休克处理进行减数分裂雌核发育诱导,获得第一代减数分裂雌核发育家系(Meio-G1)。2009年,利用Meio-G1内发育成熟的一尾个体再度诱导减数分裂雌核发育,获得连续第二代减数分裂雌核发育家系(Meio-G2)。2014年,以Meio-G2家系内三尾性成熟个体进行减数分裂雌核发育诱导,获得了三个连续三代减数分裂雌核发育家系(Meio-G3-1、Meio-G3-2、Meio-G3-3)。
2.2 样品采集与基因组DNA提取
采集作为母本的三尾Meio-G2的腹面胸鳍和Meio-G3-1、Meio-G3-2、Meio-G3-3家系仔鱼各30尾,置于100%酒精中固定,-20℃保存。基因组DNA提取采用传统的酚-氯仿抽提法进行[7]。
2.3 微卫星引物
微卫星引物全部选自Coimbra等[8]绘制的牙鲆第二代遗传连锁图谱,根据刘永新等[9]的实验结果,选取重组率高、中、低的引物各10对,所选引物覆盖牙鲆24个连锁群。引物由上海生工生物工程技术服务有限公司合成。引物序列、退火温度、M-C距离和Genbank登录号见表1。
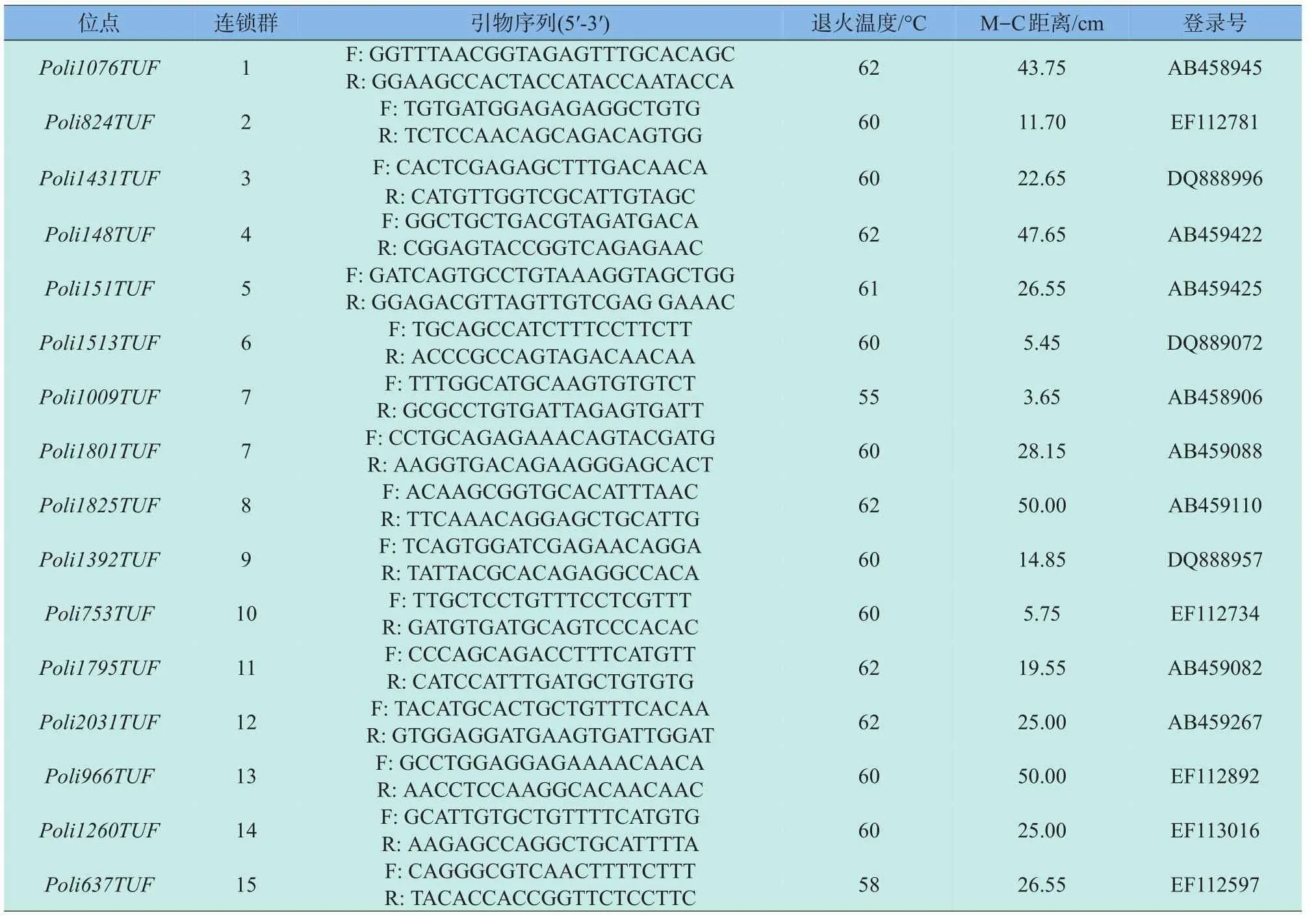
表1 30对微卫星标记位点引物序列、退火温度、M-C距离和Genbank登录号Table1 Primer sequences,annealing temperatures,M-C distance and accession number in Gen Bank of 30 microsatellite lociin the Paralichthys olivaceus
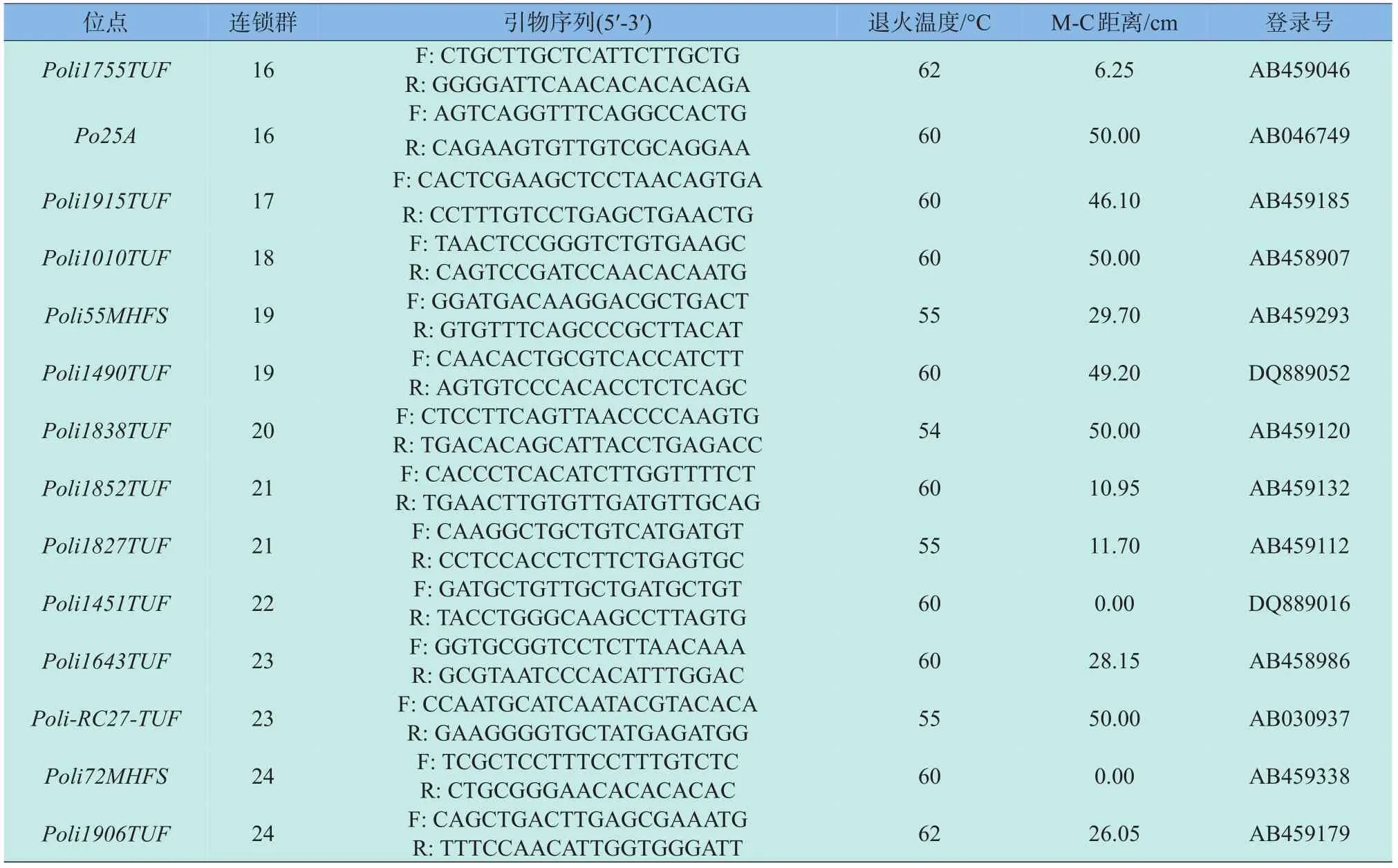
续表
2.4 聚合酶链式反应(PCR)扩增及电泳
PCR反应体系采用 15μL,包括:10×Buffer 2.5 μL、Mg2+(25 mmol/L)1 μL、dNTPs(2 mmol/L)1μL、上下游引物(10mmol/L)各0.6μL、DNA模板1 μL(40~50 ng)、Taq DNA 聚合酶 1 U,加适量ddH2O。反应程序为94℃预变性4m in;共25个循环包括94℃变性30 s,退火30 s,72℃延伸30 s;最后72℃延伸8m in,PCR扩增在PE9700型PCR仪上进行。PCR产物用8%非变性聚丙烯酰胺凝胶电泳,银染显色后用HPScanjetG4010扫描仪成像,用Gel-Pro Analyzer4.5凝胶分析软件对电泳图像进行数据采集和分析。
2.5 统计指标
等位基因数(number of alleles,A)、观测杂合度(Ho)、纯合度(homozygosity)、遗传相似系数(genetic similarity index,GSI)等遗传参数均由 popgene(ver.3.2)计算获得。重组率和近交系数由以下公式计算
重组率r=杂合子数/个体总数
近交系数

式(1)中,F为第i世代的近交系数;Gi为第i代雌核发育家系;r为微卫星位点的重组率。
3 结果与分析
3.1 PCR扩增及基因纯合度
本研究选用的30对微卫星引物在Meio-G3-1、Meio-G3-2、Meio-G3-3三个家系中均能扩增出稳定的PCR产物,所扩增到的等位基因数分别为35、38、37,平均等位基因数为1.17、1.27、1.23(见表2)。平均观测杂合度(Ho)分别为0.146 7、0.255 6、0.205 6,平均纯合度分别为0.853 3、0.744 4、0.794 4。t检验结果显示,Meio-G3-1、Meio-G3-2、Meio-G3-3三个家系间的平均观测杂合度和平均纯合度差异均不显著(P>0.05)。
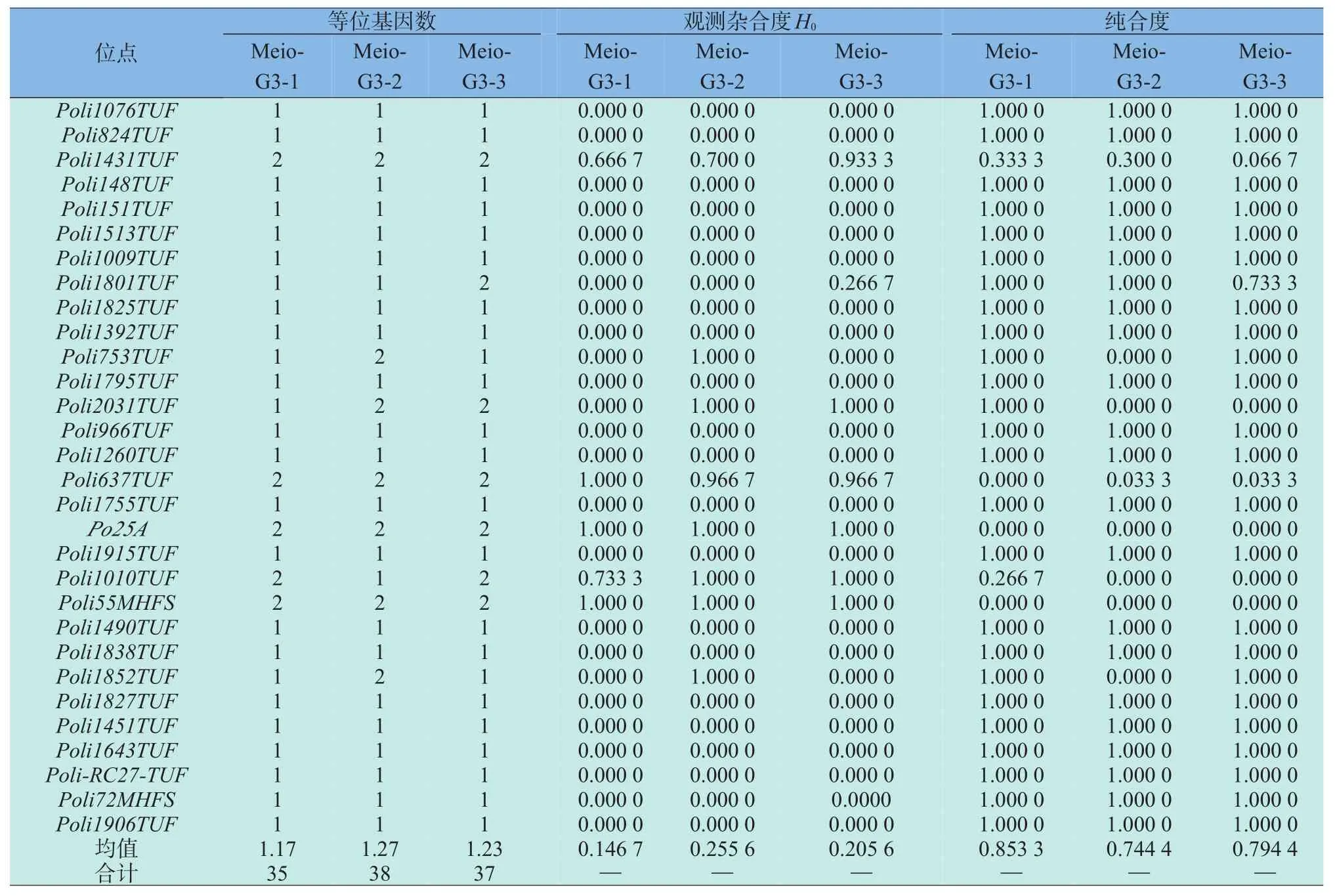
表2 30个微卫星座位上的等位基因数、观测杂合度及纯合度Table 2 Number of alleles,observed heterozy gosity and homo zygosity for the 30 microsatellite loci
3.2 连续三代减数分裂雌核发育家系内个体间的遗传相似度
根据所检测的30个微卫星位点的基因类型,分别计算了Meio-G3-1、Meio-G3-2、Meio-G3-3家系内个体间的遗传相似度(见表3)。结果表明,连续三代雌核发育家系内个体间平均遗传相似度在0.983 8~0.991 8,显示此群体已经是一个遗传一致性很高的品系。另外,各家系母本与子代之间的平均遗传相似度要高于子代之间的相似度。
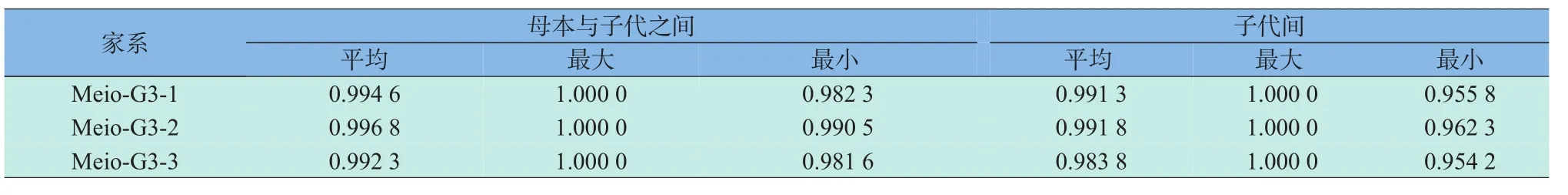
表3 连续三代减数分裂雌核发育家系内的遗传相似度Table3 Genetic similarity within family of the third successive meiogyno genetic generation
3.3 连续三代减数分裂雌核发育家系间的遗传相似度
根据30个微卫星位点的基因型数据,计算了Meio-G3-1、Meio-G3-2、Meio-G3-3三个家系间的遗传相似度(见表4)。三个家系间的遗传相似度在0.971 4~0.981 0,遗传距离在0.019 1~0.029 0。三个家系之间均表现出高度的遗传相似性。

表4 三个连续三代减数分裂雌核发育家系间的遗传相似系数和遗传距离Table 4 Genetic similarity and genetic distance among three third-generation of successive meiogynogenetic families in Japanese flounder Paralichthy solivaceus
3.4 不同微卫星位点的纯合效率和近交系数
在三个家系中,30个微卫星位点分别检测出5个、8个和7个多态性位点,多态性位点百分比为16.67、26.67、23.33,其余的各个位点,母本检测到的为单态,只有一个等位基因,子代在这些位点的纯合性和母本相同,完全纯合固定。近交系数是衡量微卫星位点纯合速率的一个指标,杂合位点在各家系的近交系数范围为0~0.7(Meio-G3-1)、0~0.66(Meio-G3-2)、0~0.98(Meio-G3-3)。不同杂合位点在不同家系表现出不同的纯合速率。比如,Poli1431TUF位点在Meio-G3-1和Meio-G3-2家系各观测到10个和9个纯合个体,而在Meio-G3-3家系中,只有两个个体在此位点为纯合;Poli1010TUF位点在Meio-G3-1家系中观测到8个纯合个体,而在Meio-G3-2和Meio-G3-3家系中却没有观测到纯合个体(见表5)。
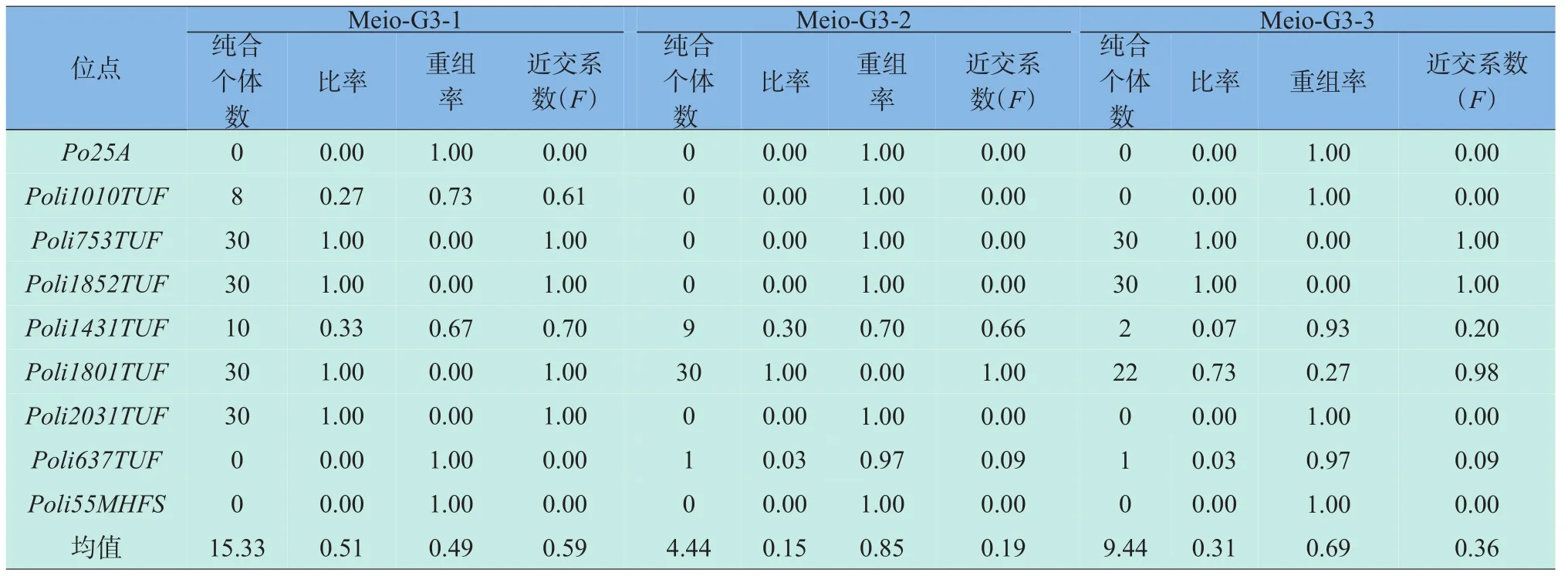
表5 部分微卫星位点上纯合个体数量、比率、重组率和近交系数Table5 Number of homo zygote,recombination frequency,coefficient of inbreeding(F)of some detected microsatellite lociin the third successive meiogynogenetic generation offspring Paralichthys olivaceus
4 结语
本研究首次报道了牙鲆三个连续三代减数分裂雌核发育家系的建立,并通过30对微卫星引物对这三个家系进行了遗传特征的研究。结果表明,家系内个体间和家系间都具有高度的遗传相似性。本研究中只选取一尾亲鱼的卵子,通过人工诱导减数分裂雌核发育,获得减数分裂雌核发育一代家系Meio-G1,再随机选取Meio-G1内一尾发育成熟雌性个体进行第二轮减数分裂雌核发育的诱导,获得第二代减数分裂雌核发育家系Meio-G2。待Meio-G2家系雌鱼性成熟时,再随机选取三尾分别进行第三轮减数分裂雌核发育的诱导,从而建立了三个连续三代减数分裂雌核发育家系。每一代都只选用单一母本分别进行减数分裂雌核发育的诱导,在最大程度上确保了遗传背景的一致性和等位基因代际纯化的最大化,从而获得遗传相似度高的家系。
遗传一致性高的动物品系对动物实验的可靠性以及可重复性具有重要意义。在生物学研究中,获得的实验结果包含了处理效应、所用生物的遗传变异、非遗传变异以及各因素之间的互作。一个好的实验设计是要控制和减少这些变异,从而让处理的信息更加清晰和可靠。获得具有高统计效力实验结果的最佳方法是利用不同近交系具有遗传异质性的少量个体进行实验[10]。在动物中,建立近交系最常用的方法为全同胞交配法,运用此方法,建立一个近交系需要至少20代[11]。迄今为止,运用全同胞交配法,已经建立了数百个啮齿类的近交系[12]。在斑马鱼上,一个连续16代的全同胞交配品系也已经被建立[13]。相比于传统的全同胞交配法,人工诱导减数分裂雌核发育法具有快速固定母本性状、提高等位基因纯合速率等优点。一般认为,一代雌核发育相当于8~10代的连续全同胞交配[14]。在牙鲆上,一代减数分裂雌核发育相当于9~10个世代的全同胞交配,连续第二代减数分裂相当于11~12代全同胞交配[7]。本研究中,三个家系内子代间的平均遗传相似度在0.981 3~0.991 8,家系间的平均遗传相似度0.971 4~0.981 0。团头鲂(Megalobrama amblycephala)连续三代减数分裂雌核发育家系内个体间的平均遗传相似度为0.984 5[15],本研究结果与之相近。通过诱导连续三代雌核发育所获得的个体,无论家系内,还是家系间,都具有高度的遗传相似性,接近或略高于连续20代全同胞交配所获得的理论结果(0.986)。因此,连续诱导多代减数分裂雌核发育能建立近交系,且比传统的全同胞交配法更节省时间。
由于减数分裂过程中,存在着等位基因的重组,而且由于不同等位基因在染色体上的位置不同造成重组率的差异,导致了纯合速率的差异,所以导致连续多代减数分裂雌核发育虽能一定程度加速等位基因纯化的进程,但很难获得所有位点全部纯合的个体。将连续多代减数分裂雌核发育个体再进行一次有丝分裂雌核发育的诱导,将能获得双单倍体纯合子。在牙鲆上,纯合度高的个体比纯合度低的个体具有更高的有丝分裂雌核发育诱导成功率。
综上所述,通过连续三代减数分裂雌核发育诱导所获得的牙鲆,具有高度的纯合性和遗传相似度,是进行牙鲆良种选育(quantitative trait locus)、QTL定位及其他遗传学研究的优质材料。
[1] Arai K.Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan[J].Aquaculture,2001,197:205-228.
[2] Peruzzi S,Chatain B.Pressure and cold shock induction of meiotic gynogenesis and triploidy in the European sea bass,Dicentrarchus labraxL.:Relative efficiency of methods and parental variability[J].Aquaculture,2000,189:23-37.
[3] You C,Yu X,Tan D,et al.Gynogenesis and sex determination in large-scale loachParamisgurnus dabryanus(Sauvage)[J].Aquaculture International,2008,16:203-214.
[4] Yamamoto E.Studies on sex-manipulation and production of cloned populations in Hirame flounder,Paralichthys olivaceus(Temminck et Schlegel)[J].Bulletin of Tottori Prefecture Fishery Experiment Station,1995,34:1-145.
[5] 刘海金,侯吉伦,常玉梅,等.真鲷精子诱导牙鲆减数分裂雌核发育[J].水产学报,2010,34(4):508-514.
[6] Tabata K,Gorie S,Nakamura K.Studies on the gynogenesis in hirameParalichthys olivaceus.II induction of gynogenetic diploid in hirameParalichthys olivaceus[J].Nippon Suisan Gakkaishi,1986,52(11):1901-1904.
[7] 王桂兴,刘海金,张晓彦,等.牙鲆连续两代减数分裂雌核发育家系的遗传特征[J].中国水产科学,2012,19(3):381-389.
[8] Coimbra M R,KobayashiK,Koretsugu S,etal.AGenetic linkage map of the Japanese flounder,Paralichthys olivaceus[J].Aquaculture,2003,220(1-4):203-218.
[9] 刘永新,朱以美,刘英杰,等.牙鲆渤海自然群体的遗传多样性分析[J].水产学报,2013,37(11):1609-1617.
[10] Festing M FW.The Design and statistical analysis of animal experiments[J].ILAR Journal,2002,43(4):191-193.
[11] Casellas J.Inbred mouse strains and genetic stability:A review[J].Animal,2011,5(1):1-7.
[12] Grimholt U,Johansen R,Sm ith A.A review of the need and possible uses for genetically standardized Atlantic salmon(Salmo salar)in research[J].Laboratory Animals,2009,43(2):121-126.
[13] Shinya M,Sakai N.Generation of highly homogeneous strains of zebrafish through full sib-pair mating[J].G3(Bethesda),2011,1(5):377-386.
[14] 刘静霞,周 莉,赵振山,等.锦鲤4个人工雌核发育家系的微卫星标记研究[J].动物学研究,2002,23(2):97-105.
[15] 唐守杰,李思发,蔡完其.团头鲂连续三代减数分裂雌核发育群体遗传变异的微卫星分析[J].淡水渔业,2014,44(2):3-8.
