乙型肝炎病毒X蛋白升高细胞内钙离子机制研究*
2014-01-01何生松刘亚男姚景宏
王 君, 何生松, 刘亚男, 张 盼, 姚景宏
华中科技大学同济医学院附属协和医院感染科,武汉430022
原发性肝细胞性肝癌(HCC)是最常见的原发恶性肿瘤之一,死亡率极高,其中乙型肝炎病毒(HBV)慢性感染是其主要致病因素[1-3]。在 HBV引发的HCC中,HBV的病毒表达产物乙型肝炎病毒x(HBx)蛋白起着重要的作用[4]。HBx蛋白作为细胞的反式激活因子可以调节很多细胞信号传导通路,可以调节细胞质Ca2+离子浓度,其与细胞的增殖有关[5-6]。肝细胞作为非兴奋性细胞,不表达电压依从性钙通道(voltageoperated calcium channels,VOCs),Ca2+通透性受体调节通道(ROCs)和通透性钙池调节离子通道(SOCs)是调控其细胞内钙离子浓度[Ca2+]i的主要通道。现已证实,SOCs在维持由激素诱导的原代肝细胞钙振荡中发挥重要作用[7]。目前认为 ROCs引起的[Ca2+]i升高是一个瞬时变化,不足以维持细胞的长期反应,SOCs则可持续升高[Ca2+]i,而[Ca2+]i持续升高是胞内多种激酶激活的必要条件[8]。SOCs被内质网内腔Ca2+浓度降低激活而开放,生理作用在于补充内质网的Ca2+而避免钙库Ca2+耗竭。间质相互作用因子1(stromal interaction molecule 1,STIM1)及钙释放激活钙通道蛋白1(calcium release-activated calcium channel protein 1,Orial)是目前已确定的肝细胞SOCs组成蛋白[9],STIM1为内质网Ca2+浓度感受器,Orail是SOCs在细胞膜上的孔蛋白。目前HBx蛋白如何调节细胞内钙离子机制不清,本研究从HBx蛋白与SOCs相关蛋白着手,探讨HBx蛋白调节细胞内钙离子的具体机制。
1 材料与方法
1.1 材料
HEK293(ATCC中心,Manassas,USA);携带HBx全 长 基 因 的 pcDNA-Flag-HBx 质 粒、携 带Orai1全长基因的pcDNA-HA-Orai1质粒、携带STIM1全长基因的pcDNA-HA-STIM1质粒(从NIH神经实验室Prof.Lutz Birnbaumer处获得);Fura-2/AM、Lipofectamine 2000(Invitrogen公司);细胞培养液 DMEM、HBSS、PBS、胎牛血清、BSA(Gibco公司);蛋白质 Marker(晶美生物有限公司);胰蛋白酶、鼠单克隆HBx抗体、鼠单克隆HA抗体、鼠单克隆myc抗体、羊抗鼠多克隆抗体(Sigma公司);ECL显色试剂盒(默克公司);毒胡萝卜素(thapsigargin,Calbiochem公司);谷胱甘肽巯基转移酶琼脂糖珠 (GST-Beads,Amersham Biosciences公司);倒置相差显微镜(日本OLYMPUS公司)。
1.2 方法
1.2.1 细胞培养 HEK293细胞用含10%胎牛血清和1% 青霉素-链霉素的高糖DMEM培养液,并置于37℃、5%CO2培养箱内,待细胞贴壁生长达80%~90%融合度时,预热的PBS清洗细胞;预热的胰蛋白酶消化细胞,加3mL DMEM 培养液(含10%FBS)以终止消化反应,并将细胞悬液转移入10 mL离心管中;1 000r/min,离心5min,去除上清;加入10mL DMEM 培养液(含10%FBS),重新悬浮细胞,使细胞充分打散;进行细胞计数,根据细胞计数结果,将适当数量的细胞悬液转至6孔培养板中(细胞密度6×104个/mL);置于37℃、5%CO2的培养箱中培养。
1.2.2 细胞转染 当细胞生长状态良好且贴壁细胞密度达到70%~80%时进行转染;在Lipofectamine 2000介导下,将pcDNA-Flag-HBx、pcDNA-HA-Orai1、pcDNA-HA-STIM1及空载质粒各2.5μg转染或共转染 HEK293细胞,置于37℃、5%CO2的培养箱孵育5h后去除含脂质体复合物的培养液,加入2mL含10%血清的DMEM培养液,置于37℃、5%CO2的培养箱中培养48h。
1.2.3 co-IP实验 转染HEK293细胞48h后,吸走培养孔中培养液,用PBS洗涤2次,加入预冷的细胞裂解液(含cocktail蛋白酶抑制剂)1mL,细胞刮收集细胞;超声裂解细胞;4℃,8 000r/min,离心15min,取上清。取30μL含有Flag蛋白的琼脂糖珠(Flag-beeds)或 HA 蛋白的琼脂糖珠(HA-beeds),用预冷的 RIPA 缓冲液洗3遍,12 000r/min,离心1min,并用RIPA缓冲液配制成1∶1琼脂糖珠悬浮液。将琼脂糖珠悬浮液加入到已收集的细胞裂解液中,4℃层析柜旋转孵育4h。在4°C,以12 000r/min,离心3min,将琼脂糖珠悬浮液离心至管底;将上清小心吸去,琼脂糖珠悬浮液用预冷的RIPA缓冲液洗3遍,800μL/遍;最后加入35μL 2×SDS上样缓冲液,将上样样品水浴95℃,5min,蛋白变性。取适量表达蛋白样品上样后,用10%的SDS-PAGE电泳分离,然后转印于PVDF膜上,用含5%的脱脂奶粉TBST室温封闭蛋白印迹膜l h,加入一抗即鼠单克隆HA抗体或Flag抗体,4℃孵育过夜。用TBST振摇洗涤3次,10min/次,加入二抗即羊抗鼠IgG,室温孵育2h,接着用TBST振摇洗涤3次,10min/次,用ECL显色,暗室胶片曝光显影。
1.2.4 GST pull-down实验 将编码蛋白 Orai1及Orai1C末端(257~301aa)与GST的重组质粒GST-Orai1及GST-CT转化到BL21(DE3)菌株(本实验室已制备)。分别挑取单个克隆到含有5mL LB(+100μg/mL Amp)的10mL细菌培养管中,37℃培养过夜。将培养菌液转移到含有500mL LB(+100μg/mL Amp)的1L锥形瓶中,37℃,225r/min培养至A600达0.6~0.8左右,加入终浓度1 mmol/L的IPTG,30℃,225r/min诱导3h;8 000 r/min,5min 4℃离心收集细菌,去尽上清,置于冰上,每500mL培养液加入10mL细菌裂解液(PBS+1%Triton-100+PMSF),吹打混匀。冰上超声破碎,开4s,停6s,总30min,至裂解液充分清亮。4℃,12 000r/min,离心15min,取上清,-80℃保存备用。将pcDNA-myc-HBx质粒转染 HEK293细胞。转染48h后,收集细胞,提取目的蛋白。同时分别取500μL融合蛋白GST-Orai1及GST-CT冰上冻融;分别取2管 GST-Beads(Immobilized Glutathione)到EP管中,50μL/管,用800μL PBS+1%Triton-100润洗3次,分别将冻融融合蛋白GST-Orai1及GST-CT与之混匀,4℃层析柜旋转结合1h。PBS+1%Triton-100洗3次;用10%BSA封闭30min,再用PBS+1%Triton-100洗2次。取50μL已纯化myc-HBx蛋白裂解液,加入50μL 2×SDS上样缓冲液,水浴95℃,5min,蛋白变性。其余myc-HBx蛋白裂解液样品加入到预处理过的GST-Beads的EP管中,4℃层析柜旋转结合3h;用PBS+1%Triton-100洗3次。用30μL 2×SDS上样缓冲液溶解beads上的蛋白,水浴55℃,10min,蛋白变性。高速离心,取适量表达蛋白样品上样后,用12%的SDS-PAGE电泳分离,然后转印于PVDF膜上,用含5%的脱脂奶粉TBST室温封闭蛋白印迹膜l h,加入一抗即鼠单克隆myc抗体,4℃孵育过夜,用TBST振摇洗涤3次,10min/次,加入二抗即羊抗鼠IgG,室温孵育2h,接着用TBST振摇洗涤3次,10min/次,用ECL显色,暗室胶片曝光显影。
1.2.5 细胞内钙离子检测 取已预先放入细胞爬片的6孔板,接种HEK293细胞悬液2mL(细胞密度6×104个/mL),置于37℃、5%CO2细胞培养箱培养,待细胞贴壁生长达80%时,分别用pcDNAGFP-HBx,pcDNA-HA-Orai1,pcDNA-GFP-EV,pcDNA-HA-STIM1质粒共转染 HEK293细胞。转染48h后,吸走培养液,用PBS轻柔地洗涤1次,加入含2μmol/L Fura-2/AM 的细胞培养液1mL,37℃避光孵育25min,让荧光染料充分进入细胞;随后取出细胞爬片,固定在灌流槽上,室温下,用无钙HBSS洗3次;将灌流槽放置在钙离子测量/成像系统的倒置显微镜载物台上,分别用波长为340nm和380nm的单色光去激发染色后的细胞使之发出荧光,选择细胞区域后,每次选择25~30个细胞,用电荷耦合器件(CCD)采集荧光强度和荧光图像,F340/F380荧光比值代表细胞内钙离子的浓度变化。起始用微量进样器小心加入含有EGTA的HBSS,观察它对所测细胞内荧光强度的影响;200s后,加入含有2μmol/L毒胡萝卜素的HBSS,使钙库钙离子耗竭;然后加入含2mmol/L Ca2+的 HBSS,诱导钙池操控的钙内流(SOCE)。
1.3 统计学分析
采用SPSS 12.0统计软件处理数据,测定结果以均数±标准差(±s)表示,两组数据间均数比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养与转染
细胞培养状态良好,转染后的细胞状态良好,使用激光共聚焦显微镜观察转染率为30%~40%(图1)。
2.2 co-IP实验
结果显示实验组细胞内HA标记的Orai1蛋白可以与Flag标记的HBx蛋白免疫共沉淀,而对照组不发生免疫共沉淀(图2)。表明HBx蛋白可以与细胞膜钙离子通道Oria1蛋白结合,产生相互作用。

图1 激光共聚焦显微镜观察HEK293细胞转染情况Fig.1 Laser confocal microscopy of transfection of HBx gene into HEK293cells

图2 co-IP实验验证在细胞内HBx蛋白与Orai1蛋白结合情况Fig.2 co-IP assay demonstrating the intracellular interation between HBx protein and Orai1
2.3 GST pull-down实验
为进一步确定HBx蛋白与细胞膜钙离子通道Oria1结合蛋白相互作用的具体部位,收集蛋白进行 GST pull-down实验,结果显示 Orai1-CT 末端(257~301aa)可以特异性地和 HBx蛋白结合,Orai1-NT(1~71aa)末端及 Orai1-loop结构域(141~173aa)不与HBx蛋白结合,对照组无结合,见图3。

图3 GST pull-down实验检测HBx蛋白与Orai1蛋白相互作用部位Fig.3 GST pull-down assay of the interacting domain between Orai1and HBx proteins
2.4 细胞内钙离子检测
为明确HBx蛋白与Orai1结合后对SOCE影响,共转染 pcDNA-GFP-HBx,pcDNA-HA-Orai1,pcDNA-GFP-EV,pcDNA-HA-STIM1 质 粒 到HEK293细胞。转染后的细胞加入荧光探针Fura-2/AM后使用毒胡萝卜素耗竭存储在细胞内的钙离子,然后加入Ca2+,诱导SOCE。结果显示转染HBx的细胞与转染空载质粒的对照组相比较,Fura-2/AM 荧光比率 F340/F380高于对照组,表明HBx可增加细胞钙内流,转染 HBx+Orai1+STIM1的细胞与转染Orai1+STIM1或者HBx的细胞相比F340/F380比率增高更明显,细胞钙内流更加明显(图4),SOCE产生后,在700s时间点左右,细胞内钙离子浓度最高,表达HBx+ Orai1+STIM1的细胞与Orai1+STIM1过表达的细胞相比较,可显著增加细胞内钙离子浓度(P<0.01)。
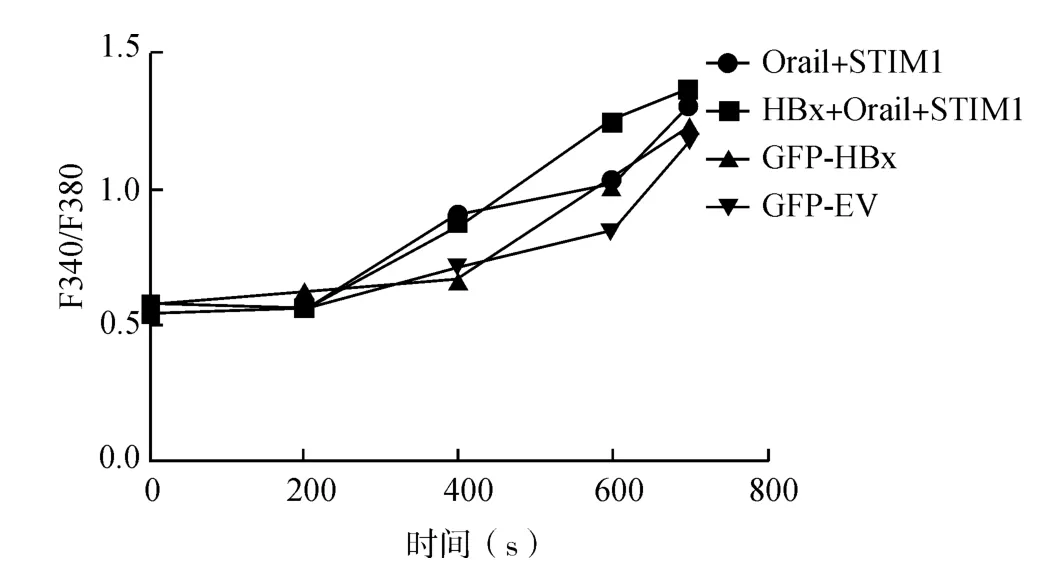
图4 细胞内钙离子检测证实HBx蛋白可增加细胞钙内流Fig.4 Single-cell calcium measurement revealed that HBx protein could increase the intracellular calcium
3 讨论
HBV感染在我国是HCC的最主要致病原因,绝大部分HCC患者合并有HBV感染[2]。HBx基因编码的HBx蛋白具有强大的恶性转化能力,可以诱导HCC的发生,并增加其恶性表型,导致肿瘤的预后不良[10-11]。我们注意到,HBx无论是在促进HBV复制,还是在诱导肝细胞恶性转化过程中,常需要首先激活钙离子信号,引起细胞内钙信号失稳。已研究证实,HBx通过升高细胞内钙离子浓度激活PyK2和FAK激酶是 HBV复制的必要条件[6,12]。HBx在升高[Ca2+]i同时激活细胞JNK和 MAPK信号途径,并促进细胞增殖[13]。因此,钙信号在HBx发挥功能中起重要作用。
钙离子是重要的细胞内第二信使,参与细胞的多种生理病理过程[14]。肝细胞在生理浓度的激素作用下可引起[Ca2+]i持续升高或振荡[7],在生理状态下,钙离子信号调节肝细胞的多种生理功能。[Ca2+]i升高需要细胞外钙离子内流,SOCs是肝细胞等非兴奋性细胞钙离子内流的主要通道[15-16]。当内质网钙池中的钙离子释放后,既可激活细胞膜上的SOCs,引起钙内流。胞膜蛋白Orai1和内质网膜蛋白STIM1是与SOCs密切相关的蛋白,其中Orai1蛋白是33kD的膜蛋白,又称为CRACM1(calcium-release-activated calcium modulator 1)。基因敲除Orai1能显著降低细胞钙池操控的钙离子内流(SOCE)或钙离子释放激活的钙电流(ICRAC)[17]。当内质网内的Ca2+释放后,内质网上的STIM1与胞膜上的Orai1相互作用,形成四聚体,在胞膜上形成高选择性孔道引起钙内流,即SOCE或ICRAC[18]。Orai1激活引起的钙内流持续时间长,振幅大,可激活转录因子AP-1、CREB及NFAT等参与细胞活化、增殖、迁移等。
目前关于HBx蛋白调节细胞内钙离子平衡的机制有线粒体方面的报道,Gearhart等[19]研究发现HBx通过开放或者关闭线粒体通透性转换孔(MPTP)而增加细胞内的钙内流。但是内质网是细胞内重要的钙离子存储库,目前还无HBx蛋白与内质网及钙离子关系的报道,本研究采用co-IP实验,从细胞内研究HBx蛋白与SOCs相关蛋白的关系,结果显示细胞内HBx蛋白可以与Orai1蛋白相互作用。使用GST pull-down实验明确HBx蛋白与Orai1蛋白结合的具体部位,结果显示HBx蛋白可以与Orai1的C末端(257~301aa)结合,进一步确定了HBx蛋白与Orai1蛋白作用的具体部位。细胞内钙离子检测结果显示Orai1+STIM1+HBx过表达细胞,钙离子增加最明显,证实HBx蛋白通过与Orai1蛋白结合从而增加细胞内钙内流,当细胞内钙离子被耗竭时,细胞内Orai1过表达,细胞内钙内流增加更加明显。因此,我们可以推测,HBx蛋白可以通过与Orai1蛋白的C末端结合,扰乱细胞内[Ca2+]i的稳态,影响其细胞周期,导致肝细胞异常增殖,可能参与肝细胞恶性转化过程。此研究与前期研究结果有所不同,Gearhart等[19]是从线粒体方面揭示HBx蛋白干扰细胞内钙离子平衡机制,而本研究从SOCs相关蛋白着手,探讨HBx蛋白调节细胞内钙离子平衡具体机制,从分子水平揭示HBV感染导致HCC的机制,该研究结果将为HCC的防治提供理论基础。本研究针对HBx蛋白的功能,探讨其诱发肝细胞恶性转化的新机制,为开展肝癌的防治提供新的实验依据。
[1] Liu B,Wen X,Huang C.Unraveling the complexity of hepatitis B virus:From molecular understanding to therapeutic strategy in 50years[J].Int J Biochem Cell Biol,2013,45(9):1987-1996.
[2] Samal J,Kandpal M,Vivekanandan P.Molecular mechanisms underlying occult hepatitis B virus infection[J].Clin Microbiol Rev,2012,25(1):142-163.
[3] Azam F,Koulaouzidis A.Hepatitis B virus and hepatocarcinogenesis[J].Ann Hepatol,2008,7(2):125-129.
[4] Wang Q,Zhang W,Liu Q,et al.A mutant hepatitis B virus x protein(HBxDelta127)promotes cell growth through a positive feedback loop involving 5-lipo-oxygenase and fatty acid synthase[J].Neoplasia,2010,12(2):103-115.
[5] Gearhart T L,Bouchard M J.The hepatitis B virus X protein modulates hepatocyte proliferation pathways to stimulate vi-ral replication[J].J Virol,2010,84(6):2675-2686.
[6] Bouchard M J,Wang L H,Schneider R J.Calcium signaling by HBx protein in hepatitis B virus DNA replication[J].Science,2001,294(5550):2376-2378.
[7] Jones B F,Boyles R R,Hwang S Y,et al.Calcium influx mechanisms underlying calcium oscillations in rat hepatocytes[J].Hepatology,2008,48(4):1273-1281.
[8] El Boustany C,Bidaux G,Enfissi A,et al.Capacitative calcium entry and transient receptor potential canonical 6expression control human hepatoma cell proliferation[J].Hepatology,2008,47(6):2068-2077.
[9] Hoover P J,Lewis R S.Stoichiometric requirements for trapping and gating of Ca2+release-activated Ca2+(CRAC)channels by stromal interaction molecule 1(STIM1)[J].Proc Natl Acad Sci USA,2011,108(32):132299-132304.
[10] Kew M C.Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma[J].Gastroenterol Hepatol,2011,26(Suppl 1):144-152.
[11] Miao J,Chen G G,Chun S Y,et al.Hepatitis B virus x protein induces apoptosis in hepatoma cells through inhibiting Bcl-xL expression[J].Cancer Lett,2006,236(1):115-124.
[12] Bouchard M J,Wang L H,Schneider R J.Activation of focal adhesion kinase by hepatitis B virus HBx protein:Multiple functions in viral replication[J].J Virol,2006,80(9):4406-4414.
[13] Oh J C,Jeong D L,Kim I K,et al.Activation of calcium signaling by hepatitis B virus-X protein in liver cells[J].Exp Mol Med,2003,35(4):301-309.
[14] 张驰,张宗明 .钙池操纵的Ca2+通道的激活机制研究进展[J].世界华人消化杂志,2007,15(17):1873-1880.
[15] 张驰,张宗明.钙池操纵的Ca通道研究中工具药的应用及进展[J].世界华人消化杂志,2005,13(2):231-234.
[16] 黄邵洪,荣健,王淑云,等 .大鼠在体心肌缺血再灌注损伤组织间液钙离子动态与胞膜钠钙交换体表达[J].华中科技大学学报:医学版,2012,41(1):76-79,98.
[17] Gwack Y,Srikanth S,Oh-Hora M,et al.Hair loss and defective T-and B-cells in mice lacking ORAI1[J].Mol Cell Biol,2008,28(17):5209-5222.
[18] Lewis R S.The molecular choreography of a store-operated calcium channel[J].Nature,2007,446(7133):284-287
[19] Gearhart T L,Bouchard M J.Replication of the hepatitis B virus requires a calcium-dependent HBx-induced G1phase arrest of hepatocytes[J].Virology,2010,407(1):14-25.
