大鼠脑积水及其分流模型建立
2013-12-26吴春明曲振运董安石张宏伟许友松李伟华
吴春明,曲振运,董安石,李 岩,张宏伟,许友松,李伟华,王 建,李 涛
(1.大连医科大学 附属第一医院 神经外科, 辽宁 大连 116011; 2.大连医科大学 病理生理学教研室,辽宁 大连 116044)
基础医学
大鼠脑积水及其分流模型建立
吴春明>1,曲振运>2,董安石>1,李 岩>1,张宏伟>1,许友松>1,李伟华>1,王 建>1,李 涛>1
(1.大连医科大学 附属第一医院 神经外科, 辽宁 大连 116011; 2.大连医科大学 病理生理学教研室,辽宁 大连 116044)
目的建立大鼠脑积水及脑积水分流模型。方法雄性Wistar大鼠80只,随机分为实验组和对照组各40只,实验组大鼠应用显微外科技术,在显微镜下向枕大池中注射250 mg/mL高岭土混悬液0.05 mL,对照组用同样方法向枕大池注入生理盐水0.05 mL,34只完成脑积水模型的实验组大鼠,再根据观察时间随机分成A(3d)、B(1周)、C(3周)、D(3周脑积水模型分流术后3 d)、E(3周脑积水模型分流术后1周)组,35只完成脑积水对照组大鼠,随机再根据观察时间分为A1(3d)、B1(1周)、C1(3周)、D1(3周脑积水模型分流术后3 d)、E1(3周脑积水模型分流术后1周)组。D、E组在显微镜下分别行侧脑室-皮下分流术, D1、E1组大鼠用和D、E组大鼠相同的方法,只是不放置分流管,通过脑室病理切片, MR观察脑室系统的变化。结果实验组大鼠脑室随着时间的延长而逐渐扩大,脑积水症状逐渐加重,分流后脑室随着时间的延长而逐渐缩小,症状得到改善。脑织织切片脑室指数测定:A组为0.165±0.076,B组0.293±0.096,C组0.487±0.133;对照组各亚组各对应时间点差异无显著性意义(P>0.05),平均为0.029±0.010。A、B、C组和A1、B1、C1组比较均P<0.001,A、B、C组间比较P<0.05。D组侧脑室指数0.322±0.054,E组0.031±0.012,分别与D1、E1组比较,D、E组间比较均P<0.001。结论高岭土枕大池注射法制作的大鼠交通性脑积水模型及脑积水脑室-皮下分流术模型,适用于脑积水发病机理及分流术后脑组织病理改变的实验研究,对脑积水病理机制和治疗方法研究有意义。
大鼠;脑积水;分流;模型
脑积水发病率较高,近年脑室-腹腔分流术已经成为脑积水首选的治疗方法之一,治疗效果有时欠佳,其病理机制不十分清楚,由于脑积水模型尤其是分流模型制作困难,一定程度上制约了脑积水病理改变机制的研究,本研究组在参考文献的基础上,成功制作大鼠脑积水及其分流模型,并取得了较高成功率,报道如下。
1 材料和方法
1.1 实验动物分组
80只雄性Wistar大鼠(体重200~250 g,由大连医科大学实验动物中心提供)用随机化表法随机分为实验组(脑积水模型)和对照组各40只,实验组34只,对照组35只完成脑积水模型制作实验。将成功制作脑积水模型实验组34只大鼠,再根据观察时间随机分成A组(3 d)6只,B组(1周)6只,C组(3周)6只,D 组(3周脑积水模型分流术后3 d)8只,E组(3周脑积水模型分流术后1周)8只。将完成脑积水模型实验对照组35只大鼠,随机再根据观察时间分为A1(3 d)、B1(1周)、C1(3周)、D1(3周脑积水模型分流术后3 d)、E1(3周脑积水模型分流术后1周)组,各7只。
1.2 脑积水模型制作
实验组大鼠经10%水合氯醛(28 mg/100 g)腹腔注射麻醉成功后,头颈背部备皮,消毒。俯卧位固定于前端有一30°角斜坡长方形木板,头置于斜坡上,充分暴露头颈交界处,于交界处纵行切一长约1 cm切口,在手术显微镜下钝性分离颈部肌肉,暴露寰枕筋膜,医用 0.45 mm头皮针穿刺寰枕筋膜,出现落空感后立即停止进针,缓缓抽出无色澄清脑脊液0.05 mL后,向枕大池内缓慢均匀注射250 mg/mL高岭土混悬液0.05 mL,注射过程不少于3 min,注射后留针2 min,拔针后立即用医用耳脑胶封闭针眼,头皮钉夹闭切口,维持头低位15~20 min,对照组用同样方法向枕大池注入生理盐水0.05 mL,麻醉清醒后将大鼠放回笼中,每个笼中放2只大鼠,维持室温在23~25 ℃,次日给予充足的水和鼠粮,术后连续应用头孢唑啉钠(50 mg/kg)腹腔注射抗炎5 d。
1.3 脑积水分流模型制作
用内径1.0 mm,外径1.6 mm的聚四氟乙烯管,近端通过加热形成90°角后,通过注射器向管内注射生理盐水,证实通畅后,储存在70%酒精溶液中,作为侧脑室-皮下分流管备用。
D、E组大鼠,10%水合氯醛(28 mg/100 g)腹腔注射麻醉成功后,头颈背部备皮,消毒,用尖刃刀沿头部中线切开,在手术显微镜下以矢状缝旁2 mm冠状缝前2 mm点为中心,在手术显微镜下,将右侧颅骨钻一个直径约为2 mm的小圆洞,用21G头皮针直接穿刺硬脑膜后,将事先制备好的脑室-皮下分流管的脑室端经皮质穿刺侧脑室约4~5 mm深(从颅骨表面计算),见分流管内有脑脊液流出,用牙科丙烯酸粘固剂固定在颅骨上,远端连接一个硅胶管,保持通畅埋在颈部皮下,使脑脊液自由地排出到皮下,头皮钉夹闭切口,麻醉清醒后将大鼠放回笼中,每个笼中放2只大鼠,维持室温在23~25 ℃,次日给予充足的水和鼠粮。D组6只,E组7只完成分流实验。D1、E1组大鼠用和D、E组大鼠相同的麻醉和手术方法处理,只是不放置分流管,D1、E1组7只均完成实验。手术后所有参加实验的大鼠,再次连续应用头孢唑啉钠(50 mg/kg)腹腔注射5 d。
1.4 MRI脑室系统检测
应用常规颅脑磁共振(GE:Signa MRI 3.0Tesla)扫描检测。用10%水合氯醛(28 mg/100 g)腹腔注射将大鼠麻醉,将医用膝线圈置于大鼠头部,行冠状位的磁共振扫描。扫描条件:T1 FLAIR扫描:采用SE序列参数:TR:2700,TE:72,FOV:90×90,NEX:1,带宽:130,矩阵:320×256,层厚:2 mm。T2WI:扫描:采用TSE序列: TR:6000,TE:120,FOV:90×90,NEX:1,带宽:31.25,矩阵:384×384,层厚:2 mm。各组各时间点大鼠MRI检查,观察大鼠脑室系统变化。
1.5 脑组织病理标本制备
将实验组和对照组各时间点大鼠用10%水合氯醛(28 mg/100 g)经腹腔注射深麻醉后,经心脏灌注肝素化生理盐水10 min然后用4%多聚甲醛固定后过夜,用冰冻切片机将冠状缝后0.5 mm 冠状切片,包括脑室周围区,切片厚度10 μm,HE染色,4倍显微镜下观察,测量脑室。在相同的光强度和放大倍数条件下,取鼠脑冠状切面第三脑室平面测脑室大小,测量侧脑室指数,计算脑组织切片的Evan's 比率(侧脑室最大横径/同一层面脑组织最大横径)作为评价脑室大小的指标。
1.6 统计学方法
所得数据用均数±标准差表示, SPSS软件进行统计处理,比较采用t检验的双总体检验。
2 结 果
2.1 脑积水和脑积水分流模型成功率
40只雄性Wistar大鼠用于脑积水模型制作,34只完成脑积水造模实验,1只死于麻醉,5只死于手术创伤,脑积水模型成功率85%。D、E组分别行侧脑室-皮下分流术,D组7只,E组6只完成分流实验全过程,脑积水分流手术成功率81%,D组手术创伤致1只大鼠死亡,E组手术创伤致2只大鼠死亡,其中1只大鼠术前脑积水反应重,状态差,术后第2天死亡。
2.2 脑积水及分流术后的大鼠症状
脑积水造模术大鼠45 min左右清醒,与平时无异常。3 d后出现活动减少,目光呆滞无神,反应迟钝;1周开始出现行动迟缓、走路不稳;3周出现嗜睡状态,双眼球突出明显,双眼球周围可见红黑色分泌物,弓背、 背部毛竖起,饮食,饮水量均减少。脑积水3周行脑积水分流术大鼠,分流后3 d,大鼠意识状态由嗜睡变清醒,仍目光呆滞,走路不稳明显改善,饮食,饮水量增加,眼周少量分泌物;分流1周大鼠,意识、活动次数、走路形态、 饮食、饮水等与对应点对照组大鼠无明显差别。
2.3 MRI检测脑室形态变化
MRI脑室形态学变化,对照组各亚组大鼠侧脑室、三脑室均呈裂隙状或基本不可见,脑组织亦无水肿;实验组大鼠均有不同程度的脑室扩张,术后3 d、1周、3周,随着时间推移,脑室系统进行性扩大,大脑皮层受压变薄。脑积水3周行脑积水分流术大鼠,术后3 d、1周,随着时间推移,脑室系统逐渐回缩,分流术后1周,脑室系统恢复呈裂隙状或基本不可见,脑皮层有所增厚。见图1和2。对照组各组大鼠各对应时间点表现差异无显著性意义。见图3。
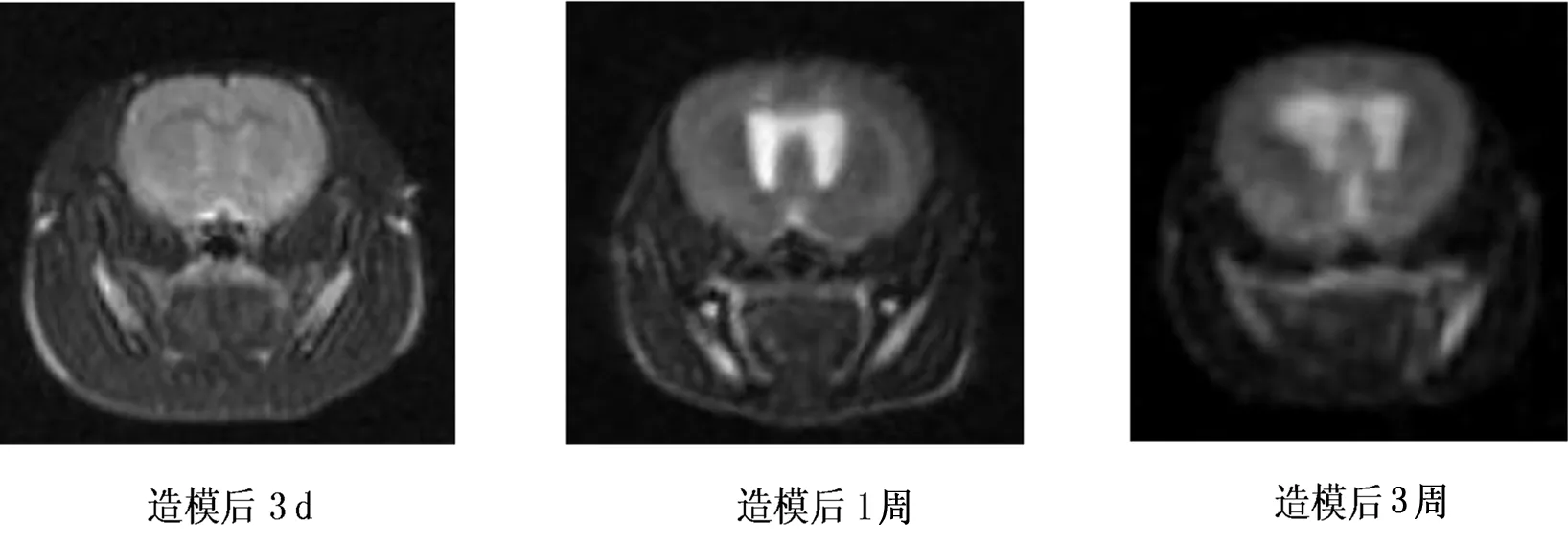
图1 造模后MRI表现
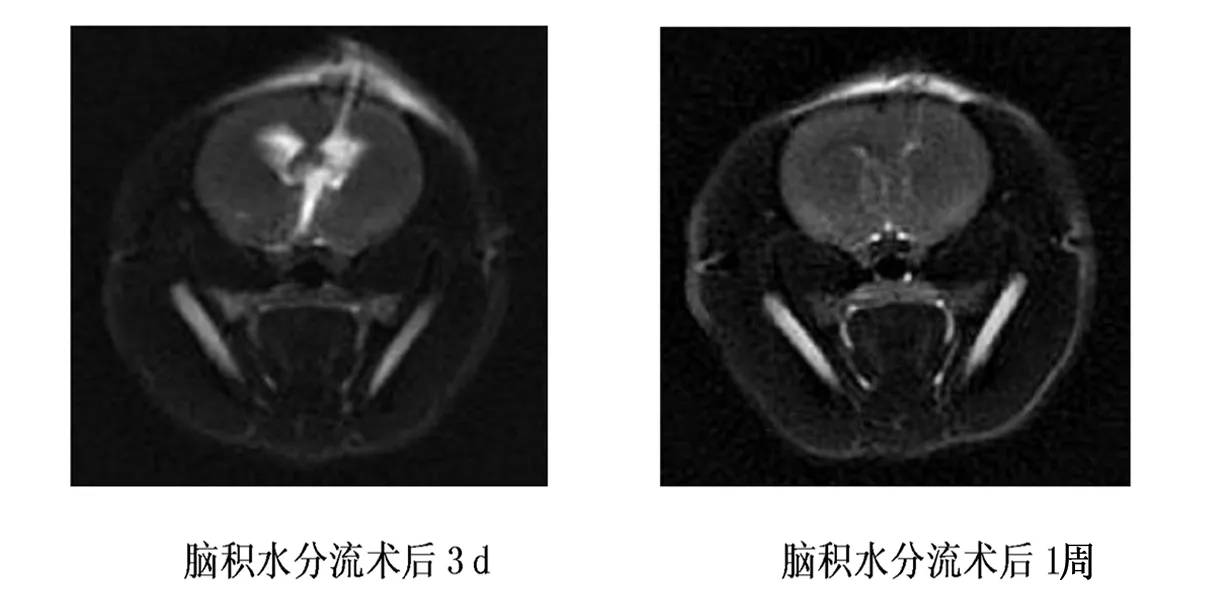
图2 脑积水分流术后MRI表现
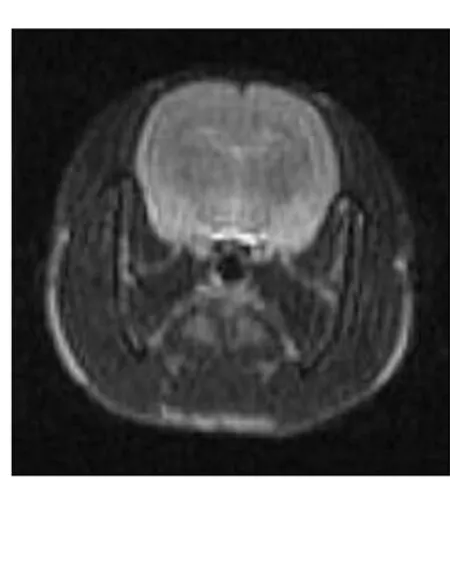
图3 对照组MRI表现
2.4 脑组织切片脑室指数测定
脑组织切片测定对照组的各亚组大鼠各对应时间点侧脑室指数,各亚组差异无显著性意义(P>0.05),平均为0.029±0.001,实验组的A、B、C组大鼠脑室进行性扩大,脑室周围区因脑室机械性扩张而缩小,脑积水造模后3 d(A组),侧脑室指数0.165±0.076, 1周(B组)扩大到0.293±0.096, 3周(C组)0.487±0.133,A、B、C组与A1、B1、C1组比较均P<0.001,A、B、C组间比较P<0.05。3周脑积水大鼠,分流后3 d(D组)侧脑室指数0.322±0.054,1周(E组)缩小到0.031±0.012,分别与D1组、E1组比较,D组、E组间比较均P<0.001。D、E组与对照组脑组织切片侧脑室见图4。
3 讨 论
成人正常颅压脑积水智力改变较早,开始时呈现近事遗忘,进而出现思维与动作迟缓,痴呆,走路不稳,重者甚至不能行走或站立,出现尿失禁;影像学上表现为脑室系统普遍增大,脑室和外侧裂扩大,脑室扩大伴额角圆钝,海马形态和脑沟正常,如果不进行及时治疗,脑室系统逐渐扩大,皮质变薄[1]。目前侧脑室-腹腔分流手术是临床治疗脑积水首选方法之一,分流术后,判断手术是否成功的重要指标之一是观察病人临床症状是否得到改善,影像学上,扩大的脑室系统是否回缩。本研究参照文献用大鼠建立的脑积水模型[2-3],观察到与成人脑积水患者类似的临床表现,用大体切片标本,对脑室系统大小测量,观察到随着时间的推移,脑室系统进行性扩大,脑积水临床表现也渐进性加重,分流术后,脑室系统缩小,临床症状也得到改善;影像学改变,与成人脑积水手术术后脑室系统改变相似,分流后脑室系统明显缩小,所以,本脑积水及分流模型适合成人脑积水及分流术后机理变化的研究。
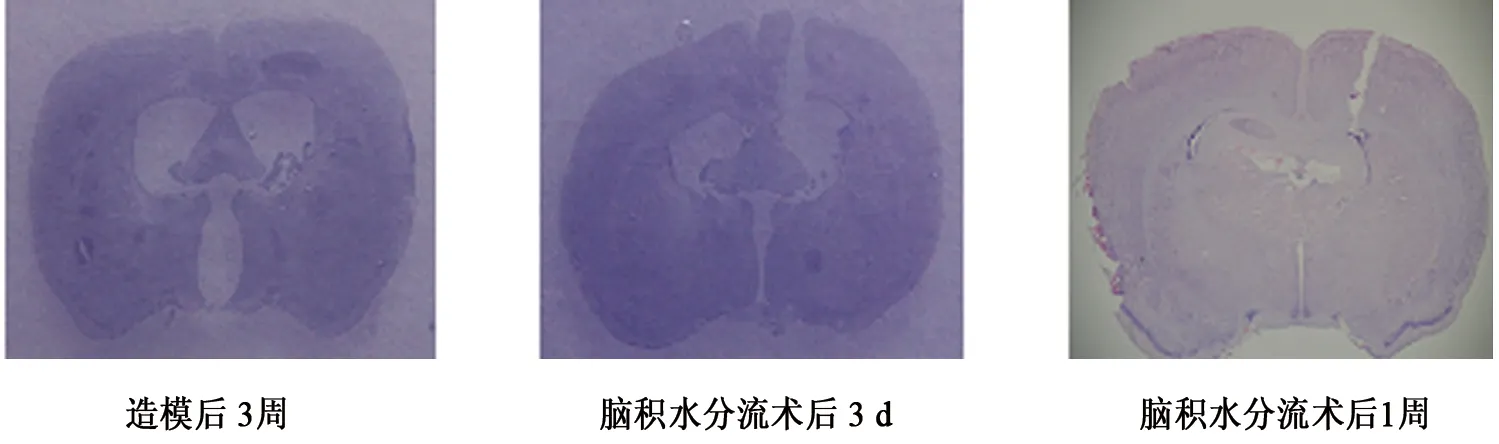
图4 脑组织切片表现
枕大池注入高岭土混悬液法是目前应用最广泛的制作交通性脑积水模型的方法。经皮切开暴露寰枕筋膜直视下注入高岭土混悬液较经皮盲穿注入高岭土混悬液大大降低了死亡率,本研究制作的脑积水模型,取得较高的成功率,且此种方法简便易行,无需特殊设备,模型制作稳定可靠。本组在制作过程中有如下体会:(1)动物满意的麻醉非常重要。(2)暴露寰枕筋膜时,严格沿中线钝性分离肌肉,这样既容易分离又对肌肉损伤小。(3)穿刺抽吸脑脊液时维持颈部屈曲30°,穿刺角度与水平线成60°~70°角,穿刺有落空感时立即停止进入。抽取脑脊液时,注射器针头斜面向上,防止因吸力过大,对脑干或小脑造成损伤,应避免反复穿刺。(4)注射高岭土前,务必再次混匀悬液,吸入1 mL无菌注射器内。当注射器针尖穿刺进入枕大池后使颈部屈曲20°,穿刺角度与水平线成50°~60°角注射高岭土,可减少高岭土渗漏。注射器针头斜面向上,避免高岭土直接压迫局部脑干,左手持注射器,右手旋转推进注射器内芯,旋转2~3圈即可向前推进0.05 mL,抽取脑脊液与注射高岭土时速度都要慢。(5)拔针后立即用医用耳脑胶封闭针眼,防止脑脊液及高岭土渗漏。(6)应用的高岭土混悬液浓度高剂量低,既能形成脑积水模型又能减少进入小脑延髓池的量,避免进入液体量过多导致枕骨大孔疝致死。(7)术后应用广谱抗生素预防感染。
参照文献采用脑室-皮下分流代替脑室-腹腔分流[4-5],显而易见,脑室-皮下分流比脑室-腹腔分流操作简单,由于将分流管末端直接放置皮下,避免了开腹对大鼠的创伤,简化了模型制作,本研究发现,脑积水脑室-皮下分流术后,大鼠的症状表现和影像学变化,与成人侧脑室-腹腔分流相似,完全可以满足脑积水分流术后脑组织病理机制变化的研究,值得推荐首先选择使用。为了进一步提高模型的成功率,本研究体会:(1)穿刺部位,深度一定要准确,必须确认分流管内有脑脊液流出。(2)分流管脑室端固定切实可靠。(3)制作的分流管远端连接一个硅胶管,防止分流管穿破皮肤,引起感染致死或影响实验结果。
随着脑积水模型及分流模型制作技巧的掌握,制作方法的改进,模型制作逐渐变得简单易行,成功率提高,为脑积水的研究提供良好平台。
[1] Michael Kiefer, Andreas Unterberg. The Differential Diagnosis and Treatment of Normal-Pressure Hydrocephalus [J]. Dtsch Arztebl Int, 2012,109(1-2): 15-26.
[2] ME Wagshul,JP McAllister,S Rashid, et al. Ventricular dilation and elevated aqueductal pulsations in a new experimental model of communicating hydrocephalus [J]. Exp Neurol,2009,218:33-40.
[3] Yong Sup Hwang, Insop Shim, Jin Woo Chang.The behavioral change of locomotor activity in a kaolin-induced hydrocephalus rat model:Evaluation of the effect on the dopaminergic system with progressive ventricle dilatation[J].Neurosci Letters, 2009,462:198-202.
[4] Hazel C Jones,Katia M Rivera,Neil G. HarrisLearning deficits in congenitally hydrocephalic rats and prevention by early shunt treatment [J].Child's Nerv Syst,1995,11: 655-660.
[5] N G Harris,H C Jones,S Patel.Ventricle shunting in young H-Tx rats with inherited congenital hydrocephalus: a quantitative histological study of cortical grey matter [J]. Child's Nerv Syst,1994, 10:293-301.
Establishmentofratmodelofhydrocephalusandshunt
WUChun-ming1,QUZhen-yun2,DONGAn-shi1,LIyan1,ZHANGHong-wei1,XUYou-song1,LIWei-hua1,WANGJian1,LITao1
(1.DepartmentofNeurosurgery,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China;2.DepartmentofPathophysiology,DalianMedicalUniversity,Dalian116044,China)
ObjectiveTo establish a rat hydrocephalus and hydrocephalus shunt model.MethodsEighty Male Wistar rats Were randomly divided into experimental and control groups of 40 each, Experimental rats injected to cisterna magna with 250 mg/mL kaolin suspension 0.05 mL by microsurgical techniques under the microscope,The same way, the control group injected with saline 0.05 mL to cisterna magna, completed the model of hydrocephalus in 34 rats as the experimental group 1, and then randomly divided into A, B, C, D, E group, completed control in 35 rats as the control group 1, and then randomly divided into A1, B1, C1, D1, E1 group, D, E groups were performed under a microscope the lateral ventricles-subcutaneous shunt, the same way, D1, E1 group does not place the shunt tube, The changes was observed in the ventricular system by Ventricle Slice, MR.ResultsVentricle index determination in Brain tissue slices: A group 0.165±0.076,B group 0.293±0.096, C group 0.487±0.133; Subgroups of the control group showed no significant difference at each time point(P>0.05),An average of 0.029 ± 0.001. Comparison between A、B、C and A1、B1、C1 groups,P< 0.001, Comparison between A,B,C groups ,P< 0.05. D group lateral ventricle index 0.322±0.054,E group 0.031±0.012, Comparison between D,E and D1,E1 groups,P<0.001.ConclusionThe rats communicating hydrocephalus model and hydrocephalus ventricle-subcutaneous shunt model by Kaolin cisterna magna injection, Suitable for hydrocephalus pathogenesis and experimental study of the pathological changes of brain tissue after shunt, It is meaningful for Pathological mechanisms and research of hydrocephalus treatment.
rat; hydrocephalus; shunt; model
10.11724/jdmu.2013.04.03
R651.1+1
A
1671-7295(2013)04-0316-04
吴春明,曲振运,董安石,等. 大鼠脑积水及其分流模型建立[J].大连医科大学学报,2013,35(4):316-319.
辽宁省自然科学基金资助项目(20062157)
吴春明(1967-), 男,辽宁大连人,教授。E-mail: luckywcm@163.com
曲振运,副教授。E-mail: quzhenyun@yahoo.com.cn
2013-06-16;
2013-06-29)
