兔戊型肝炎病毒ORF2编码蛋白的抗原表位分析
2013-12-25王松戴星董晨董敏梁久红孟继鸿
王松,戴星,董晨,董敏,梁久红,孟继鸿
(1.东南大学医学院,江苏南京 210009;2.东南大学附属中大医院皮肤科,江苏南京 210009)
戊型肝炎(HE)是由戊型肝炎病毒(HEV)引起的一种经粪-口途径传播的病毒性肝炎,呈全球分布。根据全基因组序列分析,HEV可分为4个基因型[1]:1型以缅甸株为代表,2型以墨西哥株为代表,3型以美国株为代表,4型以中国株为代表;其中1型和2型只感染人,3型和4型既感染人又感染动物。自1997年第一株动物 HEV[2]——猪 HEV美国株分离以来,已在多种动物包括非人灵长类动物、啮齿类动物、家猪、野猪、鹿、鸡、马、牛、羊、狗、猫等体内检出 HEV 抗体[3],并在家猪、野猪、鹿、兔和鸡等动物体内检测到HEV RNA,提示HEV不仅在人类中流行,而且也存在动物宿主,可由动物传染给人[4]。动物HEV传染人的最直接证据来自日本,在HE患者与食物剩余的野猪肉和鹿肉中检出同一HEV[5]。这些研究结果使人们认识到HE是一种人畜共患病。
近年,我国研究人员首先在农场养殖兔体内分离出HEV[6],基因序列分析显示兔HEV与已知1-4基因型HEV差异较大并可能构成一个新的基因型。此外,兔HEV抗体能被人源HEV抗原检测出来,提示兔HEV可能与已知基因型HEV含有共同的抗原表位。本实验室最近在江苏散养家兔的胆汁标本中成功分离出兔 HEV[7]。本研究选取一株兔 HEV毒株 JS120(GenBank序列号:JQ065059),通过制备兔HEV ORF2蛋白C端片段p166(aa452-617,R166)及抗-R166的McAbs,进一步研究兔HEV与已知基因型HEV抗原表位的异同,为阐明兔HEV的人畜共患特征及戊型肝炎的诊断和预防提供依据。
1 材料和方法
1.1 抗原的制备
将HEV缅甸株(M73218)、墨西哥株(M74506)、美国株(AF035437)、中国株(AJ272108)和兔HEV毒株JS120(JQ065059)编码 ORF2 p166(aa452-617)基因片段,插入PET28a载体(Pharmacia产品)构建重组质粒,转化大肠杆菌JM109菌株(Promega产品),表达6His-ORF2融合蛋白p166,经镍柱(Pharmacia产品)纯化的融合蛋白分别命名为 p166Bur、p166Mex、p166Us、p166Chn 和 R166。
1.2 抗R166单克隆抗体的制备
1.2.1 动物免疫和细胞融合 采用常规方法以R166免疫6~8周龄雌性BALB/c小鼠,共3次,每次免疫间隔2周。末次免疫后3 d,取免疫的小鼠脾细胞,在PEG4000的作用下与SP2/0骨髓瘤细胞以10∶1的比例融合,加入已制备有饲养细胞的96孔板,以含20%胎牛血清的HAT培养液置37℃、体积分数为5%的CO2培养箱中选择培养。
1.2.2 杂交瘤细胞株的建立 用所免疫的R166重组蛋白包被酶标反应板,采用间接ELISA法检测细胞培养板孔上清液,TMB底物显色,测定A450nm吸光度值,P/N>2.1判定为阳性。杂交瘤细胞筛选时,R166检测阳性,同时无关抗原His-HCV NS3重组蛋白检测阴性为预期McAb阳性孔。阳性孔细胞经2~3次有限稀释法进行亚克隆,至100%培养孔阳性,建立分泌McAb的杂交瘤细胞株,并将克隆化的细胞扩大培养并制备腹水,离心取上清,置-20℃保存。
1.2.3 McAb的类和亚类的鉴定及效价测定 采用上述间接ELISA法以HRP标记的兔抗鼠IgG亚类抗体(KPL产品)及兔抗鼠IgM抗体为二抗(KPL产品)鉴定McAbs的Ig类别;收集小鼠腹水并进行10倍系列稀释,采用间接ELISA法检测抗体效价。
1.3 HEV重组蛋白抗原表位分析
1.3.1 计算机辅助的序列分析 从GenBank中提取HEV缅甸株(M73218)、墨西哥株(M74506)、美国株(AF035437)、中国株(AJ272108)的基因组序列,同时本实验室自行分离鉴定兔HEV并测序,使用LASERGENE计算机软件系统(DNASTAR,Inc.美国 Wisconsin)的MegAlign Program进行计算机辅助序列分析。
1.3.2 ELISA检测 用已知基因1-4型HEV和兔HEV ORF2 p166重组蛋白分别包被酶标反应板,加入不同杂交瘤细胞的培养上清,37℃孵育45 min,洗涤6次,HRP标记的羊抗鼠IgG抗体作为酶标二抗,37℃孵育45 min,洗涤6次,以TMB为底物显色,测定A450nm值,P/N>2.1判定为阳性。
1.3.3 免疫印迹法(Western blotting)检测 将基因1-4型HEV及兔HEV的p166纯化蛋白,经 SDSPAGE后转至硝酸纤维素膜进行免疫印迹反应,以含5%脱脂牛奶TBST封闭2 h,洗涤3次后分别加入不同杂交瘤细胞培养上清,室温摇动2 h,洗膜3次,加入1∶2 000 HRP标记的羊抗鼠IgG抗体,室温摇动2 h,洗膜3次,加入DAB(二氨基联苯胺)显色,蒸馏水终止显色,摄像保存。
1.4 McAbs中和活性的鉴定
采用前期建立的基于PCR的HEV体外中和试验[8],将制备所得的McAbs腹水分别与100倍的HEV最低感染滴度的基因1型、4型HEV及兔HEV混合,37℃孵育1 h后接种单层PLC/PRF/5细胞,37℃孵育2 h,洗涤3次,按常规方法抽提HEV RNA,采用逆转录-套式聚合酶链反应法(RT-nPCR)检测HEV RNA,以PCR结果阴性判为中和试验阳性。
2 结 果
2.1 融合及筛选
获得3株稳定分泌抗R166 McAbs的杂交瘤细胞株,即1C1、6F9和10D2。以 R166 检测阳性,His-HCV NS3重组蛋白检测阴性,说明所制备的McAbs是针对R166中HEV基因编码蛋白的特异性抗体。
2.2 McAb的类和亚类的鉴定及效价测定
将3株杂交瘤细胞直立培养2周后收集上清,同时也制备腹水,经 ELISA鉴定,1C1、6F9和10D2类和亚类鉴定均为IgG1,6F9和10D2腹水的抗体滴度均为1∶10-5,1C1腹水的抗体滴度为 1∶10-4。
2.3 HEV重组蛋白抗原表位的分析
2.3.1 HEV 1-4基因型及兔HEV p166重组蛋白序列分析 比较已知HEV1-4基因型代表株缅甸株、墨西哥株、美国株和中国株及兔HEV JS120株编码p166蛋白的核苷酸序列,同源性为74.2%~80.9%,但在氨基酸水平,同源性高达88.0%~94.0%,提示不同基因型的p166重组蛋白在氨基酸水平具备相当的保守性,有可能存在共同的抗原表位。从氨基酸位点的差异来看(如图 1 所示),与 p166Bur、p166Mex、p166Us和p166Chn相比,R166有5个氨基酸残基的改变,分别位于81、125、130、155和163位点,提示兔 HEV 有可能存在与已知基因型HEV不同的抗原表位。
2.3.2 ELISA分析 采用已知4个基因型HEV的p166 重组蛋白(p166Bur、p166Mex、p166Us和 p166Chn)和兔HEV的p166重组蛋白(R166)作为包被抗原进行ELISA检测。3株杂交瘤细胞株中,1C1和6F9与5种p166均反应;10D2只与R166反应,而不与p166Bur、p166Mex、p166Us和 p166Chn反应。提示 R166与已知4个基因型HEV重组蛋白p166含有共同的抗原表位,也存在R166特有的抗原表位。
2.3.3 Western blotting分析 根据本研究中p166重组蛋白的氨基酸残基数目,p166Bur、p166Mex、p166Us、p166Chn和R166等5种重组蛋白的分子质量约为24 kDa,其SDS-PAGE可见预期条带(图2)。将3株杂交瘤细胞分泌的McAbs分别进行western blot检测,1C1株和6F9株在5种重组蛋白泳道均出现特异性24 kDa棕色反应条带,10D2株仅在R166泳道出现特异性24 kDa棕色反应条带,在其他泳道均无特异条带出现(图3)。3株McAbs的Western blotting检测结果与上述ELISA检测结果完全一致,再次提示R166与已知1-4基因型HEV含有共同的和不同的抗原表位。
2.4 McAb中和活性的鉴定
基于PCR的HEV体外中和试验检测显示,3株McAbs均不能阻断基因1、4型人HEV及兔HEV对培养细胞的感染性,不具有中和活性,提示这3株McAbs结合的抗原表位是非中和性表位。
3 讨 论
由于缺乏成熟的HEV细胞培养模型,目前HEV诊断主要依靠基因工程表达的重组蛋白或合成肽作为HEV特异性抗体检测的包被抗原。HEV ORF2编码的结构蛋白由660个氨基酸组成,其C端的2/3部分含有多个具有免疫优势的B细胞表位,广泛应用于HEV感染的免疫诊断及疫苗研究。我们前期研究发现,HEV ORF2 C端基因编码的一段含有166个氨基酸残基的重组蛋白(aa452-617),含有HEV构型依赖性中和抗原表位,用缅甸株p166Bur(1型)免疫血清能够交叉中和3种不同基因型的HEV毒株(1型巴基斯坦株、2型墨西哥株、3型美国株),提示不同基因型p166含有共同的中和抗原表位[9]。而后我们在抗原表位的分析研究中,分别制备出来源于第1、2、3和4基因型重组蛋白p166Bur、p166Mex、p166Us和p166Chn的McAb,发现4种基因型存在共同的抗原表位和基因型特异性的抗原表位[10-13]。另外,有研究提示某些感染3、4型HEV的病人对1、2型重组抗原制备的免疫诊断试剂缺乏IgG或IgM反应性[14-15];我们也发现不同基因型和亚型的HEV重组蛋白p166对不同血清标本HEV抗体检测的敏感性高低不同[16-17]。

图1 HEV 1(Bur)、2(Mex)、3(Us)、4(Chn)基因型及兔HEV代表株 ORF2 p166重组蛋白的氨基酸序列比较Fig 1 Amino acid comparison of ORF2 p166 combinant proteins encoded by genotype 1(Bur),2(Mex),3(Us),4(Chn)and rabbit HEV

图2 5种不同基因型p166重组蛋白的SDS-PAGE图谱Fig 2 SDS-PAGE analysis of five different genotypes HEV p166 recombinant proteins
近年来,我国学者首先在兔体内分离出一种新的HEV[6],可能构成HEV的新基因型。本实验室也在江苏家兔体内分离出兔HEV,其抗原表位特点有待阐明。我们选取一株兔HEV-JS120制备p166重组蛋白,免疫动物并制备McAbs,分析兔HEV与已知基因型HEV抗原表位的异同。本研究共得到3株能稳定分泌兔HEV p166相关的杂交瘤细胞株,ELISA及Western blotting检测结果提示,1C1株和6F9株是兔HEV与已知4种基因型HEV的共同型McAb,而10D2是兔HEV的特异性McAb,表明兔HEV与已知4种基因型HEV既含有共同的又含有不同的抗原表位。对5种p166氨基酸序列进行分析,R166有5个氨基酸残基的改变,分别位于81、125、130、155和163位点。10D2只与R166反应,而不与其他4种p166反应,提示上述5个位点中的一个或多个氨基酸残基的改变可能是引起R166抗原表位变异的原因,这种现象在已知HEV其他基因型和其他病毒中也有报道[10]。利用基于PCR的HEV体外中和试验,本研究所获得的3株McAbs均不能中和兔HEV及基因1、4型HEV,提示3株McAbs针对的抗原表位是非中和性抗原表位。
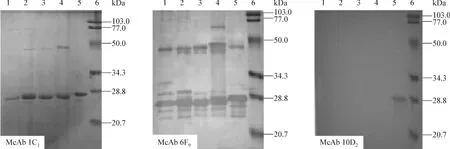
图3 McAb(1C1、6F9和10D2)与5种不同基因型p166重组蛋白的免疫印迹反应Fig 3 Wester blotting analysis of McAb(lc1,bFa and 10D2)reacted with five different genotypes HEV p166 recombinant proteins
综上所述,兔HEV作为一种新发现的HEV,其编码重组蛋白R166与已知1-4基因型HEV ORF2 p166含有共同的和不同的抗原表位,这些异同有助于深入研究不同基因型HEV抗原表位的变异,更加深入认识兔HEV的生物学特性,对扩展HEV的动物宿主的认识和防治具有重要价值。
[1]LU L,LI C H,HAGEDORN C H.Phylogenetic analysis of global hepatitis E virus sequences:genetic diversity,subtypes and zoonosis[J].Rev Med Virol,2006,16(1):5-36.
[2]MENG X J,PURCELL R H,HALBUR P G,et al.A novel virus in swine is closely related to the human hepatitis E virus[J].Proc Natl Acad Sci,1997,94(18):9860-9865.
[3]ZHANG W,SHEN Q,MOU J,et al.Hepatitis E virus infection among domestic animals in eastern China[J].Zoonoses Public Health,2008,55(6):291-298.
[4]MENG X J.Recent advances in hepatitis E virus[J].J Viral Hepat,2010,17(3):153-161.
[5]DALTON H R,BENDALL R,IJAZ S,et al.Hepatitis E:an emerging infection in developed countries[J].Lancet Infect Dis,2008,8(11):698-709.
[6]ZHAO C,MA Z,HARRISON T J,et al.A novel genotype of hepatitis E virus prevalent among farmed rabbits in China[J].J Med Virol,2009,81(8):1371-1379.
[7]WANG S,DONG C,DAI X,et al.Hepatitis E virus(HEV)isolated from rabbits is highly genetic heterogeneity but with very similar antigenicity to human HEV[J].J Med Virol,2013,85(4):627-635.
[8]MENG J H,DUBREUIL P,PILLOT J.A new PCR-based semneutralization assay in cell culture for diagnosis of hepatitis E[J].J Clin Microbiol,1997,35:1373-1377.
[9]MENG J H,DAI X,CHANG J C,et al.Identification and characterization of the neutralization epitope(s)of the hepatitis E virus[J].Virology,2001,288(2):203-211.
[10]梁久红,孟继鸿,赵宇,等.不同基因型戊型肝炎病毒的抗原表位分析[J].中华微生物学和免疫学杂志,2003,23(10):817-821.
[11]赵宇,梁久红,孟继鸿,等.戊型肝炎病毒 I、Ⅱ与 III、Ⅳ基因型B细胞抗原表位的异同[J].中国免疫学杂志,2004,20(9):591-595.
[12]邓蕾,孟继鸿,赵宇,等.不同基因型戊型肝炎病毒存在多种类型抗原表位[J].微生物学报,2006,46(1):120-126.
[13]汪源,梁久红,董晨,等.戊型肝炎病毒第Ⅳ基因型特异性抗原表位的鉴定与定位[J].微生物与感染,2006,1(3):149-152.
[14]KWO P Y,SCHLAUDER G G,CARPENTER H A,et al.A-cute hepatitis E by a new isolate acquired in the United States[J].Mayo Clin Proc,1997,72(12):1133-1136.
[15]WANG Y C,LING R,ERKER J C,et al.A divergent genotype of hepatitis E virus in Chinese patients with acute hepatitis[J].J Gen Virol,1999,80(Pt 1):169-177.
[16]卢晶,戴星,孟继鸿.不同基因型戊型肝炎病毒重组抗原p166用于抗体检测的价值[J].中华微生物学和免疫学杂志,2006,26(4):369-374.
[17]孟继鸿,戴星,窦晓光,等.不同基因型戊型肝炎病毒重组蛋白的抗原性分析[J].东南大学学报:医学版,2002,21(1):31-35.
