西达本胺联合顺铂对三阴乳腺癌细胞株MDA-MB-231的体外抗增殖作用及其机制的研究
2013-12-25项丹姜藻顾晓怡
项丹,姜藻,顾晓怡
(1.东南大学附属中大医院肿瘤中心,江苏南京 210009;2.东南大学环境医学工程教育部重点实验室,江苏南京 210009)
近年来乳腺癌发生率呈明显上升趋势,其中不表达雌激素受体(ER)、孕激素受体(PR)和表皮生长因子受体-2(HER-2)的乳腺癌被称为“三阴性”乳腺癌[1-2],是目前乳腺癌治疗的难点之一[3-4]。Basal-like型细胞绝大多数不表达这3种受体,因此常作为研究“三阴性”乳腺癌的靶细胞[5]。目前的研究结果仅能提示铂类、蒽环类、高剂量环磷酰胺等可能是相对敏感药物[6],而紫杉类和长春新碱类药物是不敏感药物,但不能明确三阴乳腺癌的最佳治疗策略[6-7]。
西达本胺是我国自主研发的一种组蛋白去乙酰化酶抑制剂,目前研究表明其可抑制结肠癌、前列腺癌、淋巴瘤等细胞的增殖,但其对三阴乳腺癌的作用尚未见报道。本实验通过西达本胺和(或)顺铂(DDP)干预Basal-like型细胞,初步探讨西达本胺联合顺铂体外干预三阴乳腺癌细胞株MDA-MB-231增殖、凋亡及其机制,探索治疗三阴乳腺癌的新方法。
1 材料和方法
1.1 细胞
人三阴乳腺癌细胞株MDA-MB-231购于中国科学院细胞库,培养传代在含体积分数为10%新生牛血清的DMEM高糖培养基、CO2体积分数为5%的培养箱中,选择对数生长期细胞进行实验。
1.2 药物及主要试剂
顺铂购自山东齐鲁制药厂,西达本胺由深圳微芯公司赠送,用二甲亚砜(DMSO)溶解,配成32 000 μmol·L-1的储存液,保存于-20℃冰箱中,3周内使用,控制DMSO浓度在1%以内。DMEM培养液(美国Gibco公司),胎牛血清(杭州四季青有限公司),HEPES、DMSO、MTT(美国 Sigma 公司),Anti-ERCC1 antibody、Anti-HDAC3 antibody、Anti-Histone H3 antibody-ChIP Grade(美国Abcam公司)
1.3 实验方法
1.3.1 MTT法检测西达本胺及顺铂单独对MDA-MB-231细胞增殖的影响 将MDA-MB-231细胞密度调整为4.5 ×104ml-1,接种于96 孔培养板,每孔200 μl,培养过夜,观察细胞贴壁且生长良好后,取西达本胺药物浓度 4、8、16、32、64、128 μmol·L-1,DDP 药物质量浓度 1、2、4、8、16、32 mg·L-1处理作为实验组,非药物处理作为阴性对照,DMEM培养液不加细胞作为空白对照,各设3个复孔,分别继续培养24、48、72 h,每孔加入 5 mg·ml-1MTT 溶液 20 μl,培养 4 h,吸弃培养液,每孔加 DMSO 150 μl,摇床振荡 5 min,酶标仪测定492 nm波长处OD值。以药物作用浓度为横坐标、抑制率为纵坐标绘制肿瘤增殖抑制曲线图,并计算出IC50值。
1.3.2 MTT法检测西达本胺及顺铂联合对MDA-MB-231细胞增殖的影响 以1/2 IC50西达本胺+1/16、1/8、1/4、1/2、1、2 IC50顺铂作用于细胞,并计算出达到IC50时顺铂的浓度。
1.3.3 流式细胞仪(FCM)检测西达本胺对MDA-MB-231细胞凋亡的影响 将MDA-MB-231细胞密度调整为4.5×104ml-1,接种于6孔板,每孔4 ml,分别以1/4 IC50、1/2 IC50和IC50浓度的西达本胺处理细胞48 h,对照组加入含等量DMSO的DMEM培养液,用不含EDTA的胰酶消化收集处理后的MDA-MB-231细胞,4℃PBS缓冲液洗涤2次,加入500 μl结合缓冲液、5 μl Annexin V-FITC、5 μl PI,染色 5 ~15 min 后,用流式细胞仪及ModFit软件检测分析。
1.3.4 Western blotting分析组蛋白H3、HDAC3蛋白的表达 取生长状态良好的细胞,待细胞密度达到60%~70%,分别取IC50西达本胺、1/2 IC50西达本胺处理及对照组细胞各5×106个,加裂解液(含蛋白酶抑制剂)冰上裂解 30 min,14 000 r·min-1离心 5 min,取上清,BCA法测定蛋白含量。蛋白与5倍上样缓冲液混合煮沸5 min后,取20 μg蛋白上样,进行SDSPAGE,转膜并封存。50 g·L-1的脱脂奶粉/TBST按1∶1 000稀释一抗,4℃孵育过夜,再加入HRP标记的相应二抗4℃孵育2 h,然后加入ECL液,曝光,显影,定影。
1.3.5 荧光定量PCR检测ERCC1基因表达情况分别取IC50西达本胺、IC50顺铂及1/2 IC50西达本胺+1/2 IC50顺铂处理48 h及对照组细胞5×106个,采用Trizol法提取细胞中总RNA,用TaKaRa逆转录试剂盒合成cDNA,采用罗氏SYBR染料进行荧光定量PCR,行数据分析。PCR反应条件为:95℃预变性10 min;94℃变性15 s,54℃或者58℃退火20 s,72℃延伸30 s,共循环40次。ERCC1上下游引物分别为5'-TGGCTTCTGCTATGTCAACG-3'和5'-GCACGTGGGTTG GTAGAAGT-3',产物大小为216 bp;内参β-actin上下游引物分别为5'-AGATACTAATGCTCTGCGTGT-3'和5'-GATGGAGACTGGCTTCTGATT-3',产物大小为 147 bp。
1.4 统计学处理
2 结 果
2.1 西达本胺、顺铂单药对MDA-MB-231细胞增殖的抑制作用
与未经药物处理的正常对照组比较,细胞经过不同浓度不同时间的处理后细胞增殖受到明显抑制,不同浓度及不同时间细胞增殖存在明显差异(P<0.05),见图1、2。西达本胺作用24、48、72 h 的 IC50分别是(84.36 ±4.33)、(57.38 ±7.19)、(31.64 ±9.25)μmol·L-1,顺铂作用24、48、72 h 的IC50分别是(18.24 ±1.14)、(8.37 ±0.79)、(5.08 ±1.63)mg·L-1。单药西达本胺浓度64 μmol·L-1、单药顺铂质量浓度 8 mg·L-1接近 48 h的IC50值,遂取其为后续实验浓度。

图1 西达本胺对MDA-MB-231细胞增殖的影响Fig 1 Influence of chidamide on the proliferation of MDAMB-231 cells
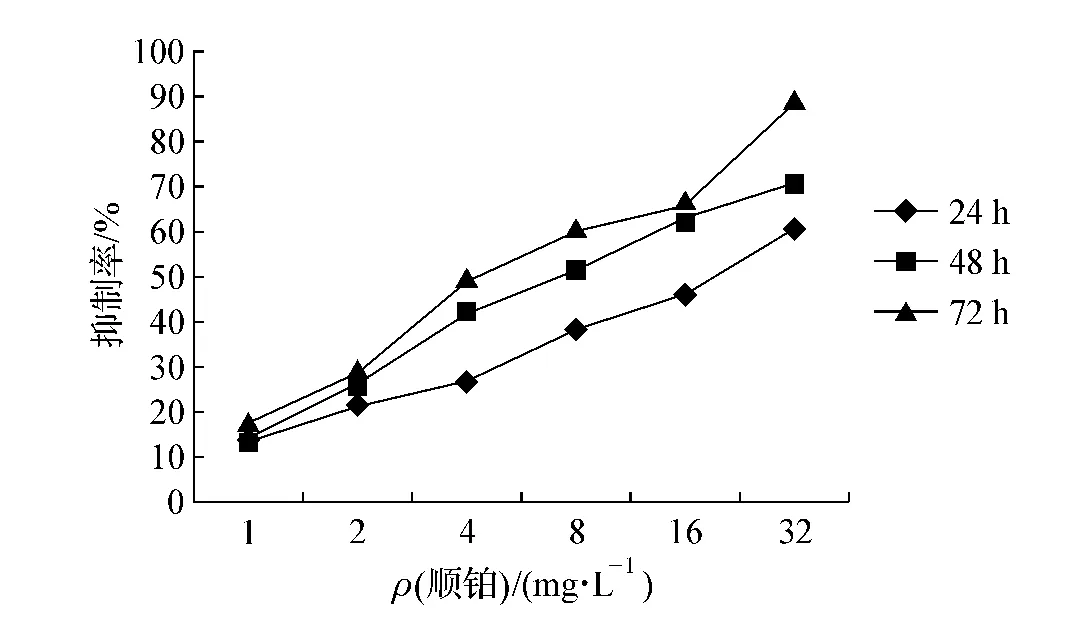
图2 顺铂对MDA-MB-231细胞增殖的影响Fig 2 Influence of cisplatin on the proliferation of MDA-MB-231 cells
2.2 西达本胺联合顺铂对MDA-MB-231细胞增殖的抑制作用
32 μmol·L-1西达本胺联合不同浓度的顺铂(0.5、1、2、4、8、16 mg·L-1)对 MDA-MB-231 细胞作用48 h后,抑制率分别为(23.04±4.73)%、(37.45±5.14)%、(49.47±3.72)%、(60.33±4.05)%、(76.64±3.58)%、(89.14±6.12)%,计算出顺铂的 IC50为(1.97±0.24)mg·L-1,此数值明显小于 1/2 IC50顺铂,表明西达本胺联合顺铂能起到协同作用。
2.3 流式细胞仪检测细胞凋亡
西达本胺作用48 h后,16 μmol·L-1组细胞凋亡率为48.5%,32 μmol·L-1组凋亡率为 70.1%,64 μmol·L-1组凋亡率为89.9%,而对照组细胞自然凋亡率为16.4%,说明该药物具有明显的促细胞凋亡作用。3个浓度西达本胺组间差异有统计学意义(P<0.05),见图3。
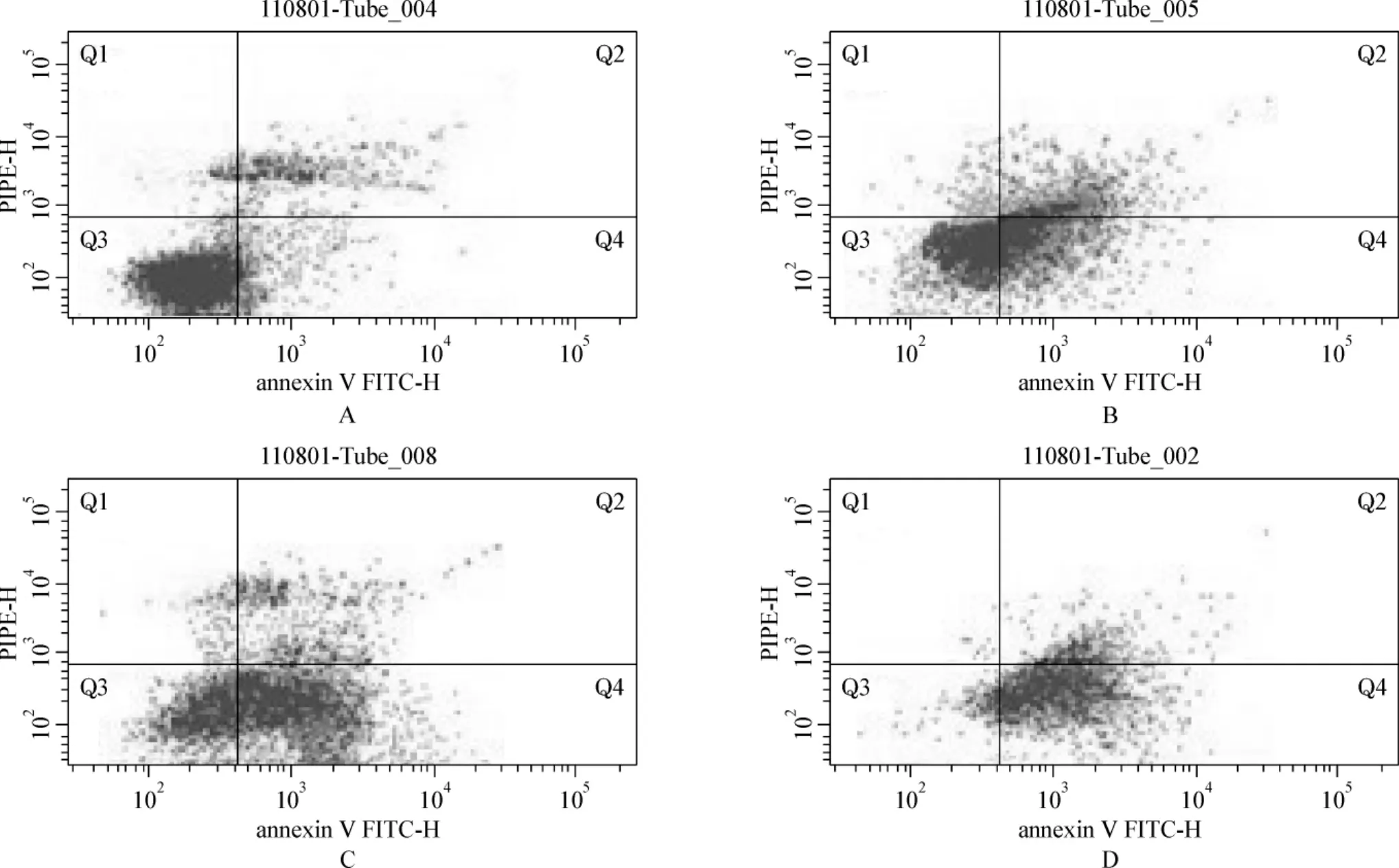
图3 西达本胺作用MDA-MB-231细胞48 h的细胞凋亡Fig 3 Apoptosis of MDA-MB-231 cells treated with chidamide for 48 h
2.4 不同浓度西达本胺对组蛋白H3、HDAC3蛋白表达的影响
Western blotting 法检测显示,对照组和 32、64 μmol·L-1西达本胺作用48 h后随着药物浓度的增加,H3的乙酰化水平增强,HDAC3蛋白表达减少,见图4。表明西达本胺可通过抑制HDAC3蛋白的表达,上调组蛋白H3的乙酰化水平,影响相关基因的转录,从而抑制肿瘤细胞的增殖。
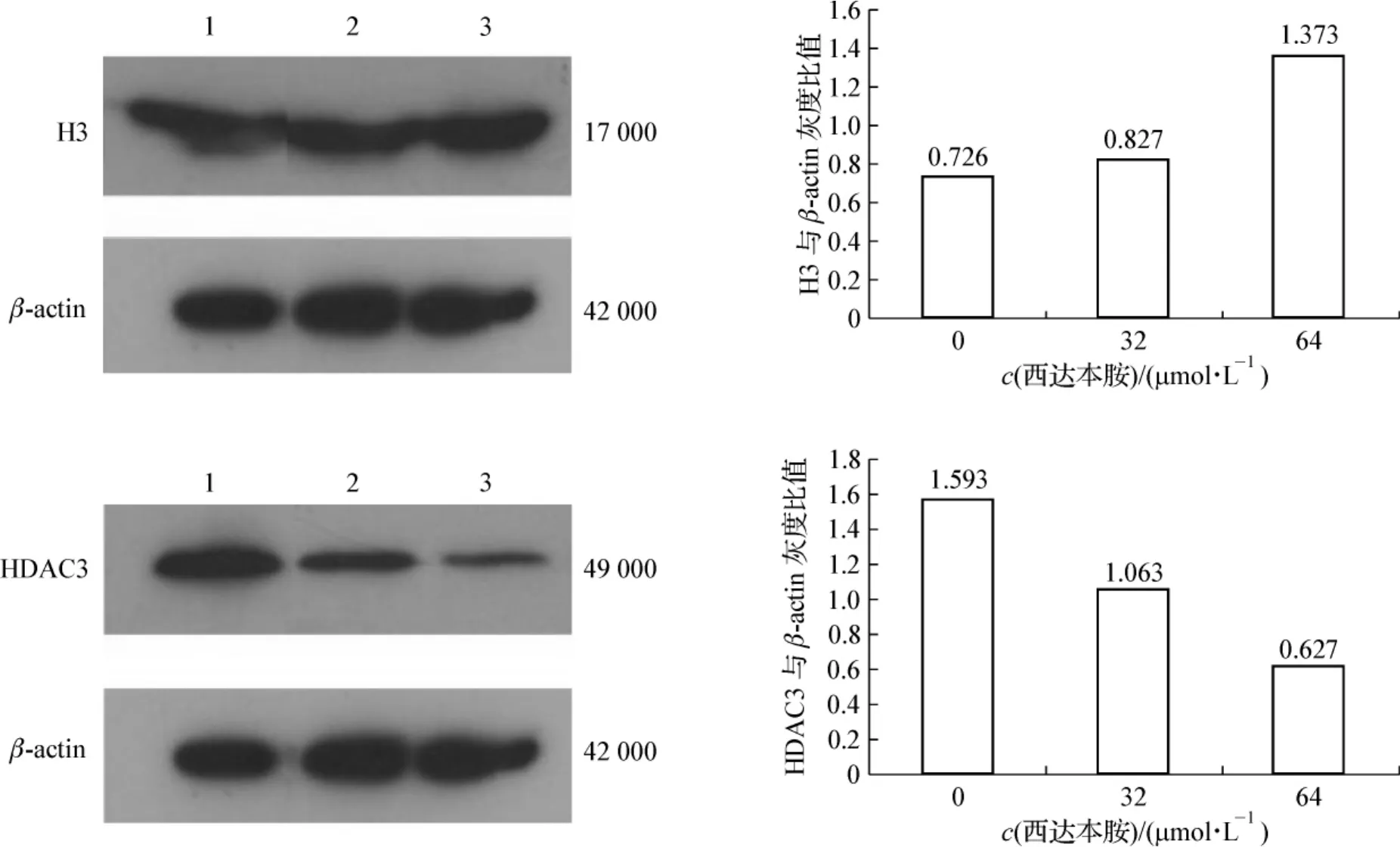
图4 西达本胺作用48 h后H3、HDAC3蛋白表达水平Fig 4 The expression of H3 and HDAC3 of MDA-MB-231 cells treated with chidamide for 48 h
2.5 荧光定量PCR检测ERCC1基因表达情况
荧光定量PCR结果显示,单独使用顺铂组细胞ERCC1与对照组表达量相近,但单独使用西达本胺组细胞ERCC1较对照组表达量有明显减少,联合用药组细胞ERCC1较空白对照组表达量亦明显减少,表明西达本胺能降低细胞ERCC1的表达量,从而降低细胞对顺铂的耐药性,达到协同作用,见图5。
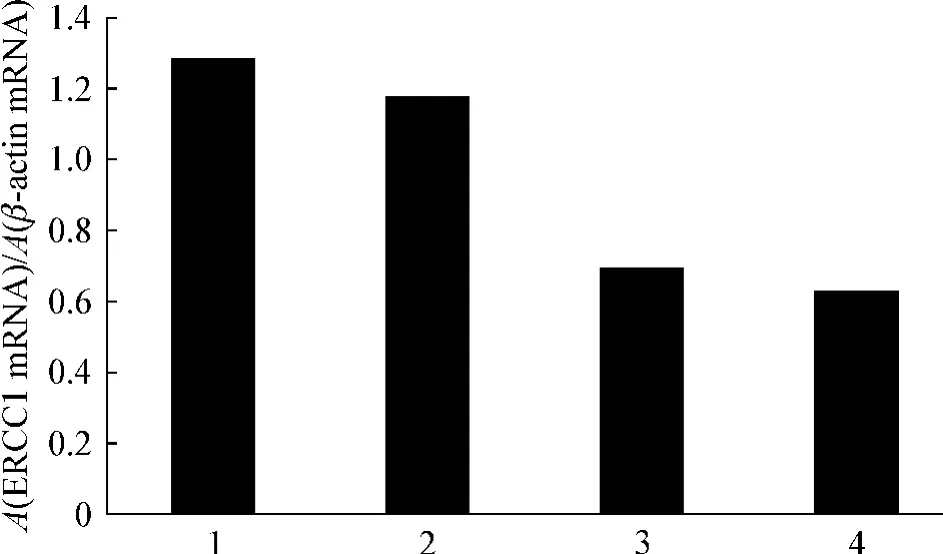
图5 西达本胺和(或)顺铂作用48 h后细胞ERCC1的相对表达量Fig 5 Expression level of ERCCI of MDA-MB-231 cells treated with chidamide and(or)cisplatin for 48 h
3 讨 论
组蛋白去乙酰化酶抑制剂会使染色质组蛋白乙酰化水平增高,改变染色体结构,影响基因的转录,从而抑制细胞的增殖和诱导凋亡[8]。目前报道的已进入临床或即将进入临床试验的组蛋白去乙酰化酶抑制剂共有十余个,西达本胺是我国自主研发合成的一种组蛋白去乙酰化酶抑制剂[9],其活性基团为苯酰胺基,底物主要为HDAC3[10]。目前研究发现,其可抑制恶性黑色素瘤细胞[11]、前列腺癌细胞[12]、结肠癌细胞[13]、B 淋巴瘤细胞[14]、胃癌细胞[15]的增殖,但未见西达本胺作用于三阴乳腺癌的相关报道。顺铂是一种类烷化剂的金属铂类化合物,三阴乳腺癌对铂类药物相当敏感。本研究首次进行了西达本胺单药或(和)顺铂体外治疗三阴乳腺癌的研究。
MTT结果表明,西达本胺和顺铂单药对MDAMB-231细胞的生长均有抑制作用,且抑制率随着药物剂量及时间的增加而增加,具有剂量时间效应依赖关系。两药联合作用后对乳腺癌细胞相同的抑制作用时所需药物剂量较其单独作用时极大降低,这对于临床用药时降低药物剂量、减少毒副作用具有极大的意义。
HDACI可以抑制肿瘤细胞内高表达的HDAC活性。相关研究发现,西达本胺可抑制HDAC1、2、3和10的活性[16]。本实验结果发现,HDAC3在MDA-MB-231细胞中有表达,且西达本胺能降低HDAC3在此细胞株中的表达。西达本胺抑制HDAC3后可上调组蛋白H3的乙酰化水平,诱导细胞周期阻滞和凋亡,进一步抑制肿瘤细胞的增殖[17]。本实验发现,应用西达本胺后与空白组对照,组蛋白H3的乙酰化水平有所提高。因此,在表观遗传方面显示,西达本胺上调组蛋白H3的乙酰化水平,影响相关基因的转录,从而抑制肿瘤细胞的增殖。
顺铂对肿瘤的细胞毒作用主要是通过形成铂-DNA加合物。顺铂的主要作用靶点是DNA,顺铂进入肿瘤细胞后水解为双氯双氨铂,然后与细胞DNA形成顺铂—DNA加合物,影响细胞DNA的复制与转录,从而导致DNA损伤,使增殖的细胞停滞在G2/M期[18]。ERCC1对铂类药物化疗及其患者生存期具有显著相关性[19],ERCC1过表达可使停滞在 G2/M期的损伤DNA迅速修复,尤其是ERCC1能使顺铂诱导的DNA络合物的清除增加,导致其对顺铂耐药[20]。本实验结果显示,西达本胺联合顺铂较单药顺铂ERCC1的表达降低。因此,西达本胺能降低ERCC1的表达是两药联合增效的部分原因。
本实验的意义在于,首次发现西达本胺联合顺铂在体外能协同抑制MDA-MB-231细胞的增殖,并初步阐明其分子机制,为该方案的临床应用提供了理论依据。
[1]HU Z,FAN C,OH D S,et al.The molecular portraits of breast tumors are conserved across microarray platforms[J].BMC Genomics,2006,(7):96.
[2]BERTUCCI F,FINETTI P,CERVERA N,et al.How basal are triple-negative breast cancers?[J].Int J Cancer,2008,123(1):236-240.
[3]WILLIAM J,IRVIN Jr,LISA A.What is triple-negative breast cancer?[J].Eur J Cancer,2008,44(18):2799-2805.
[4]DIALLO-DANEBROCK R,TING E,GLUZ O,et al.Prognostic and predictive impact of protein expression profiling in highrisk breast cancer patients treated with high-dose or conventional dose-dense chemotherapy[J].Clin Cancer Res,2007,13(2):488-497.
[5]CAREY L A,PEROU C M,LIVASY C A,et al.Race,breast cancer subtypes,and survival in the Carolina breast cancer study[J].JAMA,2006,295(21):2492-2502.
[6]DIALLO-DANEBROCK R,TING E,GLUZ O,et al.Prognostic and predictive impact of protein expression profiling in highrisk breast cancer patients treated with high-dose or conventional dose-dense chemotherapy[J].Clin Cancer Res,2007,13(2):488-497.
[7]BAUER K R,BROWN M,CRESS R D,et al.Descriptive analysis of estrogen receptor(ER)-negative,progesterone receptor(PR)-negative,and HER2-negative invasive breast cancer,the so-called triple-negative phenotype:a population-based study from the California Cancer Registry[J].Cance,2007,109(9):1721-1728.
[8]MINUCCI S,PELICEI P G.Histone deacetylase inhibitors and the promise of epigenetic(and more)treatments for cancer[J].Nat Rev Cancer,2006,6(1):38-51.
[9]尹子卉,吴仲闻,兰玉坤,等.新型抗肿瘤组蛋白去乙酰化酶抑制剂西达本胺的合成[J].中国新药杂志,2004,13(6):536-538.
[10]郑杰.肿瘤的细胞与分子生物学[M].上海:上海科学技术出版社,2011:249-251.
[11]陈佳,周武庆,陈浩,等.西达本胺对恶性黑色素瘤细胞系A375的体外抗增殖作用[J].中华皮肤科杂志,2009,42(4):255-258.
[12]程宏,王璇琳,赵丽晶,等.西达本胺对人前列腺癌DU145及PC3细胞凋亡的影响[J].生物技术通讯,2012,10(4):176-179.
[13]何向明,李苏宜,刘琳,等.西达本胺对结肠癌LoVo细胞增殖抑制的体外研究[J].肿瘤学杂志,2009,15(4):310-313.
[14]李艳莹,王艳芳.西达本胺对人B淋巴细胞株的作用及其机制研究[J].中国实验血液学杂志,2012,20(4):893-899.
[15]周珊,姜藻,顾晓怡.西达本胺对胃癌SGC-7901细胞增殖、凋亡及Notch1、Sirt1基因表达的影响研究[J].东南大学学报:医学版,2012,31(3):273-276.
[16]NING Z Q,LI Z B,NEWMAN M J,et al.Chidamide(CSO55/HBI-8000):a new histone deacetylase inhibitor of yhe benzamide class with antitumor activity and the ability to enhance immune cell-mediated humor cell cytotoxicity[J].Cancer Chemother Pharmacol,2012,69(4):901-909.
[17]LIU L,CHEN B,QIN S,et al.Anover histone deacetylase inhibitor chidamide induse apoptosis of hum colou cancer cells[J].Biochem Biophys Commun,2010,292(2):190-195.
[18]ALTAHA R,IAANG X,YU J J,et al.Excision repair cross complementing—group1:gene expression and platinum resistance[J].Int J Mol Med,2004,14:959-970.
[19]成红艳,陈宝安,孙新臣,等,ERCC1、XRCC1单核苷酸多态性与非小细胞肺癌铂类药物化疗预后关系的研究[J].东南大学学报:医学版,2011,30(5):717-721.
[20]EBPG Expert Group on Renal Transplantation.European best practice guidelines for renal transplantation[J].Nephrol Dial Transplant,2002,17(4):34-39.
