Ezrin多克隆抗体制作及应用
2013-12-23张宏玲万骏严飞张新胜曹威陶伟黄来强
张宏玲 万骏 严飞 张新胜 曹威 陶伟 黄来强
(1.清华大学生命科学学院,北京 100084;2.清华大学深圳研究生院生命与健康学部 生物医药研究中心和基因与抗体治疗重点实验室,深圳 518055)
埃兹蛋白(Ezrin)是一种重要的膜-细胞骨架连接分子,属于ERM家族(Ezrin,Radixin,Moesin)中的一员。ERM家族蛋白的同源性主要体现在他们都在N-末端有一个同源性很高的FERM 功能域(FERM domain),以及在C-末端的不同氨基酸位置上有一个关键的、与其激活有关的苏氨酸磷酸化位点,FERM功能域在介导细胞表面黏附分子与细胞骨架连接的生理功能中起着关键作用。通过Ezrin的桥接作用,可将肌动蛋白细胞微丝与细胞膜相连,从而产生一系列细胞功能,如细胞形态的改变、细胞运动、黏附、有丝分裂、细胞极性等[1-3]。研究发现Ezrin在多种肿瘤中表达异常,并且在肿瘤细胞转移过程中扮重要角色[4,5]。Ezrin通过调节黏附分子和信号转导以及细胞骨架及其相关蛋白的功能,参与细胞与细胞、细胞与基质之间的相互作用,从而在肿瘤发展、浸润和转移过程中起着重要作用[6,7]。
研究肿瘤相关蛋白功能机理的一个重要方法是通过找出其相互作用的蛋白,进而阐述它在整个网络状信号通路中所起的作用。本研究通过原核诱导表达,纯化出Ezrin全长蛋白,便于后续验证与其相互作用蛋白的体外直接结合,并通过蛋白免疫动物,获得针对Ezrin的多克隆抗体,为研究其在真核细胞以及在肿瘤发生发展过程的相关功能奠定基础。
1 材料与方法
1.1 材料
质粒pET-28a(+)-ezrin,重组大肠杆菌E. coli BL21(DE3)[携带质粒LpET-28a(+)-ezrin]为本实验室构建和保存;HeLa,HepG2,HEK 293,CNE,NIH3T3细胞为本实验室储存; 用于饲养哺乳动物细胞的DMEM培养基购自Gibico公司;新西兰大耳兔、昆明鼠,购买自广州实验动物中心;蛋白质Marker购自Fermentas;HRP酶标二抗(抗鼠和抗兔)及罗丹明标记的二抗购自KPL公司。
1.2 方法
1.2.1 Ezrin蛋白原核诱导表达及纯化 随机挑取单克隆接种于5 mL含适量抗生素LB液体培养基中,于37℃、200 r/min条件下过夜培养。然后按2%接种量接种于200 mL含抗生素新鲜的LB液体培养基中,于37℃、200 r/min条件下继续培养。当菌液浓度达到OD600=0.6时加入终浓度1 mmol/L IPTG,37℃、200 r/min条件下培养。IPTG诱导5 h,5 000 r/min 离心5 min,收集菌体,用40 mL 20 mmol/L Tris-HCl(pH8.0)缓冲液混合重悬,冰上进行超声处理。5 000 r/min离心,根据蛋白表达情况分别收集上清,沉淀。结果显示Ezrin蛋白主要在上清中。
纯化方法:Ni-NTA His Binding@Resin 2 mL柱预处理:用5 mL去离子水洗涤;加0.5-1 mL NiSO4;再用5 mL去离子水洗涤。用10 mL 20 mmol/L Tris-HCl(pH8.0)+8 mol/L尿素平衡柱。上样准备好的蛋白上清溶液,收集流出液。用30 mL 20 mmol/L Tris-HCl、100 mmol/L咪 唑、1 mmol/L β-巯 基 乙 醇(pH8.0),收集流出液。用10 mL 20 mmol/L Tris-HCl,300 mmol/L imidazole,1 mmol/L β-巯基乙醇,pH8.0洗脱蛋白,收集1 mL/管,蛋白在此步收集。最后用10 mL 20 mmol/L Tris-HCl,5 mmol/L imidazole,1 mmol/L β-巯基乙醇,pH8.0洗涤,收集流出液。用10 mL去离子水洗涤柱子,充满20%乙醇,放在4℃冰箱保存。纯化的蛋白用SDS-PAGE电泳检测。
1.2.2 Ezrin兔抗血清的制备 取2 mL 蛋白(1.6 mg/mL)制品与等体积的弗氏完全佐剂混合,在新西兰大耳兔背部选取4-6个点,进行皮下多点接种,共接种4次,每次间隔14 d,第4次加强免疫后7 d耳缘静脉采血,分离血清,进行效价检测,获阳性结果后,进行心脏取血,将血液收集到无菌的试管中,室温静置1-2 h,待血液凝固后,转移到4℃冰箱中,放置过夜,至血清析出,将血清转移到无菌的离心管中,10 000 r/min、4℃离心30 min,取上清,保存于-70℃备用。
1.2.3 Ezrin鼠抗血清制备 5只3-4周龄昆明小鼠,将200 μg抗原蛋白溶于250 μL生理盐水并与等体积弗氏完全佐剂充分乳化,对小鼠进行皮下注射。首次免疫2周后进行第2次免疫,免疫原剂量减半,并用弗氏不完全佐剂乳化。第2 次免疫后每隔7 d按照2次免疫的方法继续免疫,第4次免疫后第3天,分离血清,进行效价检测,获阳性结果后进行心脏取血,将血液收集到无菌试管中,室温静置1-2 h,待血液凝固后转移到4℃冰箱中,放置过夜,至血清析出,将血清转移到无菌离心管中,10 000 r/min、4℃离心30 min,取上清,保存于-70℃备用。
1.2.4 ELISA检测抗血清效价 抗原包被:将抗原用包被液14 000稀释(10 μg/mL终浓度),100 μg/孔加入聚苯乙烯96孔反应板中,4℃放置过夜。洗涤:次日倾去凹孔内的液体,PBST洗3次。封闭:加100 μL/孔3% BSA,室温放置0.5 h。洗涤:用PBST洗3次。加待测样品(一抗):将抗体血清在另一块板上用PBS连续稀释,100 μL/孔加到已包被的板上,每个样品平行做两份,免疫前的血清作为阴性对照。加盖37℃恒温箱温育1 h。洗涤:用洗涤液洗3次。加HRP酶标二抗:用封闭液1∶8 000稀释,100 μL/孔,加盖37℃恒温箱温育1 h。洗涤:用PBST洗5次,蒸馏水洗2次。显色:加新鲜配制的底物溶液100 μL/孔暗处放置5-30 min,显示蓝色。终止反应,比色:加50 μL/孔终止液,颜色变黄;用酶标仪测定450 nm处各孔的吸光值,阳性反应的最大稀释度为待测样品的效价。
1.2.5 Western blotting 检测 将收集的细胞加入SDS加样缓冲液,煮沸10 min,离心后取上清液进行SDS-PAGE后电转移至PVDF膜上,以5%的脱脂牛奶封闭2 h,与自制兔抗人,鼠抗人TRIP-1的多克隆抗体4℃过夜,之后用TBST每10 min洗1次,共3次;加入相应二抗室温1 h后用TBST洗膜3次,每次10 min,曝光。
1.2.6 细胞免疫荧光 固定在盖玻片上的细胞用PBS漂洗3次,每次5 min;用3.7%的甲醛固定细胞,37℃ 10 min;0.1% TritonX-100透化10 min;PBS漂洗3次,每次5 min;5%山羊血清(PBS配制)室温封闭1 h;去除山羊血清封闭液之后,直接加入5% BSA稀释的一抗,4℃杂交过夜。PBS漂洗5次,每次5 min;加入5% BSA稀释的二抗,室温避光杂交1 h;PBS漂洗5次,每次5 min;抗催灭封片剂封片,激光共聚焦荧光显微镜上观察。
1.2.7 Protein G亲和层析柱纯化抗体 配制缓冲液:起始缓冲液为TBS缓冲液,洗脱缓冲液为pH2.7 0.1 mmol/L甘氨酸盐酸。
准备收集管:取1.5 mL离心管,每支离心管加70 μL pH9.0 1 mol/L Tris-HCl。
样品准备:抗血清经TBS进行透析过夜,并经0.22 μm微孔滤膜滤过。
透析过的待纯化的样品15-25 mL上柱,流速为0.5 mL/min,将留出的样品反复过柱。然后以同样的流速用10-20倍体积的TBS缓冲液洗涤,去除未结合和非特异性结合的蛋白,洗涤是否完全可以通过测定OD280的吸光度进行。洗脱缓冲液(pH2.7,0.1 mmol/L甘氨酸盐酸)6-7 mL每管1 mL收集洗脱液,测每管OD280吸收值。收集第2洗脱峰,BCA法测蛋白含量,4℃保存备用。

纯化的抗体用SDS-PAGE电泳鉴定其纯度:用12%分离胶、5%浓缩胶,恒流下电泳2 h,考马斯亮蓝R250(Pharmacia)染色。
2 结果
2.1 Ezrin蛋白的表达与纯化
利用构建好的pET-28a(+)-ezrin载体分别转化E. coli BL21(DE3),成功地原核诱导表达Ezrin全长蛋白于上清,并且用经镍柱纯化好的蛋白进行下一步试验,即免疫小鼠和新西兰大耳兔。
2.2 Ezrin抗血清效价检测
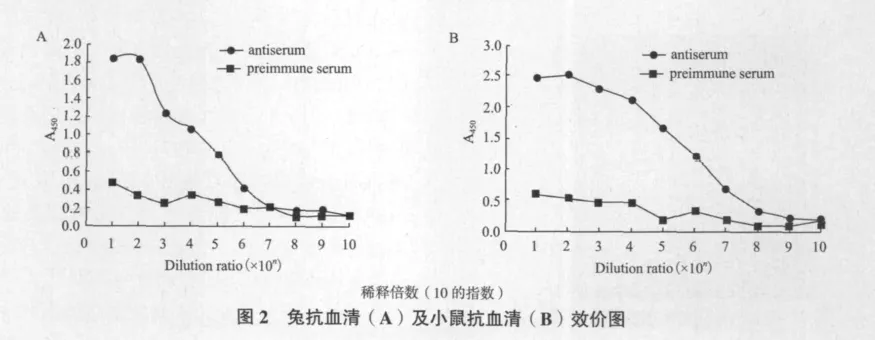
将用Ezrin蛋白抗原免疫4次之后的新西兰大耳兔以及昆明鼠抽取血清样本通过ELISA法测量抗体效价,计算阳性血清和阴性血清A450值之比(antiserum/preimmune serum,a/p),当a/p≥2.1时为阳性,当1.5≤a/p<2.1时为可疑,当a/p<1.5时为阴性。抗血清效价测定,经过免疫过的兔和鼠的血清,通过ELISA法测定其效价,如图2所示,两种抗血清稀释倍数为106时,和阴性血清相比,仍呈现阳性反应,表明免疫后的两种抗血清的效价均达到106。
2.3 利用抗体检测真核细胞及组织蛋白表达情况
利用抗体检测真核细胞及组织蛋白表达情况,各细胞及组织蛋白,12%蛋白胶PAGE电泳,将制作好的Ezrin鼠源及兔源抗体用于Western blotting试验,检测多种细胞和组织当中的Ezrin表达情况。将所制备抗体3 000倍稀释用来检测真核细胞内源性Ezrin蛋白表达情况,如图3所示,兔抗和鼠抗均能够很好的检测真核细胞内源性的蛋白表达,包括293、HeLa、CNE及NIH3T3细胞株。在HepG2细胞中,没有检测到Ezrin蛋白的表达。以上结果说明制备的抗血清具有较高的特异性和灵敏性。

2.4 细胞免疫荧光法检Ezrin蛋白细胞内定位
取HeLa细胞进行免疫荧光,用Ezrin鼠抗来检测其在细胞内的定位情况,二抗rhodamine标记的羊抗鼠抗体。荧光显微镜下拍照。将制备的Ezrin鼠抗人多克隆抗体100倍稀释进行细胞免疫荧光化学染色试验分析,发现制备的抗体能够进行细胞免疫荧光化学染色,且染色效果十分良好,同时发现,Ezrin蛋白在细胞质内质网位置定位明显,此定位与发表的相关文献吻合(图4)。

2.5 Ezrin抗体纯化
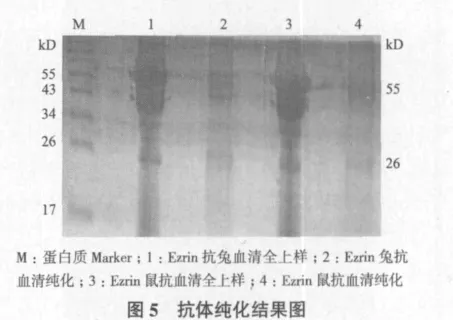
取免疫过的兔和鼠的抗血清,利用protein G纯化方法,将2种抗体进行了初步纯化,从纯化结果(图5)可清楚的看到抗体重链(55 kD)和轻链(26 kD),但是纯化得率较低,且有杂带。其原因可能是抗血清中的抗体亚型与protein G柱子结合能力较低,或者洗脱缓冲液的pH值需要改进和调整。
3 讨论
Ezrin是属于ERM家族蛋白中与肿瘤密切相关的蛋白,它在多种癌症组织中高表达且对肿瘤细胞的迁移起着重要的调控作用。对其功能的研究将进一步揭示癌症发生发展的机理并有望找到治疗癌症的新靶点。本试验中原核表达纯化出的Ezrin蛋白也可以直接用于验证相互作用和体外蛋白活性的试验,为揭示与Ezrin相互作用的蛋白创造条件。抗体是研究基因功能的重要工具[8-11]。制备一种效价高、特异性好的抗体是研究疾病相关基因的表达、定位和生物学功能非常重要的一步。抗体包括多克隆抗体,单克隆抗体等。单克隆抗体的特异性较好,但制作过程比较繁琐。多克隆抗体则制作较为容易。本研究通过原核诱导表达与纯化[12],得到较为纯净的Ezrin蛋白,采用直接免疫兔子和小鼠的方法获得抗血清。兔抗和鼠抗均能够很好的检测真核细胞内源性的蛋白表达,包括293、HeLa、CNE及NIH3T3细胞株。在HepG2细胞中,没有检测到Ezrin蛋白的表达,这与文献报道相符。曾有文献报道在HepG2细胞株当中,Ezrin的表达量很少[13]。ELISA是检测抗体质量相关系数的重要手段[14,15],本研究制备的抗血清经过ELISA测定具有较高的效价。未经纯化的抗血清效价非常高,稀释很高的倍数仍可用于Western blotting和免疫荧光等试验,表明制备的抗血清可用于多种免疫学试验,且有较高的特异性和灵敏度。
抗血清纯化可使用几种不同的方法,常用的是蛋白A/G结合法和抗原亲和纯化法[16,17]。为了进一步提高抗体的纯度,采用protein G方法对抗体进行了纯化,但纯化效率有待提高。分析原因可能是抗血清中的种属亚型与protein G的结合能力较弱,或者洗脱缓冲液的pH值需要进一步调整和优化。
综上所述,本研究制备的Ezrin多克隆抗体具有与其抗原特异性结合的特征,并成功应用于ELISA,免疫印迹和免疫荧光试验,其纯化方法仍需进一步改进。这为继续深入研究此蛋白的病理、生理学功能及其调控打下了基础。
4 结论
通过将原核表达纯化,获得了较为纯净的Ezrin全长蛋白。通过免疫新西兰大耳兔和昆明小鼠,获得了抗血清。通过ELISA,Western blotting和免疫荧光试验验证了抗体的效价和特异性,证明用该方法可制备具有较高特异性和灵敏度的多克隆抗体。
[1] Bretscher A, Edwards K, Fehon RG. ERM proteins and merlin:integrators at the cell cortex[J]. Nat Rev Mol Cell Biol, 2002, 3:586-599.
[2] Gautreau A, Louvard D, Arpin M. Morphogenic effects of Ezrin require a phosphorylation-induced transition from oligomers to monomers at the plasma membrane[J]. J Cell Biol, 2000, 150(1):193-203.
[3] Algrain M, Turunen O, Vaheri A, et al. Ezrin contains cytoskeleton and membrane binding domains accounting for its proposed role as a membrane-cytoskeletal linker[J]. J Cell Biol, 1993, 120(1):129-139.
[4] 卢航青, 郑杰.埃兹蛋白:生物学特征及其在肿瘤转移中的作用[J].细胞生物学杂志, 2005, 27:257-262.
[5] 王友元, 李劲松, 陈伟良.埃兹蛋白相关信号通路与肿瘤侵袭转移[J].国际肿瘤学杂志, 2011, 38(3):166-169.
[6] Yu Y, Khan J, Khanna C. Expression profiling identifies the cytoskeletal organizer Ezrin and the developmental homeoprotein Six-1as key metastatic regulators[J]. Nat Med, 2004, 10:175-181.
[7] Makitie T, Carpen O, Vaheri A. Ezrin as a prognostic indicator and its relationship to tumor characteristics in uveal malignant melanoma[J]. Invest Ophthalmol Vis Sci, 2001, 42(11):2442-2449.
[8] 王俊茹, 覃文新, 李锦军, 等.肝癌相关蛋白HCAP1的表达、抗体制备及其亚细胞定位[J].中国免疫学杂志, 2003, 19(1):26-28.
[9] 王仁, 杨向东, 屈顺林, 等.新的人突触相关蛋白(FRG4)抗原表位分析及抗体制备[J].中国免疫学杂志, 2005, 21(7):531-534.
[10] 刘雨飞, 丁丽华, 郝春芳, 等.转录因子XBP21的融合表达、纯化及多克隆抗体的制备[J].中国生物化学与分子生物学报, 2004, 20(6):762-767.
[11] 韩克军, 杨美香, 李燕, 等.肿瘤相关抗原基因HCA520重组蛋白的表达纯化及其肝癌患者血清中相应抗体的分析[J].中国生物化学与分子生物学报, 2003, 19(1):31235.
[12] 郭艳荣, 常晓月, 崔晓君, 等. eEFIAl基因克隆、原核分泌表达及融合蛋白纯化[J].生物技术通报, 2011(6):127-133.
[13] Zhang Y, Hu M, Wu W, et al. The membrane-cytoskeleton or ganizer ezrin is necessary for hepatocellular carcinoma cell growth and invasiveness[J]. J Cancer Res Clin Oncol, 2006, 132:685-697.
[14] 张小兵, 邸禄芹, 吴萌, 等.单克隆抗体与多克隆抗体配对ELISA方法比较[J].生物技术通报, 2009(11):125-129.
[15] 陈卓, 刘家驹, 毕亮, 等. NPR1多肽抗体的制备和应用[J].生物技术通报, 2012(1):145-150.
[16] 张圆, 庄然, 金伯泉, 等.兔抗mLAIR21胞外区抗体的制备、纯化和鉴定[J].细胞与分子免疫学杂志, 2005, 21(5):595-597.
[17] 王京, 汪立, 范慧, 等. CMTM12v17/CKLFSF12v17多克隆抗体的制备、亲合纯化与鉴定[J].中国免疫学杂志, 2006, 22:1132-1136.
