利用转基因烟草表达人胰高血糖素样肽1的研究
2013-12-23梁宏伟陈发菊王玉兵李凤兰陆海
梁宏伟 陈发菊 王玉兵 李凤兰 陆海
(1.三峡大学生物技术研究中心,宜昌 443002; 2. 北京林业大学生物科学与技术学院,北京 100083)
II型糖尿病是一种以慢性血葡萄糖水平增高为特征的代谢性疾病,是由于胰岛素分泌和作用缺陷所引起,是影响人类健康的一种主要疾病之一。目前,对II型糖尿病患者的治疗主要从饮食、运动以及使用药物等几个方面着手,新的治疗手段主要是控制机体代谢、增加胰岛β-细胞数量和维持其正常生理功能[1]。人胰高血糖素样肽1(hGLP1)是一种肠肽激素,主要由末端空肠、回肠和结肠的L细胞所分泌,是胰高血糖素原(proglucagon)基因翻译后加工和修饰的产物,主要通过与G蛋白偶联的受体结合后发挥其生理功能[2]。hGLP1作为一种肠降血糖素,能够诱导胰岛β-细胞增殖和分化,促进葡萄糖依赖的胰岛素分泌,抑制胰高血糖素分泌,减缓胃肠蠕动和饥饿感,减少饮食,从而达到降低血糖的水平[3]。hGLP1能够明显降低Ⅱ型糖尿病患者空腹和餐后血糖水平,对Ⅱ型糖尿病具有较好的疗效,同时对Ⅰ型糖尿病的治疗也具有一定的潜力[4]。
烟草是转基因植物生产重组药用蛋白、抗体、基因工程疫苗研究的模式植物,其遗传转化体系成熟完善。目前利用转基因烟草已成功表达了葡萄脑苷脂酶(β-glucocerebrosidase)[5]、人生长激素(hGH)[6],以及针对霍乱病毒(cholera)[7]、人类乳突病毒(HPV)[8]、艾滋病(HIV)[9]和炭疽杆菌(anthrax)[10]等多种治疗性蛋白或疫苗。本研究利用烟草这一成熟转化体系,通过农杆菌介导法将人胰高血糖素样肽1(hGLP1)基因导入烟草中,并通过动物试验对转基因烟草表达产物进行初步的生物活性检测,旨在为转基因烟草作生物反应器表达人胰高血糖素样肽1提供理论和技术支持。
1 材料与方法
1.1 材料
普通烟草(Nicotiana tabacum L.),本实验室保存。昆明小鼠购自军事医学科学院,雄性,6-7周龄,体重18-22 g,SPF级,质量合格证号:SCXK-(军)-2007-004。
各种限制性内切酶购自宝生物工程(大连)有限公司;所有引物均由上海生工公司合成;Southern blot试剂盒购自Roche(Germany)公司;Marker DNA、2×Taq MasterMix、Western blot试剂盒购自北京康为世纪生物科技有限公司;各种激素、抗生素和组培生化试剂购自北京拜尔迪生物技术有限公司。
hGLP1基因和PBI121表达载体由三峡大学生物技术研究中心惠赠,将含有His-tag标签的hGLP1基因克隆至PBI121质粒CaMV35S启动子下游,hGLP1基因两端限制性酶切位点为BamHⅠ和SmaⅠ,T-DNA区结构示意见,图1。根癌农杆菌(Agrobacterium tumefaciens)GV3101菌株,由本实验室保存。

图1 植物表达载体PBI121质粒(包含hGLP1基因)T-DNA区
叶片不定芽分化培养基:MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂粉5.2 g/L;继代、生根培养基:1/2MS+NAA 0.2 mg/L+IBA 0.2 mg/L+蔗糖30 g/L+琼脂粉5.4 g/L; 遗传转化的选择压力为30 mg/L卡那霉素(Km),除菌羧苄青霉素(Carb)为500 mg/L。以上培养基配制时均调pH值6.0。
1.2 方法
1.2.1 烟草的遗传转化 采用叶盘法[11]进行农杆菌的侵染转化。用含有PBI121-GLP1表达载体的农杆菌GV3101侵染过夜预培养的烟草小叶块(0.5 cm×0.5 cm)5 min,然后吸去附着的菌液置于(25±2)℃、黑暗条件下共培养2 d,共培养结束后转入附加30 mg/L卡那霉素和500 mg/L羧苄青霉素的不定芽分化培养基上,(25±2)℃,16/8 h光周期下进行选择培养,3周后叶片外植体开始分化出抗性不定芽,待不定芽长到1 cm以上时,切下并接入附加30 mg/L卡那霉素的生根培养基上进行生根培养。
1.2.2 GUS组织化学染色 GUS染色液配方参照Jefferson等[12]方法稍作修改。50 mmol/L磷酸钠缓冲液(pH7.0)中含有5 mmol/L K4Fe[CN]6,5 mmol/L K3Fe[CN]6,10 mmol/L EDTA-Na2,0.1%(V/V)Triton X-100,20%甲醇,1 mg/L的X-Gluc。X-Gluc需提前溶于DMSO中,再加入上述缓冲液里,混匀后分装于2.0 mL离心管中置-20℃中保存备用。
1.2.3 转基因烟草的分子生物学检测
1.2.3.1 PCR检测 采用CTAB法[13]提取转化植株和野生型烟草植株总DNA。以PBI121-GLP1质粒DNA为阳性对照,野生型烟草总DNA为阴性对照进行PCR扩增。PCR扩增检测引物:GLP1-F:5'-GGATCCACCATGGGGCATCATCATC-3';GLP1-R:5'-GCACCAGTCTTCCCTTAACCAGCCAAG-3'。扩增程序:94℃变性5 min;94℃变性1 min,58℃退火35 s,72℃延伸30 s,30个循环;72℃ 延伸10 min。
1.2.3.2 Southern blot检测 通过PCR扩增PBI121-GLP1质粒DNA,回收GLP1基因片段,按照Roche公司DIG High Prime DNA Labeling and Detection Starter kit Ⅱ操作手册标记探针。对PCR检测呈阳性植株进行Southern杂交检测,方法按杂交试剂盒的操作指南进行。
1.2.3.3 Western blot检测 采用PBS提取缓冲液(NaCl 137 mmoL/L,KCl 2.7 mmoL/L,Na2HPO410 mmoL/L,KH2PO41.76 mmoL/L,pH7.4)提取烟草叶片中总可溶性蛋白质,用Bradford法测定可溶性蛋白质浓度。经SDS-PAGE 电泳,采用半干法转移至硝酸纤维素膜(NC)上。将NC膜置于封闭液中封闭;漂洗,加入稀释的His-tag标签抗体一抗孵育;漂洗,加入稀释的羊抗兔-HRP(辣根过氧化物酶)二抗孵育;漂洗,使用ECL Western blot Kit进行ECL反应;X-光片压片,曝光、显影、定影。
1.2.4 转hGLP1基因烟草的总可溶性蛋白生物活性检测 参照文献[14,15]将雄性昆明小鼠禁食12-18 h后,检测基础血糖值,挑选血糖值相近的小鼠分成2组,每组8只。分为对照组和给药组,对照组按体重腹腔注射50%葡萄糖溶液同时给予野生型烟草总可溶性蛋白提取液,给药组按体重腹腔注射50%葡萄糖溶液同时给以待测样品。
尾静脉取血测定血糖值,并记录血糖值变化的差异。所有数据以±s表示,以SPSS12进行t检验统计组间差异。
2 结果
2.1 烟草外植体的选择培养和抗性再生
经过农杆菌侵染烟草小叶块在不定芽分化的选择培养过程中,大部分外植体黄化甚至白化逐渐死亡,小部分则仍然正常生长分化。15-20 d左右,开始有部分外植体分化出不定芽。取1 cm以上的抗性不定芽转入附加30 mg/L Km选择压的生根培养基进行生根培养,最终获得hGLP1基因转化的烟草再生植株10株。
2.2 烟草抗性再生植株的PCR扩增检测
分别提取10个株系的转基因烟草植株的叶片基因组DNA,采用hGLP1基因特异性引物进行PCR扩增检测,同时以PBI121-GLP1质粒DNA为阳性对照,未转化野生型烟草总DNA为阴性对照。结果(图2)显示,其中6个株系的转基因烟草和阳性对照均扩增出了150 bp左右目的条带,而未转基因野生型烟草则没有特异性扩增条带。从而证实hGLP1基因已经成功整合到烟草基因组DNA中。
2.3 转hGLP1基因烟草的GUS组织化学染色
对转hGLP1基因烟草再生植株茎叶做GUS表达检测,以未转基因野生型烟草作为阴性对照。结果(图3)显示,在转基因烟草的茎和叶脉中有明显的蓝斑阳性信号,而野生型烟草则无GUS蓝斑信号。从而证明GUS报告基因在转基因烟草中获得翻译表达。由于hGLP1基因和GUS报告基因串联或构成融合基因,报告基因的表达间接证明hGLP1基因也能够在转基因烟草中正常转录表达。


2.4 Southern blot检测
以含有hGLP1基因的质粒DNA为阳性对照,野生型烟草总DNA为阴性对照,对转化植株样本进行Southern杂交检测。结果(图4)显示,6个转hGLP1基因烟草抗性再生株系均出现明显的阳性杂交信号。进一步证明hGLP1基因已成功整合到烟草的基因组DNA中,获得了转人胰高血糖素样肽1基因的转基因烟草。将Southern杂交检测呈阳性的转基因烟草进行扩繁,炼苗后移栽至温室,以便进行蛋白质提取和生物活性检测。
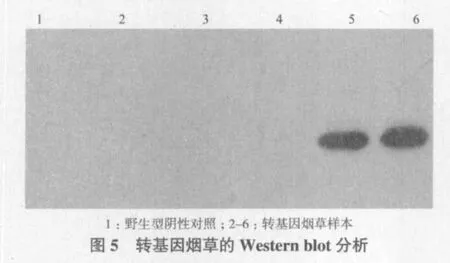
2.5 转hGLP1基因烟草的Western杂交检测
由于hGLP1基因序列中融合有6×His-tag标签,在检测转基因烟草是否翻译表达hGLP1融合蛋白的Western杂交检测中,以Anti-His tag Antibody作为第一抗体,羊抗兔-HRP为二抗,以野生型烟草总可溶性蛋白作为阴性对照,分别提取6个株系的转hGLP1基因烟草的总可溶性蛋白进行Western杂交检测。结果(图5)显示,在2个株系转基因烟草中可以检测到hGLP1融合蛋白的表达而在非转基因的野生型烟草中没有检测到特异性杂交条带。从而证实了hGLP1基因在转基因烟草中获得了翻译表达。随着压片时间的延长,非特异性条带开始出现。

2.6 转hGLP1基因烟草总可溶性蛋白的生物活性
提取转hGLP1基因烟草总可溶性蛋白,以昆明小鼠葡萄糖性高血糖模型进行体内生物活性检测。葡萄糖对照组注射50%葡萄糖溶液,同时给以野生型烟草总可溶性蛋白提取液,给药组注射50%葡萄糖溶液,同时给以转hGLP1基因烟草总可溶性蛋白提取液。统计结果(表1)显示,对照组和给药组腹腔注射18 mmol/kg的50%葡萄糖溶液,10 min后小鼠血糖浓度迅速升高4 7倍,说明试验性高血糖模型造模成功。给药组小鼠腹腔注射18 mmol/kg的50%葡萄糖溶液同时给以7.5 mg/kg的总可溶性蛋白,在随后的10、20、40 min时小鼠血糖浓度均明显低于葡萄糖对照组。初步证明转hGLP1基因烟草的总可溶性蛋白具有一定的降血糖生物活性。
3 讨论
hGLP1基因由本课题组根据植物偏爱密码子对碱基序列的优化修饰,在基因序列上游添加了在翻译的起始中有重要作用KOZAK序列[16],以增强目的基因的翻译效率,期待能够在转基因烟草植株内高效表达人胰高血糖素样肽1。
在烟草的遗传转化过程中,通过抗生素筛选获得再生植株仍有相当一部分假阳性植株,可能是因为在培养过程中叶片常常卷翘变形而没有完全接触到选择培养基,从而造成部分假阳性植株的筛选逃逸。也可能随着培养时间增长,培养基中抗生素逐渐降解导致浓度降低,从而造成假阳性植株的再生。因此,在选择培养的过程中保证叶片外植体充分接触选择培养基,经常更换新鲜的培养基,优先选取最早分化的抗性芽进行下一步的继代培养,可望提高选择效率。在Western杂交检测中,仅有2个株系能够检测hGLP1融合蛋白的表达,其余4个株系没有获得阳性信号。由此可见,不同转化子之间外源蛋白表达与否及表达量是存在明显差异。究其原因可能是发生基因沉默,或是外源蛋白表达量太低不足以检测到阳性信号,也可能是表达的外源蛋白在植物体内被降解。外源蛋白在转基因植物中表达量低是普遍存的问题,有时甚至发生基因沉默而不能表达[17]。Yasud等[18]将GLP1基因导入水稻中,发生基因沉默而未获得胰高血糖素样肽1的表达,随后他们将GLP1与GFP基因构建融合序列转化水稻,获得高效的表达融合蛋白,但分离纯化的过程中GLP1蛋白丢失,分析认为可能是被细胞内水解酶消化。

表1 转hGLP1基因烟草总可溶性蛋白的生物活性(血糖浓度单位:mmol/L)
以模式植物烟草作为生物反应器的受体,比较高效的遗传转化效率是其最大优点。但是也存在着一定的问题,主要表现为烟草中含有大量的尼古丁等生物碱毒素,毒性较大,4 0 60 mg剂量即可使人致死[19]。以烟草作为生物反应器表达的药用蛋白无法直接使用,需精细纯化后才能应用。本研究中提取烟草总可溶性蛋白测试小鼠体内生物活性发现,无论是对照组还是给药组小鼠注射烟草总可溶性蛋白提取液后不断颤抖,可能是烟草中生物碱毒素所致,下一步将采用分离纯化的hGLP1融合蛋白进行动物体内生物活性检测。分离纯化转基因烟草表达的重组药用蛋白,无疑会大大提高重组药用蛋白的生产成本,不符合植物生物反应器廉价地生产重组药用蛋白的主旨。尽管目前已经有多种植物被用作生物反应器的受体来生产药用蛋白、重组疫苗,如烟草、 谷类作物、 豆类、 蔬菜与根茎类作物等,但是还没有找到公认的最好的适于商业生产的植物物种和组织[20]。
4 结论
通过农杆菌介导侵染转化,hGLP1基因已成功地整合到烟草基因组中并获得转化再生植株,hGLP1融合蛋白在转基因烟草植株中获得表达,初步的动物试验表明该融合蛋白具有一定的降血糖生物活性。
[1] Arulmozhi D K, Portha B. GLP-1 based therapy for type 2 diabetes[J]. European Journal of Pharmaceutical Sciences, 2006, 28(1-6):96-108.
[2] 姚艳丽, 冯凭. 胰高血糖素样肽-1与Ⅰ型糖尿病治疗[J]. 生命的化学, 2005, 25(4):316-317.
[3] Giorgino F, Laviola L, Leonardini A, et al. GLP-1:a new approach for type 2 diabetes therapy[J]. Diabetes Research and Clinical Practice, 2006, 74:S152-S155.
[4] 李慧, 陈家琪. 胰高血糖素样肽1类似物的研究进展[J]. 天津药学, 2005, 17(3):41-43.
[5] Cramer CL, Boothe JG, Oishi KK. Transgenic plants for therapeutic proteins:Linking upstream and down stream strategies[J]. Curr Topics Microbiol Immunol, 1999, 240:95-11.
[6] Staub JU, Garcia B, Graves J, et al. High-yield production of a human therapeutic protein in tobacco chloroplasts[J]. Nature Biotechnology, 2000, 18:333-338.
[7] Daniell H, Lee SB, Panchal T, et al. Expression of the native cholera toxin B subunit gene and assembly as functional oligomers in transgenic tobacco chloroplasts[J]. J Mol Biol, 2001, 311:1001-1009.
[8] Biemelt S, Sonnewald U, Galmbacher P, et al. Production of human papilloma virus type 16 virus-like particles in transgenic plants[J]. J Virol, 2003, 77:9211-9220.
[9] Meyers A, et al. Expression of HIV-1 antigens in plants as potential subunit vaccines[J]. BMC Biotech-nology, 2008, 8(53):1-15.
[10] Abdoreza DS, Nalapalli S, Henry D. The green vaccine:A global strategy to combat in factious and autoimmune diseases[J]. Hum Vaccin, 2009, 5(7):488-493.
[11] Horsch RB, Fry JE, et al. A simple and general method of transferring genes into plants[J]. Science, 1985, 227:1229-1231.
[12] Jefferson RA, Kavanagh, Bevan MW. GUS fusion:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. EMBO J, 1987, 6(13):3901-3907.
[13] 王关林, 方宏筠. 植物基因工程原理与技术[M]. 北京:科学出版社,1998.
[14] O’Harte FP, Mooney MH, Lawlor A, et al. N-terminally modified glucagon-like peptide-1(7-36)amide exhibits resistance to enzymatic degradation while maintaining its antihyperglycaemic activity in vivo[J]. Biochimica et Biophysica Acta, 2000, 1474(1):13-22.
[15] 黄静, 徐进, 左翼, 等. 重组人胰高血糖素样肽-1的表达及生物学活性[J]. 中国生物工程杂志, 2006, 26(1):50-55.
[16] Kozak M. Compilation and analysis of sequences upstream from the translational start site in eukaryotic mRNAs[J]. Nucleic Acids Res, 1984, 12(2):857-872.
[17] 杜小春, 何正权, 陈磊. 植物生物反应器表达药用蛋白研究新进展[J]. 中国生物工程杂志, 2008, 28(9):135-143.
[18] Yasuda H, Tada Y, Hayashi Y, et al. Expression of the small peptide GLP-1 in transgenic plants[J]. Transgenic Research, 2005, 14(5):677-684.
[19] 路宝玉. 烟叶和烟气中化学成分及其危害[J]. 中国公共卫生, 1997, 13(6):322-323.
[20] 杨振泉, 刘巧泉, 焦新安. 利用转基因植物表达药用蛋白[J]. 中国生物工程杂志, 2004, 24(3):22-25.
