复合EST-SSR标记在大白菜品种鉴定中的应用
2013-12-23赵新王永兰青阔陈锐李欧静余景会朱珠郭永泽
赵新 王永 兰青阔 陈锐 李欧静 余景会 朱珠 郭永泽
(天津市农业质量标准与检测技术研究所,天津 300381)
大白菜(Brassica campestris L. ssp. pekinensis)为十字花科芸薹属叶用蔬菜,原产于我国,营养丰富,易于储存,因此广受欢迎。大白菜品种繁多,不同品种的栽培技术、食用价值和经济价值也存在差异,因此对市售种子品种的鉴别非常关键,尤其是在农户播种之前利用最短的时间鉴别出种子品种的真实性,有效地降低劳动成本和经济损失尤为重要。传统的田间形态学观察是种子品种鉴定较为常用的方法,但时间较长且易受环境条件的影响,结果可能存在偏差,因此需要一种更加高效、准确并且操作简便的分子水平品种鉴定方法[1]。同时新品种的登记、测试,以及品种间的遗传距离聚类分析也需要相关的分子辅助手段[2]。
近年来出现了多种分子生物学标记技术,简单重复序列SSR 标记(也称微卫星技术)是其中的一种,与其他分子标记技术相比具有多态信息含量高、共显性遗传、技术简单、重复性好、特异性强等特点[3,4],并且在杂交种品种鉴定中得到了大量应用。随着功能基因组学的迅速发展,GenBank中积累了许多重要物种的大量EST序列,这些序列获取简便,没有任何费用,已经成为发展SSR标记的重要来源,因此基于表达序列标签(expressed sequence tags,EST)的微卫星(simple sequence repeats,SSR)标记技术不仅保留了SSR标记技术的所有优点,而且凸显了其便捷、花费低、效率高的优势;但SSR技术也存在着相对的不足,即一次试验得到的位点较少,针对这一问题Tommasini等[5]发展了多重SSR分析技术,并有效地鉴定了油菜品种。
本研究以12份大白菜杂交种为试验材料,利用新型分子标记复合EST-SSR进行大白菜品种鉴定研究,筛选其多态性特异谱带,并以该谱带作为分子标记对其品种进行区分。
1 材料与方法
1.1 试验材料
试验材料为12份市售大白菜杂交种,由天津科润蔬菜研究所提供,具体信息见表1。
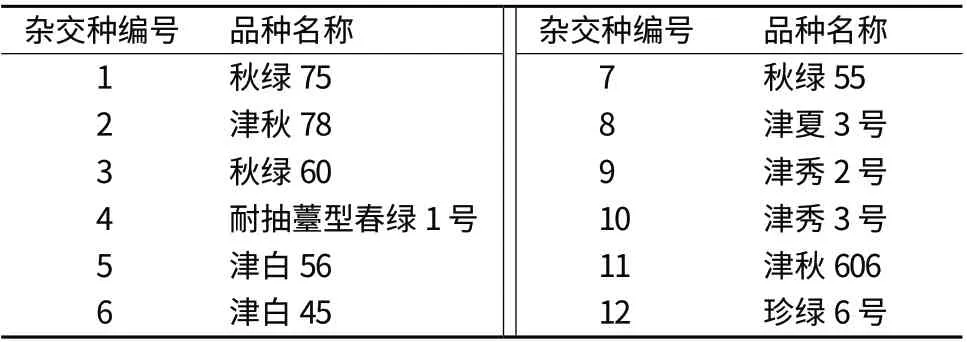
表1 品种名称及编号
1.2 方法
1.2.1 EST-SSR引物的开发 利用GenBank上公布的大白菜EST序列,设计合成30对核心引物,命名为BC1-BC30,引物由上海生工合成。
1.2.2 大白菜基因组DNA提取 利用改良CTAB法[6]分别提取12份大白菜杂交种叶片基因组DNA,将获得的植物组DNA用1%的琼脂糖凝胶电泳检测。
1.2.3 引物筛选 以大白菜杂交种的基因组DNA为模板,分别对30对EST-SSR引物进行扩增,扩增产物用8%聚丙烯酰胺凝胶电泳进行分离、染色,在能够得到有效扩增的引物中筛选多态性高的特异谱带,同时结合单一引物品种鉴定结果及特异谱带的相互位置差异,优化组合多个引物对,筛选复合EST-SSR标记。
1.2.4 PCR扩增体系及程序 PCR扩增反应的总体积为10 μL,扩增反 应体系为:2×GoTaq®Master Mixes 5 μL,上下游引物10 μmol/L各0.25 μL(Ⅰ套EST-SSR复合引物中BC1上游引物、BC1下游引物、BC19上游引物、BC19下游引物、BC26上游引物、BC26下游引物均等量混合各0.25 μL;或Ⅱ套ESTSSR复合引物中BC1上游引物、BC1下游引物、BC9上游引物、BC9下游引物、BC10上游引物、BC10下游引物、BC16上游引物、BC16下游引物、BC27上游引物、BC27下游引物均等量混合各0.25 μL),供试品种大白菜基因组DNA模板,浓度50 ng/μL,1 μL,双蒸水补足10 μL。PCR反应程序:94℃预变性5 min;94℃ 1 min,53.5℃ 45 s,72℃ 45 s 35个扩增循环;72℃延伸7 min,4℃保存。
1.2.5 数据分析及聚类图谱构建 根据聚丙烯酰胺凝胶电泳图谱,每个样品的特异性谱带按照相互位置差异在相同迁移率位置上进行有无的“1,0”标注,根据标注结果计算2套引物的多态率和多态信息量(PIC),分析2套引物对12份大白菜品种的鉴定结果,并应用NTSYS聚类分析软件构建12份大白菜品种的聚类图谱。
2 结果
2.1 大白菜叶片基因组DNA的提取
利用改良CTAB方法提取大白菜叶片基因组DNA,用1%的琼脂糖凝胶电泳检测。结果(图1)显示,所提取的基因组DNA主带清晰,整齐一致,无明显降解,可用于下一步PCR扩增。

图1 大白菜基因组DNA电泳图
2.2 引物筛选结果
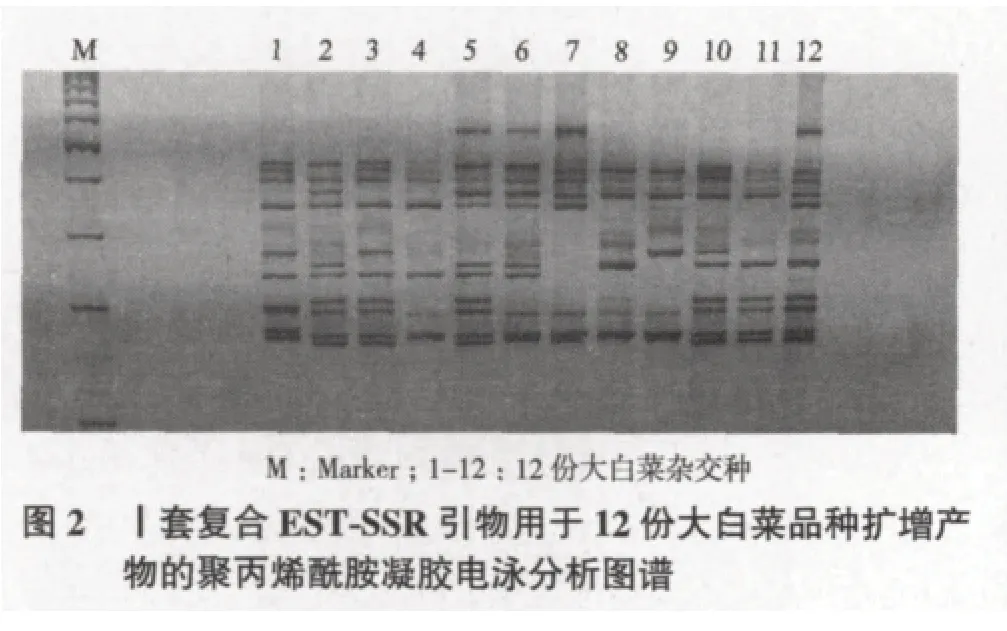
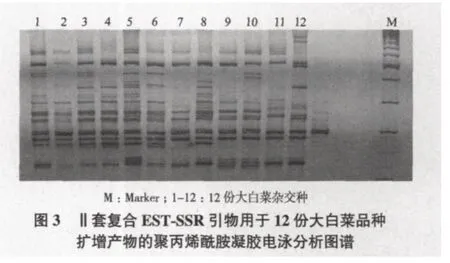
利用SSR技术对天津科润蔬菜研究所提供的大白菜杂交种进行了特异性分子标记分析,共利用30对EST-SSR引物进行了PCR扩增,其中21对得到有效扩增,10对具有较高的多态率及多态信息量,根据这10对引物扩增条带的相互位置差异,进行优化组合,确定了2套复合引物可对12份大白菜品种进行完全的区分。引物序列见表2,应用2套复合引物对12份大白菜进行品种鉴定的聚丙烯酰胺凝胶电泳图谱如图2、图3所示。

表2 引物序列
2.3 复合标记12份大白菜品种的多态性分析及聚类分析结果
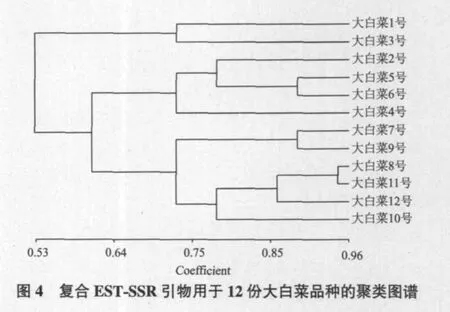
通过分析EST-SSR结果,比较12份大白菜品种间多态性位点的差异,确定2套复合引物的多态率及多态信息量;在相同迁移率位置上进行“1,0”标注,构建12份大白菜品种的SSR分析谱带数据(表3),通过数据分析复合引物是否可对12份大白菜品种进行完全的区分,同时构建12份大白菜品种的聚类图谱(图4)。

表3 复合EST-SSR引物组合鉴定大白菜品种的多态性分析
3 讨论
随着植物育种和种子产业的发展,植物新品种保护(Protection of New Varieties of Plant,简称PVP)作为知识产权的10种内容之一,其重要性越来越突出。培育和推广新的优良品种是我国蔬菜育种发展的重要方向,因此新品种的准确鉴定不仅是新品种审定和保护的前提,也为辨别假冒伪劣种子,保护自身知识产权,维护育种农家的切身利益提供保障和科学依据。因此,开发高效、准确的种子品种鉴定方法已成为种子科研单位和企业共同关注的课题。
近年来随着分子生物学的发展,遗传标记经过形态学标记、细胞学标记、蛋白质标记已经发展到了DNA水平的标记。各种DNA标记技术在杂交种品种鉴定中层出不穷,EST-SSR是近几年建立的新型分子标记技术,目前已应用于水稻、小麦、高羊茅、黑杨等[7-10]植物的分子连锁图谱构建和遗传多样性分析,证明了EST-SSR标记进行品种鉴定的可行性,该技术具有稳定性高、共显性、重复性好等特点,而且开发成本相对低廉。
为了进一步提高EST-SSR的多态性,更加高效地进行相关物种的品种鉴定,本研究以大白菜为试验材料,摸索了多重EST-SSR的反应体系和反应条件,构建了2套复合EST-SSR引物组合可完全对12份大白菜品种进行区分。复合引物标记的构建需要根据单一引物的相互位置差异进行优化组合,使单一引物的扩增片段处在不同片段大小的区域,避免复合标记的重叠性。复合EST-SSR标记对大白菜杂交品种具有很好的区分效果,可通过一次反应检测到高水平的多态性,同时所建立的试验组合、方法和思路,具有一定的推广性,不仅仅局限于12份大白菜品种的鉴定,通过对30对核心引物的组合优化,可以对更多的大白菜品种进行标记和鉴定的研究,进而为有效地解决大白菜杂交种的鉴别问题提供技术参考。本研究的检测方法在不计算DNA提取过程耗时的情况下,PCR耗时2 h,EST-SSR分析60-90 min,所以本发明的检测方法在4 h之内即可完成对大白菜品种的鉴定工作,具有高效、低成本、操作方便等优势。
4 结论
本研究仅以12份市售大白菜品种为例,通过EST-SSR标记的特异谱带进行聚类分析,表明12份大白菜品种两两间的相似系数在0.53-0.96之间,平均值为0.75,以遗传相似系数0.96为标准,复合EST-SSR引物组合扩增的特异性谱带数据,能将市售大白菜的12份品种完全区分开。这些研究方法和结果对建立大白菜新种质、新品种保护以及种苗质量仲裁检验等都具有重要意义。
[1] 赵新, 王永, 兰青阔, 等. EST-SSR标记在大白菜杂交种种子纯度鉴定中的应用[J].分子植物育种, 2012, 10:1145-1150.
[2] 李丽, 郑晓鹰.用于白菜和大白菜品种鉴定的EST-SSR复合标记的建立[J].园艺学报, 2009, 36(11):1627-1634.
[3] 忻雅, 崔海瑞, 卢美贞, 等.白菜EST-SSR信息分析与标记的建立[J].园艺学报, 2006, 33(3):549-554.
[4] Powell W, Machray GC, Provan J, et al. Polymorphism revealed by simple sequence repeats[J]. Trends Plant Science, 1996, 1(7):215-222.
[5] Tommasini L, Batley J, Arnold GM, et al. The development of multiplex simple sequence repeat(SSR)markers to complement distinctness, uniformity and stability testing of rape(Brassica napus L.)varieties[J]. Theor Appl Genet, 2002, 106:1091-1101.
[6] 王永, 兰青阔, 张莉, 等.改良Chelex-100法和CTAB法用于转基因抗草甘膦大豆检测效果的比较[J].大豆科学, 2008, 27(5):898-901.
[7] Cho YG, Ishii T, Tenmykh S, et al. Diversity of microsatellites derived from genomic libraries and GenBank sequences in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics, 2000, 100:713-722.
[8] Eujayl I, Sorrells ME, Baum M, et al. Assessment of genotypic variation among cultivated durum wheat based on EST-SSRs and genomic SSRs[J]. Euphytica, 2001, 119:39-43.
[9] 段乃彬, 王建成, 于天祥, 等.高羊茅EST-SSR标记的开发及品种鉴定[J].山东农业科学, 2010, 10:7-10.
[10] 张亚东, 胡兴宜, 宋丛文, 等.利用新型分子标记EST-SSR鉴定湖北省内的主栽黑杨品种[J].分子植物育种, 2009, 7(1):105-109.
