人源EFA6A蛋白Sec7结构域的克隆表达与纯化
2013-12-23谢长林芮斌江娜赵晨唐雅珺文汉
谢长林 芮斌 江娜 赵晨 唐雅珺 文汉
(1.安徽农业大学生命科学学院,合肥 230036;2.中国科学技术大学生命科学学院,合肥 230026)
小GTP酶广泛地参与真核生物细胞中的各项生命活动,发挥着十分重要的作用[1]。Arf家族是一类最先被报道的小GTP酶,主要功能是参与膜运输和细胞骨架的装配,其成员包括Arf1-6[2]。其中,Arf6在它的信号通路中,通过调节细胞膜和细胞骨架的动力学活性来实现胞内生物膜系统的循环和细胞骨架的装配[3]。越来越多的研究揭示,Arf6还对胞外分泌的调节[4,5]、胞质分裂[6]、肿瘤细胞的迁移[7]、细胞的吞噬作用[8]发挥着重要的作用。同其他小GTP酶一样,一些特异性的GEFs和GAPs调节Arf6的活性,和它一起参与到细胞内的各项生命活动中。GEF的催化机制是通过剥落结合在Arf6上的GDP,使Arf6能够重新与GTP结合,并从失活态转变为活性态[9]。
人EFA6家族都是Arf6的GEF,包含4个成员:EFA6A、EFA6B、EFA6C和EFA6D。EFA6A在脑组织中高表达,GEF缺陷型EFA6A在神经细胞形态上有利于树突的形成[10]。过表达EFA6A会促进海马神经元细胞的神经棘生长[11]。它通过调节Arf6和胞外信号调节蛋白的活性,促进细胞的迁移和侵袭[12]。EFA6A在神经胶质瘤细胞迁移中也发挥作用,另一方面它通过调节自身在神经细胞中的表达量来参与到神经细胞的精加工活动中[9]。EFA6A包含3个结构域:负责定位于膜上的PH结构域、调节肌动蛋白细胞骨架装配的Coiled-coil Motif结构域和具有催化鸟苷酸交换作用活性的Sec7结构域。这些结构域在EFA6家族中都是十分保守的[13]。
本研究拟从人脑cDNA文库中克隆出Sec7结构域的基因序列,再亚克隆至p28a表达载体中。将重组质粒转化至宿主菌BL21-Gold(DE3)中,IPTG诱导表达,旨在为其结构和功能的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒与细菌 p28a质粒:pet28a(Thrombin)改造后的新型载体,宿主菌DH5α和BL21-Gold(DE3)菌、人脑cDNA文库。以上均由中国科技大学施蕴渝教授实验室提供。
1.1.2 酶和试剂 Primer Star来自TaKaRa公司,限制性内切酶Nde I、Xho I和T4 DNA连接酶来自Fermentas公司。质粒抽提试剂盒和胶回收试剂盒是OMEGA公司产品。
1.2 方法
1.2.1 生物信息学软件分析、引物的设计与合成 从Uniprot搜索EFA6A的边界信息,初步选取450-740 aa长度的氨基酸序列作为Sec7结构预测的起始片段。依据Jpred预测的结果,分析PDB(Protein Date Bank)中同源Sec7的结构特点,确定本研究重组表达的Sec7的边界为506-719,共214 aa。根据已测序的人EFA6A的基因序列,设计一对针对Sec7基因片段的引物,在上游引物加入Nde I酶切位点,在下游引物中加入Xho I酶切位点,引物由上海英骏有限公司合成。上游引物:5'-ACGTCATATGGAGGACAGCCTTGGGCTGGGGGCAG-3',下游引物:5'-GCTACTCGAGTCAGCGTCTCAGCTCCTCCTCGTCT-3'(下划线为Nde I及Xho I酶切位点)。
1.2.2 Sec7基因的克隆 运用Touchdown PCR法(程序如表1)从人脑cDNA文库中钓取目的基因。程序结束后用1%(W/V)琼脂糖凝胶电泳回收纯化目的基因片段。目的基因片段经Nde I和Xho I双酶切后,亚克隆至表达质粒p28a中,16℃过夜连接,将连接产物转化至感受态细胞DH5α中,卡纳抗生素平板筛选后挑取3个单克隆,将初步鉴定为阳性的克隆送至上海华大基因测序。
1.2.3 Sec7的诱导表达 比对测序结果,经序列吻合的特异性重组子编号保种。运用试剂盒抽提重组质粒并转化至感受态细胞BL21-Gold(DE3)中。挑取单菌落接种于含50 mg/L卡那抗生素的5 mL LB培养基中37℃过夜培养。隔天,1∶20扩大培养至100 mL LB中,37℃培养至OD为0.8-0.9后,加入终浓度为0.3 mmol/L IPTG、诱导温度16℃、时间24 h。
1.2.4 Sec7的Ni-NTA柱和分子筛纯化 目的蛋白诱导24 h后,6 000 r/min离心10 min收菌,50 mL Binding Buffer (20 mmol/L Tris,500 mmol/L NaCl,pH8.0)重悬菌体后超声破碎8 min,13 000 r/min离心30 min取上清。当离心破碎液时,再生Ni-NTA柱,待离心结束后,取上清,流穿Ni-NTA柱。上清流穿结束后,Binding Buffer洗脱10 mL,Wash Buffer(30 mmol/L imidazole+Binding Buffer)洗脱50 mL,Elution Buffer (300 mmol/L imidazole +Binding Buffer)洗脱20 mL。将含有目的蛋白的Elution溶液浓缩至5 mL,上样Superdex200柱,目的峰接样后12%SDS-PAGE蛋白电泳胶查看目的蛋白状态。
2 结果
2.1 生物信息学软件分析结果
Sec7结构域在GEF-EFA6家族中非常保守,PDB中已知的同源Sec7的结构一般由9-11个α螺旋组成。Uniprot中提供的Sec7边界信息为521-706。Jpred预测的Sec7结构域边界为541-716,包含10个α螺旋,与同源的Sec7的α螺旋数相符。综合所有信息学软件的分析结果,为了保证所有的α螺旋能够被完整表达,此次试验向N、C两端各自延长了数量不等的氨基酸,最终确定边界为506-719(图1)。

图1 EFA6A的结构域全图
2.2 Sec7基因的克隆
以人脑cDNA文库为模板,利用特异性引物进行PCR引物扩增,扩增产物经1%(W/V)琼脂糖凝胶电泳检测,在约700 bp左右的地方有一条特异性的DNA条带(图2),与预期的结果一致。

图2 PCR电泳结果
2.3 表达载体的构建、PCR鉴定和测序
双酶切目的片段回收纯化后与p28a载体连接,将重组质粒转化至感受态DH5α中,过夜37℃培养。挑取3个单克隆,菌液PCR结果均为阳性克隆(图3),同时送样测序。测序结果表明,3个阳性克隆的目的基因序列与Sec7(506-719)基因序列完全吻合。

图3 菌液PCR鉴定结果
2.4 Sec7蛋白的Ni-NTA柱、分子筛纯化和SDSPAGE电泳分析
将表达质粒转化至感受态BL21-Gold(DE3)细胞中,诱导表达后,经Ni-NTA柱纯化的蛋白组份跑SDS-PAGE电泳。结果(图4)表明,上清液在约25 kD处有一条明显的特异带,与目的蛋白分子量基本吻合。从流穿液的电泳结果来看,目的蛋白与Ni柱的结合效果良好,且Elution洗脱液中目的蛋白纯度较高。500 mmol/L EDTA洗脱液中没有发现目的蛋白的存在,说明目的蛋白已经被洗脱干净。

图4 Ni-NTA柱纯化的SDS-PAGE电泳图
将Elution Buffer的洗脱液浓缩至5 mL,上样Superdex200柱,波长280 nm层析图谱结果(图5),接样后取目的峰的峰尖处蛋白样品,SDS-PAGE电泳查看蛋白状态。
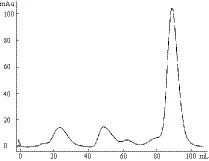
图5 Sec7蛋白Superdex200分子筛 U280峰图
尽管Elution的SDS-PAGE电泳结果显示,Ni柱纯化后的目的蛋白纯度较高,但是从波长280 nm层析图谱可以看出,在Sec7目的峰出现前仍有较多杂质的峰,需要分子筛进行后续纯化。将Sec7的目的峰接样,总体积约为12 mL,取样SDS-PAGE电泳结果(图6)显示蛋白质条带单一,无杂带出现,经检测蛋白纯度高于95%。将分子筛后的样品,超滤浓缩后至500 μL,目的蛋白浓度为7 mg/mL。蛋白质每经一次纯化理论损失量约为25%,经换算,Sec7上清表达量应为70 mg/L(LB液体培养基的体积)。

图6 分子筛纯化SDS-PAGE电泳图
3 讨论
Sec7结构域在EFA6家族里是高度保守的一个结构域,作为GEF的核心结构域,主要承担着催化鸟苷酸交换反应的功能。目前的PDB中还没有EFA6家族Sec7结构域的结构信息,这局限了我们了解Sec7结构特点及结构与其功能之间的联系。
现有的解析蛋白质结构的方法大都建立在得到高纯度、稳定、均一的重组蛋白的基础上。运用现有的生物信息学技术,选择恰当的边界、合适的载体以及相对应的表达纯化方法是获得理想重组蛋白的重要手段。
本试验在边界选择方面综合了生物信息学软件Jpred的预测结果、Uniprot提供的信息和PDB中同源Sec7的结构特点,选取适宜的结构域边界,设计引物,通过优化PCR的程序,成功从人脑cDNA文库中扩增出了Sec7的目的基因片段。根据后续的试验结果显示,此次边界的选择有利于Sec7的高效表达,突出了现有生物信息学软件对此次试验的指导意义。
试验还使用了一种改造后的新型表达载体p28a,p28a载体是由pET28a(+)载体改造而来。pET28a(+)载体表达的重组蛋白一级序列为:MGSSHHHHHHSSGLVPRGSHM+目的蛋白一级序列(下划线为Thrombin酶识别的氨基酸序列),经酶切后的重组蛋白一级序列为GSHM+目的蛋白。经过改造后的p28a载体表达的重组蛋白一级序列为:MGHHHHHHM+目的蛋白,N端含有6个His的标签,用于Ni柱纯化,纯化后标签无需酶切,避免了蛋白在酶切时发生的沉淀和降解等不利因素,同时也降低了纯化蛋白的经济成本。
Ni-NTA柱纯化后,蛋白状态经SDS-PAGE检测纯度较高,但从分子筛的波长280 nm层析图谱上看,在目的峰出现以前仍然有很多的杂质峰,这不仅反映了SDS-PAGE检测方法的缺陷,更突出了分子筛二次纯化的必要。后者在起纯化作用的同时,也能反映蛋白的纯度、状态和稳定性,为得到优良的蛋白样品提供了有力保障。
4 结论
通过优化PCR程序成功从人脑cDNA文库扩增出人EFA6A的Sec7结构域的基因序列。将目的基因片段亚克隆至p28a表达载体中,测序结果与NCBI中的序列完全吻合。将表达载体转化至BL21-Gold(DE3)中,在终浓度0.3 mmol/L IPTG、16℃、24 h情况下成功表达。重组的Sec7表达量高(70 mg/L),易于纯化,状态稳定,性质均一,纯度高于95%。
[1] Anders N, Jürgens G. Large ARF guanine nucleotide exchange factors in membrane trafficking [J]. Cell Mol Life Sci, 2008, 65:3433-3445.
[2] Gillingham AK, Munro S. The small G proteins of the Arf family and their regulators [J]. Annu Rev Cell Dev Biol, 2007, 23:579-611.
[3] D'Souza-Schorey C, Chavrier P. ARF proteins:roles in membrane traffic and beyond [J]. Nat Rev Mol Cell Biol, 2006, 7(5):347-358.
[4] Caumont AS, Galas MC, Vitale N, et al. Regulated exocytosis in chromaffin cells[J]. Journal of Biological Chemistry, 1998, 273(3):1373-1379.
[5] Yang CZ, Mueckler M. ADP-ribosylation factor 6 (ARF6) defines two insulin-regulated secretory pathways in adipocytes[J]. Journal of Biological Chemistry, 1999, 274(36):25297-25300.
[6] Schweitzer JK, D’Souza-Schore C. Localization and activation of the ARF6 GTPase during cleavage furrow ingression and cytokinesis[J]. The Journal of Biology Chemistry, 2002, 277(30):27210-27216.
[7] Hashimoto S, Onodera Y, Hashimoto A, et al. Requirement for Arf6 in breast cancer invasive activities[J]. The PNAS Journal, 2004, 101(17):6647-6652.
[8] Niedergang F, Colucci-Guyon E, Dubois T, et al. ADP ribosylation factor 6 is activated and controls membrane delivery during phagocytosis in macrophages[J]. The Journal of Cell Biology, 2003, 161(6):1143-1150.
[9] Sironi C, Teesalu T, Muggia A, et al. EFA6A encodes two isoforms with distinct biological activities in neuronal cells [J]. Journal of Cell Science, 2009, 122(12):2108-2118.
[10] Sakagami H, Matsuya S, Nishimura H, et al. Somatodendritic localization of the mRNA for EFA6A, a guanine nucleotide exchange protein for ARF6, in rat hippocampus and its involvement in dendritic formation[J]. European Journal of Neuroscience, 2004, 19(4):863-870.
[11] Choi S, Ko J, Lee JR, et al. ARF6 and EFA6A regulate the development and maintenance of dendritic spines[J]. The Journal of Neuroscience, 2006, 26(18):4811- 4819.
[12] Li M, Ng SS, Wang J, et al. EFA6A enhances glioma cell invasion through ADP ribosylation factor 6/extracellular signal-regulated kinase signaling[J]. Cancer Research, 2006, 66:1583-1590.
[13] Franco M, Peters PJ, Boretto J, et al. EFA6, a Sec7 domain-containing exchange factor for ARF6, coordinates membrane recycling and actin cytoskeleton organization[J]. The EMBO Journal, 1999, 18(6):1480-1491.
