模拟微重力对拟南芥幼苗的生物学效应
2013-12-23吴承菲郭双生赵琦孙建锋
吴承菲 郭双生 赵琦 孙建锋
(1.首都师范大学生命科学学院,北京 100048;2.中国航天员科研训练中心,北京 100094)
近年来,随着国际空间站的建成和载人航天技术的进步,空间生命科学和空间生物技术领域的研究发展迅猛。有关微重力,最早是指空间飞行器在轨飞行时,离心力与地球引力相平衡,飞行器舱内物体处于接近零重力的状态,即微重力状态[1]。对于微重力下的生物学研究可采用空间搭载和地面模拟方式进行。地面模拟微重力通常采用回转器,主要是当样品在回转器上时,生物体处于重力场中,受到恒定的重力矢量作用。但是,由于回转器的转动,作用于物体上的重力,方向不断改变,由于重力方向改变,使生物体来不及感受重力的作用(每种生物都有一个最低感受时间或响应时间阈值),而产生类似于微重力环境的现象[2]。通过空间飞行及回转器研究表明,微重力会影响植物体的生长和发育,并会引起植物体生理特性的变化,同时相关基因的差异表达也会发生改变。20世纪90年代开始,随着空间搭载机会的增加,空间实验站的不断建立,地面模拟实验的不断丰富和细胞分子生物学研究技术的创新,空间细胞生物学研究成果层出不穷。
1 材料与方法
1.1 材料
拟南芥是野生的双子叶草本植物,喜湿润,不耐旱,生长周期短。将少量拟南芥Columbia种子在培养间(22℃,空气相对湿度≥65%,16 h 光照/8 h 黑暗)进行扩繁,待成熟饱满后获取种子并密封,4℃保存。
1.2 方法
1.2.1 拟南芥幼苗培养 将拟南芥Columbia种子灭菌15 min后春化2 d,播种于1/2MS培养基上,22℃,在光照培养箱中培养,16 h 光照/8 h 黑暗,处理样品放置水平回转仪(中科院生物物理所提供)上,2 r/min;对照组(CK) 在实验台上培养。培养8 d 后采收。
1.2.2 幼苗株高、鲜重的测定 从生长第3天开始,测量处理和对照的拟南芥幼苗的株高、根长、下胚轴长度,直到第8天。在第8天测定幼苗的鲜重。
1.2.3 叶绿素含量测定 参照Arnon (1949) 的方法。待第8天采收后,用80%丙酮室温、黑暗条件下提取叶绿素,分别于646 nm 和663 nm 处测定吸光度,根据Lichtenehaler和Wallbum 的修正公式计算叶绿素a、b、叶绿素(a+b) 的含量及叶绿素a/b的值。
1.2.4 活性物质含量测定 待第8天拟南芥幼苗采收后,充分研磨,分别测定维生素C(Vc) 、超氧化物歧化酶(SOD) 、过氧化物酶(POD) 、过氧化氢酶(CAT) 的含量(南京建成公司提供的试剂盒)。丙二醛(MDA) 含量的测定采用硫代巴比妥酸(TAB) 法、脯氨酸(pro) 含量的测定采用酸性茚三酮法。
1.2.5 叶片钙离子分布的检测 钙荧光探针指示剂法是利用与钙离子结合探针并发出荧光的方法来检测钙离子的浓度,这种钙离子指示剂有很高的钙离子亲和能力,能检测出低浓度的钙离子。按照文献[3]采用Fluo-3/AM作为检测细胞钙离子浓度的荧光探针。利用激光共聚焦荧光显微镜观察试验材料。(1)取培养8 d的拟南芥根尖置于100 μL MS液体培养基中;(2)加入1 μL 1 mmol/L Fluo-3/AM,混匀;(3)4℃避光处理2 h,取出后用MS洗2次;(4)室温下避光放置2 h;(5)激光共聚焦显微镜观察,波长为488 nm,记录并照相。
1.2.6 拟南芥幼苗RNA的吸光值的测定
1.2.6.1 总RNA的提取 拟南芥幼苗RNA 的提取采用Trizol法(Invitrogen 公司提供)。试验步骤:(1) 称取100 mg新鲜拟南芥组织加液氮速冻后充分研磨成干粉,转入 1.5 mL离心管中,加入1 mL Trizol,混匀,室温下静置3-5 min;(2)每1 mL Trizol加200 mL氯仿,盖紧管盖,剧烈振摇15 s,放置5 min;(3)4℃,12 000 r/min离心15 min;(4)RNA存在于上层水相,将上层水相转移至新离心管,做好标记;(5)加500 μL异丙醇,-20℃沉淀30 min以上,4℃,12 000 r/min离心10 min;(6)弃去上清,加入1 mL 75%乙醇(用DEPC水配制),洗涤沉淀物,4℃,12 000 r/min离心10 min;(7)吸弃乙醇,空气中干燥5-10 min;(8)RNA略显透明,加入30-50 μL RNase-free Water,充分溶解。
1.2.6.2 总RNA的定量与RNA纯度检测 (l)紫外分光光度计测定RNA的产量:测定RNA溶液的OD260,按照1个OD260=40 μg/mL计算;(2)RNA纯度检测:测定样品在260 nm和280 nm下的吸光值,OD260/OD280的比值在2.0附近为佳。
2 结果
2.1 模拟微重力对拟南芥幼苗生长发育的影响
2.1.1 对幼苗向性的影响 观察生长8 d的拟南芥幼苗,可以明显看出,正常重力条件下的拟南芥幼苗茎向上生长,根直立向下生长;而模拟微重力条件下的幼苗生长没有方向性,茎和根都呈现不定向生长,根呈弯曲状(图1),说明模拟微重力影响植物的生长方向。

图1 SM条件下(A)和CK条件下(B)拟南芥幼苗图
2.1.2 对幼苗株高的影响 分别对幼苗的株高、根长、下胚轴长度进行了测定,模拟微重力下生长8 d 的幼苗株高比对照低,在3-5 d 时,处理的幼苗的株高、根长比对照长,而5 d之后,处理的株高和根长都比对照短;而且,下胚轴长度比对照长约0.804 mm(表1),说明模拟微重力影响植物的生长。
2.2 模拟微重力对拟南芥幼苗生理特性的影响
2.2.1 对幼苗光合特性的影响 光合作用中叶绿体对光能的捕获、传递和转化主要是通过叶绿素a 和叶绿素b完成的。分别测定了生长8 d的处理和对照的幼苗的叶绿素含量,处理的幼苗的叶绿素a和叶绿素b的含量均高于对照组,但叶绿素a/b的比值有所下降。光合速率测定结果表明,对照与处理的光合速率无显著差异,说明微重力环境会提高拟南芥的叶绿素含量,而对光合作用效率无显著影响。
2.2.2 模拟微重力对幼苗活性物质含量的影响 用试剂盒和紫外分光光度计分别测定维生素C(Vc) 、超氧化物歧化酶(SOD) 、过氧化物酶(POD) 、过氧化氢酶(CAT) 的含量。处理的Vc含量减少,而POD、SOD和CAT含量却高于对照。而且,通过对丙二醛(MDA)和脯氨酸(pro)含量的测定发现,处理的丙二醛与脯氨酸含量明显高于对照。
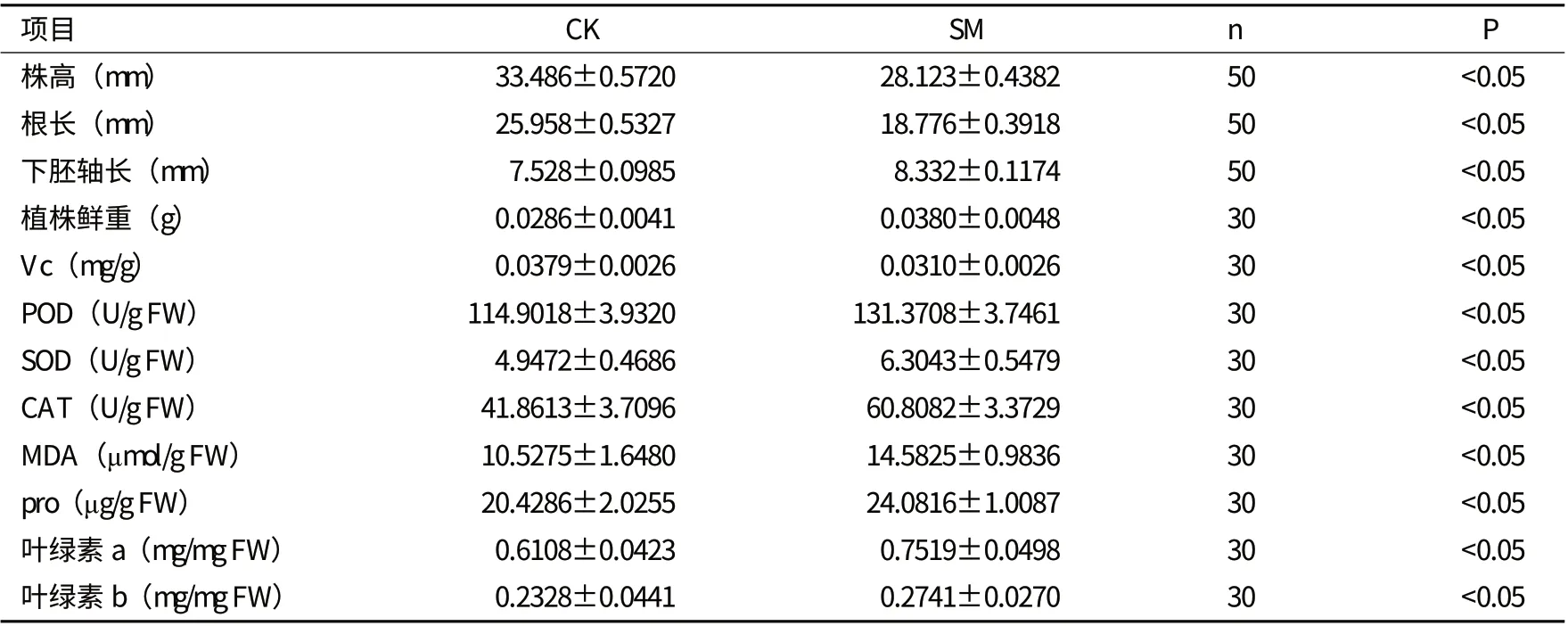
表1 模拟微重力(SM)与正常重力(CK)条件下拟南芥生理生化指标测定数据
2.3 模拟微重力影响幼苗叶片的钙离子分布
Fluo-3荧光染料与游离钙离子结合可发出绿色荧光,在激光共聚焦显微镜下观察发现,处理的拟南芥叶片细胞壁的绿色荧光十分明显,如图2所示。

图2 正常重力条件下(A)与模拟微重力条件下(B)拟南芥叶肉细胞钙离子分布
2.4 模拟微重力对基因表达的影响
生物体在重力改变的情况下,生长代谢、遗传发育、生理特性及显微结构的变化都是由基因调控的。本实验室在R平台上用ANOVA的方法挑选出模拟微重力处理6 d的差异基因和模拟微重力处理1 d的差异基因。基因芯片结果表明,模拟微重力处理6 d后的拟南芥差异表达的基因有450个,上调表达201个,下调表达249个,上调倍数最大为4.25,下调倍数最小为0.37;在模拟微重力处理1 d后拟南芥差异表达的基因有365个,上调表达136个,下调表达229个,上调倍数最大为2.19,下调倍数最小为0.43。
3 讨论
室外培养的拟南芥种子一般春季萌发,到夏季即种子成熟,因此,生殖生长延缓,生活周期过长,不利于加快实验进程。而室内培养是将种子播撒于营养土、蛭石、素沙按体积比1∶1∶1均匀混合的培养介质中,该方法使用的培养介质既有拟南芥苗期根系生长所需的透水和透气性,又能为拟南芥后期生长提供养分,且水、肥和气均供应均衡一致,且室内培养的成活率较高,生长健壮,生长发育进程快且整齐,因此能最好的发挥拟南芥个体小和生育期短的优势,降低生物实验系统误差。
许多文献提出,微重力环境对于正常生长的植物来说是一个逆境条件,改变重力的大小和方向都会影响植物的代谢、生长、发育、繁殖及应激反应等[5,6]。植物在正常的重力下,根向下生长,茎向上生长。在微重力环境下,根的生长方向依种胚所处的方位而定。地上部生长取决于光源的位置,在微重力场中向光性弯曲更加明显,因此,茎和根都呈现不定向生长,根呈弯曲状。目前,已有多项研究表明模拟微重力会影响植物的细胞形态和植物细胞的亚显微结构[7]。有人报道,太空飞行的豌豆幼苗根细胞变长,表面积变大,而细胞核变小。有研究者[8]采用马铃薯、香石竹、草莓及人参果的试管幼苗作为试验材料,分别置于正常重力环境中和模拟微重力环境中,待生长8 d后,对4种植物的电镜切片观察发现,模拟微重力对植物细胞亚显微结构产生了影响:细胞壁收缩呈不规则多角形,细胞之间联结松散,而且叶绿体片层结构明显弯曲、疏松和膨化,并且变得模糊。线粒体表面的膜粗糙、嵴不明显、结构松散。Popova等[9]观察了飞行10.5 d 和18 d 的小球藻细胞发现细胞分裂受到干扰,类囊体腔膨胀,叶绿体出现电子半透明区。同时,类囊体相对体积减小。黄伟等[8]观察玉米在微重力下会导致细胞出现畸形核,这可能与细胞骨架遭到破坏有关。POD、SOD和CAT是植物体内活性氧清除系统中的3种重要保护酶,它们能够有效阻止活性氧在植物体内的积累。因此,POD、SOD和CAT活性的升高反映出植物在逆境下,能通过自身防御机制对有害物质做出保护性应激反应[10-12]。我们的试验结果表明,模拟微重力处理后3种抗氧化酶活性均有不同程度的提高,表明拟南芥幼苗对微重力刺激作出了保护性应激反应。而Vc是植物体内抗氧化的成分,体内活性氧的增加会导致Vc的含量发生变化,Vc的抗氧化功能同样可以防止活性氧对植物组织的破坏。在防御应激过程中,植物体消耗了大量的Vc,因此,Vc含量的下降同样也说明拟南芥幼苗对微重力刺激作出了保护性应激反应。MDA是膜脂过氧化的主要产物之一,具有细胞毒性,能引起细胞膜功能紊乱[13]。模拟微重力处理后,拟南芥体内活性氧含量增加,导致MDA的升高,说明模拟微重力类似于逆境刺激。因此,造成MDA升高。钙离子是真核生物中调节细胞信号转导的第二信使,钙离子参与植物应激、抗逆、抗病等一系列刺激反应的调节[14,15]。有人研究了模拟微重力条件下的草莓和香石竹的株高、叶片数、叶绿素含量及光合速率发现,微重力对叶绿体的正常光合功能没有显著影响。此外,有研究者发现,重力改变时,拟南芥的钙离子分布和浓度也发生改变,进而引起一系列的生物效应[15]。徐伟等[16]对微重力条件下芦笋根尖钙离子的分布的研究发现,微重力条件下根尖细胞钙离子浓度比对照的钙离子浓度低。本试验结果显示,模拟微重力环境下,拟南芥叶片的钙离子浓度比对照的钙离子浓度高,说明模拟微重力影响钙离子的分布。这些结果表明钙离子在植物的微重力效应过程中起到很大的作用。但是,根和叶片在模拟微重力条件下的钙离子分布状况有所不同,很可能是由于重力方向发生改变,钙离子在植物组织细胞中进行移动,如果集中移动到根部,叶片中就减少了钙离子,如果集中移动到根部,叶片就减少了钙离子。结果显示,模拟微重力,促使钙离子移动到了叶片细胞中,徐伟等仅对玉米根尖钙离子分布进行了观察,未对叶片钙离子分布进行检测,所以,本试验的结果和前人并不矛盾。Mari 等[17]以水蕨属作为试验材料,对其孢子进行了不同时间(包括1、8和20 h)的模拟微重力处理,提取RNA并进行实时定量RT-PCR,然后比较分析芯片结果,通过基因表达分析发现,1 h处理的孢子的2 110个基因中有3.46%基因位点发生改变,其中37个基因明显上调,25个基因下调表达;8 h 处理的孢子的2 486个基因中有5.91%发生改变,其中70个明显上调表达,42个下调表达;经20 h处理的孢子的2 797个基因中有5.20%发生改变,其中有53个上调表达,48个下调表达[18]。对人肾细胞进行空间搭载后发现,有1 632个基因表达发生了明显改变[19]。Barjaktarović等[20]对7 g处理1 h的拟南芥愈伤组织进行了基因芯片分析发现,200多个基因表达明显上调,他们还通过蛋白质组学的方法发现,超重1 h处理的愈伤组织中有28个蛋白发生了明显改变。
4 结论
本研究有关基因芯片分析结果或许可以说明,上述这些生理指标差异,很可能与模拟微重力处理的差异表达有关,处理6 d上调表达201个,下调表达249个;处理1 d 差异表达的基因,上调表达136个,下调表达229个,或许这些差异表达的基因是由微重力处理引起的,研究结果尚需进一步验证。
[1] 王浩, 牛颜冰.航天育种机理的研究进展[J]. 山西农业大学学报:自然科学版, 2009, 29(2):120-121.
[2] Albrecht-Buehler G. The simulation of microgravity conditions on the ground[J]. ASGSB Bulletin, 1992, 5(2):3-10.
[3] Sobol M, Kordyum E. Distribution of calcium ions in cells of the root distal elongation zone under clinorotation[J]. Microgravity Sci Technol, 2009, 21(1-2):179-185.
[4] Zhao Q, Li J, Liu M. Effects of simulated microgravity on characteristics of photosynthesis in plant seedling[J]. Space Medicine & Medical Engineering, 2002, 15(2):79-83.
[5] 郑景生.微重力下的植物生物学效应与空间诱变育种研究[J]. 江西农业大学学报:自然科学版, 2003, 25(5) :671-675.
[6] 费翅鲲, 胡向阳, 崔大勇, 等.模拟微重力的植物生物学效应[J]. 自然科学进展, 2002, 12(2) :135-139.
[7] 刘敏, 王亚林, 薛淮, 等.模拟微重力条件下植物细胞亚显微结构的研究[J]. 航天医学与医学工程, 1999, 12(5):360-363.
[8] 黄伟, 黄晓兵, 郭梅, 等.模拟微重力对玉米根尖细胞核的影响[J].内江师范学院学报, 2008, 23(4):57-59.
[9] Hilaire E, Guikema JA, Brown J, Gravit CS. Clinorotation affects soybean seedling morphology[J]. Physiology, 1995, 2:149-150.
[10] Kochba J, Lvee S. Differences is peroxidase activity and isoenzymes in embryogenic and non-embryogenic shamouti orange ovular callus lines[J]. Plant Cell Physiology, 1977, 18:463-467.
[11] Cai WM. Isozyme analysis of SOD of several plants species in simulate microgravity condition[J]. Acta Phytophysiologica Sinica, 2000, 26:137-142.
[12] Hepler PK, Wayne RO. Calcium and plant development[J]. Annu Rev Plant Physiol, 1985, 36:397-439.
[13] Zhao HC, Zhu T, Wu J, Xi BS. Effect of simulated microgravity on aged pea seed vigour and related physiological properties[J]. Colloids and Surfaces B:Biointerfaces, 2003, 27:311-314.
[14] Gilroy S, Jones RL. Gibberellic acid and abscisic acid coordinately regulate cytoplasmic calcium and secretory activity in barley aleurone protoplasts[J]. Proc Natl Acad Sci USA, 1992, 89(8):3591-3995.
[15] Hilaire E, Paulsen AO, Brown CS, et al. Microgravity and clinorotation cause redistribution of free calcium in sweet clover columella cells[J]. Plant Cell Physiol, 1995, 36:831-837.
[16] 徐继, 赵琦. 微重力对石刁柏根尖组织和细胞中钙水平及分布的影响[J]. 生物物理学报, 1999, 15(2):381-386.
[17] Salmi ML, Roux SJ. Gene expression changes induced by space flight in single-cells of the fern Ceratopteris richardii[J]. Planta, 2008, 229:151-159.
[18] Centis-Aubay S, Gasset G, Mazars C, et al. Changes in gravitational forces induce modifications of gene expression in A. thaliana seedlings[J]. Planta, 2003, 218:179-185.
[19] Commission on Physical Sciences Mathematics and Applications National Research Council. Biological sciences and biotechnology microgravity research opportunities for the 1990s[R]. Conmittee on Microgravity Research Space Studies Board, 1999:62-75.
[20] Barjaktarović Ž, Babbick M, Nordheim A, et al. Alterations in protein expression of Arabidopsis thaliana cell cultures during hyper- and simulated micro-gravity[J]. Microgravity Sci Technol, 2009, 21:191-196.
