非小细胞肺癌上皮间质转化与化疗耐药性的相关性
2013-12-23,,,
,,,
(青岛大学医学院附属医院病理科,山东 青岛 266003)
肺癌是当今世界上发病率和死亡率最高的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)约占肺癌的75%~80%,5 年生存率平均不到50%[1]。目前临床多采用手术与放、化疗结合的综合治疗方案,其中顺铂是临床上NSCLC化疗方案中必不可少的一线药物。但是治疗过程中肿瘤细胞产生的耐药性是影响疗效的重要因素,现在临床多通过检测DNA修复家族成员核苷酸切除修复基因1(ERCC1)来评估肿瘤组织的顺铂耐药性。已有研究显示,高表达耐药蛋白的肿瘤细胞表现出与亲本细胞不同的侵袭和转移能力,耐药癌细胞系的侵袭转移力显著提高,肿瘤多药耐药与侵袭转移存在一定的内在联系[2];上皮间质转化(EMT)在肿瘤侵袭和转移中发挥重要作用[3-5],提示在肿瘤的进展过程中,EMT的发生和肿瘤耐药性之间可能存在着一定的相关性。本研究从组织学角度证实化疗耐药性的发生与EMT有关,为化疗耐药性的研究拓展新的思路。
1 材料与方法
1.1 标本及其来源
收集青岛大学医学院附属医院及青岛市市立医院病理科近5年NSCLC新辅助化疗后手术切除标本40例(新辅助化疗组,其中12例有术前未作化疗时的活检标本),同时收集2011年7月—2012年6月手术切除的NSCLC组织标本40例(单纯手术组,术前未经化疗)。新辅助化疗组均给予以顺铂为基础的联合化疗(其中28例为NP方案:重酒石酸长春瑞滨+顺铂,12例为GP方案:盐酸吉西他滨+顺铂),术前行2周期化疗,化疗后3周左右手术。
1.2 主要试剂
鼠抗人E-钙黏素(E-cadherin)单克隆抗体、鼠抗人波形蛋白(vimentin)单克隆抗体、鼠抗人CK单克隆抗体、鼠抗人ERCC1单克隆抗体、PV-6000检测试剂盒及DAB显色剂,均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色
所有组织标本均制成4 μm厚度的连续切片,二甲苯脱蜡,系列乙醇水化至蒸馏水,含体积分数0.03的过氧化氢灭活内源性过氧化物酶,高压修复;采用免疫组织化学PV-6000二步法染色;其中一抗ERCC1浓度为1∶100,E-cadherin为1∶200,vimentin为1∶100;DAB显色,苏木精复染,封片。用PBS代替一抗作为阴性对照,用已知的阳性切片作为阳性对照。
1.4 结果判定
ERCC1以肿瘤细胞核和(或)细胞浆出现棕黄色颗粒状染色为阳性,E-cadherin以肿瘤细胞膜或细胞浆出现棕黄色颗粒状染色为阳性,vimentin以细胞浆出现棕黄色颗粒状染色为阳性。免疫组化结果根据染色深浅和阳性细胞数两项综合分析:每例标本在400倍视野下随机选取500个肿瘤细胞,观察阳性细染色强度,并计数阳性细胞百分数。细胞染色强度评分:无着色为0分,淡黄色为1分,棕黄色为2分,深棕色或棕褐色为3分;阳性细胞百分数评分:
1.5 统计学处理
应用SPSS 19.0统计软件进行数据处理,数据间比较采用非参数统计秩和检验(Mann-Whitney Test),两变量间相关性分析采用Spearman分析,P<0.05为差异有统计学意义。
2 结 果
2.1 两组ERCC1与EMT表型蛋白之间的相关性
新辅助化疗组ERCC1阴性表达11例,阳性表达29例(72.5%);vimentin阴性者13例,阳性27例(57.5%);E-cadherin阴性者31例,阳性9例(29.0%)。vimentin和ERCC1表达呈正相关(r=0.482,P<0.05);E-cadherin和ERCC1表达呈负相关(r=-0.519,P<0.05)。见表1。
单纯手术组ERCC1阴性表达19例,阳性表达21例(52.5%);vimentin阴性表达21例,阳性表达19例(47.5%);E-cadherin阴性表达27例,阳性表达13例(32.5%)。vimentin和ERCC1表达呈正相关(r=0.405,P<0.05);E-cadherin和ERCC1表达呈负相关(r=-0.346,P<0.05)。见表1。
2.2 两组E-cadherin、vimentin和ERCC1的表达情况比较
新辅助化疗组与单纯手术组的E-cadherin、vi-mentin和ERCC1表达阳性率比较,差异无显著性(P>0.05)。见表2。
2.3 E-cadherin、vimentin和ERCC1表达与临床病理特征关系
新辅助化疗组和单纯手术组低分化癌病人的ERCC1、E-cadherin和vimentin表达强度与分化程度及淋巴结转移有关(Z=-2.031~-1.976,P<0.05),而与病理类型、性别及年龄无关(P>0.05)。新辅助化疗组EMT现象以及肿瘤耐药性均比单纯手术组明显,但差异无统计学意义(P>0.05)。见表3、4。
3 讨 论
近年来,NSCLC治疗领域取得了较大的进展,引进多学科综合治疗和靶向治疗为代表的新治疗方法的同时,传统化疗依然是肺癌主要的治疗手段之一。但是肿瘤细胞普遍存在多药耐药现象,是影响疗效的重要因素。肺癌化疗过程中常用的顺铂抗癌作用的主要靶点为DNA,两者可以共价结合形成顺铂-DNA复合物,引起DNA损伤,从而造成细胞死亡[6]。DNA损伤修复基因ERCC1主要参与DNA损伤的核苷酸切除修复,可以修复顺铂等多种原因所引起的DNA损伤,因此ERCC1过表达提示肿瘤细胞对顺铂的耐药性增强[7]。目前,国际上公认检测ERCC1是评估NSCLC顺铂耐药性的重要指标之一,但是关于化疗耐药的机制不完全清楚。
越来越多的研究显示,肿瘤细胞的EMT与化疗耐药性之间有着密切的联系[8],因此对肿瘤细胞EMT机制的研究有可能成为了解化疗耐药性关键所在。EMT指上皮细胞暂时丧失原有的细胞极性,细胞间黏附减少,表现出具有移行能力的间质细胞特征; 同时细胞表型发生改变,即上皮表型标志物E-cadherin 等表达下调、vimentin等间充质表型标志物表达上调,其中最具特征性的是E-cadherin表达下调。现已证实,EMT存在于多种病理过程中,如伤口愈合、肿瘤发生及转移,是目前肿瘤转移研究的热点之一[8],其最有力的证据是EMT的调控基因或信号通路广泛地参与肿瘤的形成和转移的过程[9]。随着肿瘤浸润性与EMT的相关性研究的深入,EMT与肿瘤耐药性相关性研究也逐渐受到重视。目前,对EMT与化疗耐药性相关性的研究主要采用体外培养细胞系。YANG等[10]研究结果表明,耐奥沙利铂的结直肠癌细胞出现EMT现象,表现为细胞呈长梭形、极性丧失,黏附性降低、伪足形成等;免疫荧光示细胞的上皮标志物E-cadherin和桥粒斑蛋白表达下调,间质标志物vimentin 表达上调。RHO等[11]成功建立了NSCLC耐吉非替尼细胞系A549/GR,并且也观察到上述的EMT 现象,细胞在Transwell小室中侵袭性及运动能力增强。THOMSON等[12]将能够耐受埃罗替尼的NSCLC细胞(H460和Calu6)接种至小鼠体内,其肿瘤组织检测不到E-cadherin表达或表达少量E-cadherin,而埃罗替尼敏感的NSCLC细胞(H292)接种瘤体则高表表达E-cadherin;相反,纤连蛋白(fibronectin)和vimentin只在耐药组中高表达。
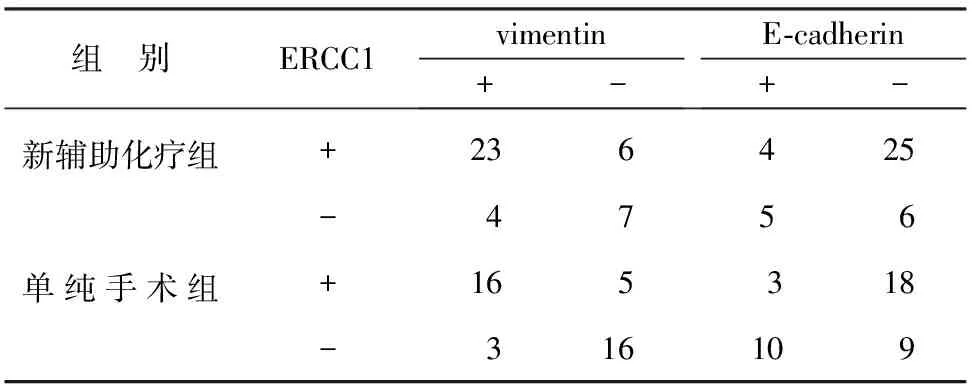
表1 新辅助化疗组与单纯手术组ERCC1和vimentin、E-cadherin表达的相关性(例)

表2 新辅助化疗组与单纯手术组ERCC1、E-cadherin和vimentin表达阳性率比较(例)

表3 两组ERCC1表达与临床病理的关系(例)
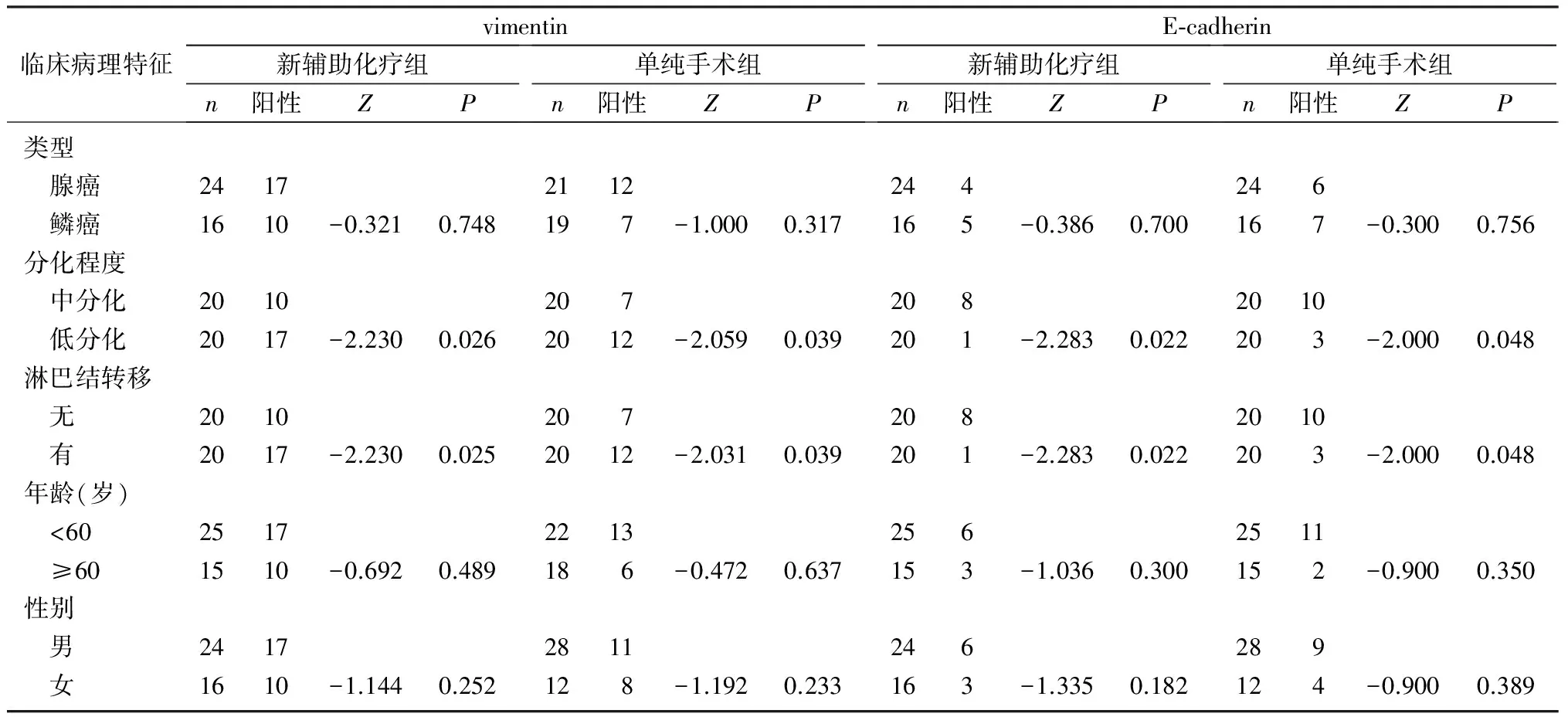
表4 新辅助化疗组和单纯手术组vimentin和E-cadherin表达与临床病理的关系(例)
鉴于上述研究均建立在细胞系研究的基础上,本实验选用NSCLC单纯手术组及新辅助化疗组手术标本,在前期实验研究结果的基础上,选择分化程度构成比相近的病例,对比分析E-cadherin、vimentin和ERCC1的表达情况,结果显示两组肿瘤组织中vimentin和ERCC1表达呈正相关,E-cadherin和ERCC1表达呈负相关。提示发生EMT的肿瘤细胞化疗耐药性增强,也就是说EMT和肿瘤化疗耐药性之间联系紧密。另外,两组之间各种蛋白的阳性表达比较结果显示,新辅助化疗组EMT现象以及肿瘤耐药性均比单纯手术组明显,虽然其差异没有统计学意义,原因一方面可能与所选病例数量相对有限有关,另一方面提示肿瘤耐药性的产生以及EMT表型的获得可能与处理方式联系不紧密,而与肿瘤的异质性有关,有待进一步研究。
综上所述, NSCLC化疗耐药性与EMT现象呈正相关。深入研究NSCLC化疗抵抗与EMT产生的机制,对于预测肿瘤化疗的敏感性,实现对肿瘤病人的个体化治疗,具有重要的临床意义。
[1] 于文娟,项锋钢,王曰伟. 非小细胞肺癌肺耐药相关蛋白定量分析及其临床意义[J]. 青岛大学医学院学报, 2007,43(2):164-166.
[2] THOMSON S, BUCK E, PETTI F, et al. Epithelial to me-senchymal transition is a determinant of sensitivity of non-small-cell lung carcinoma cell lines and xenografts to epidermal growth factor receptor inhibition[J]. Cancer Research, 2005,65(20):9455-9462.
[3] THIERY J P. Epithelial-mesenchymal transitions in tumour progression[J]. Nature Reviews Cancer, 2002,2(6):442-454.
[4] SAVAGNER P. Leaving the neighborhood: molecular mechanisms involved during epithelial-mesenchymal transition[J]. Bio Essays, 2001,23(10):912-923.
[5] MA L I, TERUYA-FELDSTEIN J, WEINBERG R A. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J]. Nature, 2007,449(7163):682-688.
[6] STEWART D J. Mechanism of resistance to cisplatin and ear-boplatin[J]. Critical Reviews in Oncology/Hematology, 2007,63(1):12-31.
[7] 谷海燕,项锋钢,信芳杰,等. NSCLC含铂新辅助化疗后ERCC1和BRCAl表达及其与疗效关系[J]. 齐鲁医学杂志, 2012,27(2):98-100.
[8] GUARINO M. Epithelial-mesenchymal transition and tumour invasion[J]. International Journal of Biochemistry and Cell Biology, 2007,39(12):2153-2160.
[9] THIERY J. Epithelial-mesenchymal transitions in tumor progression[J]. Nature Reviews Cancer, 2002,2:442-454.
[10] YANG A D, FAN F, CAMP E R, et al. Chronic oxaliplatin resistance induces epithelial-to-mesenchymal transition in colorectal cancer cell lines[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2006,12(14 Pt 1):4147-4153.
[11] RHO J K, CHOI Y J, LEE J K, et al. Epithelial to mesenchymal transition derived from repeated exposure to gefitinib determines the sensitivity to EGFR inhibitors in A549, a non-small cell lung cancer cell line[J]. Lung Cancer, 2009,63(2):219-226.
[12] THOMSON S, BUCK E, PETTI F, et al. Epithelial to mesenchymal transition is a determinant of sensitivity of non-small-cell lung carcinoma cell lines and xenografts to epidermal growth factor receptor inhibition[J]. Cancer Research, 2005,65(20):9455-9462.
