西兰花种子及其愈伤组织中萝卜硫素含量比较
2013-12-23张品南马绍英杨海荣刘会杰周文政付瑞军
张品南,马绍英,杨海荣,杨 柯,刘会杰,李 胜* ,周文政,付瑞军
1甘肃农业大学生命科学技术学院,兰州730070;2 甘肃顺意生物科技有限公司,张掖734000
西兰花(Brassica oleracea L. var italica Plenck)属十字花科芸墓属甘蓝种,为一、二年生草本植物。西兰花以顽强的生命力、不可替代的营养价值、药用价值、超乎食用价值被誉为“防癌[1]、抗癌[2]新秀”风靡世界。日本的农业研究院表示异硫代氰酸盐能阻止黑色素癌细胞的生长[3],其中萝卜硫素是迄今为止蔬菜中发现的抗癌活力最强的一类异硫代氰酸盐,它的抗癌作用已在大鼠的乳腺癌、皮肤中得到充分的证明[4]。近年来,从西兰花种子、不同器官中提取萝卜硫素的研究较广[5]。
利用细胞和组织培养方法生产植物次生物质是药物和一些工业原料的重要来源[6]。西兰花(Brassica oleacea)为常见的蔬菜,从种子和花椰菜中提取萝卜硫素具有成本高、含量低等缺点。利用细胞培养方法来生产,既可摆脱对植物资源的依赖,又能保护物种多样性和生态环境[7]。
本实验以萝卜硫素含量为考察指标,采用高效液相色谱法,对市场供试的9 个品种及不同组织所诱导的愈伤中萝卜硫素的含量进行了测定,以期为西兰花离体细胞系的代谢调控和资源合理利用等提供科学依据。
1 材料与方法
1.1 试验材料
参试的9 种西兰花种子由甘肃省农科院种子公司提供,材料和品种名及编号见表1,萌发所得无菌苗叶片、胚轴及胚根诱导的愈伤组织为材料。所有愈伤组织在甘肃农业大学生命科学技术学院细胞工程实验室诱导获得。
1.2 试剂与仪器
萝卜硫素标准品(90%,美国sigma 公司)、95%的乙醇(AR)、甲醇(HPLC)、二氯甲烷(AR)、乙腈(AR)。
培养基:MS +2. 0 mg/L 2,4-D +1. 0 mg/L 6-BA。
Aglient 1100 高效液相色谱仪:配有可变波长紫外检测器和 Aglient 1100 色谱工作站,美国。AR2140 分析天平(奥斯豪上海公司);旋转蒸发器(RE52CS-1);真空泵(中国浙江临海市精工真空设备厂,L* 2-0.25 旋片式)。
1.3 试验方法
1.3.1 愈伤组织的获得
取14 d 苗龄的西兰花无菌苗,切取子叶(约25 mm2)、胚轴(约5 mm2)和胚根(约5 mm2)接种到诱导培养基上,每个部位10 瓶,每瓶4 块外植体,进行愈伤组织诱导。以上培养基均添加30 g/L 蔗糖,4.5 g/L 琼脂粉,用0.1 mol/L NaOH 调节pH 至5.8~6.0,高压0.10~0.15 MPa,温度121.0 ℃,灭菌20 min。培养温度控制在(25 ±2)℃,黑暗下培养30 d。
1.3.2 萝卜硫素样品的制备
参照Bertelli 等[8]的制备及提取方法:取5 g 干燥材料(种子、愈伤组织)研钵研碎后,过60 目筛,准确称取0.5 g,倒入150 mL 的三角瓶中,加1 mL蒸馏水浸湿粉末室温(25 °C)下放置12 h 并过夜,用盐酸调pH 至3,然后冷冻干燥得到干燥的粉末,再加入10 mL 二氯甲烷浸提3 h,抽滤除去粉末,粉末再用10 mL 二氯甲烷浸提3 h,合并两次二氯甲烷浸提液,浓缩并回收溶剂,45 °C 旋转蒸发旋转浓缩,后用甲醇定容至4 mL。最后取提取样液1 mL过0.22 μm 水系滤膜,冷冻保存待测[9]。
1.3.3 萝卜硫素分析
1.3.3.1 HPLC 分析
色谱柱:VP-ODS(150 × 4.6 mm,10 μm);流动相:V(乙腈)∶V(水)=70∶30;流速:0.8 mL/min;柱温:30 °C;检测波长:245 nm;进样量:20 μL,每个浓度重复3 次;检测灵敏度:0.02AUFS。萝卜硫素标准品和样品色谱图见图1、图2。
1.3.3.2 萝卜硫素标准曲线制作

采用外标法定量,精确称取10 mg 萝卜硫素标准品,使用甲醇配制成浓度为1.0 mg/mL 的标准溶液,逐级稀释成浓度为500、250、125、62.5 μg/mL 的标准溶液。浓度由低至高依次进样,分别进样3 次,每次20 μL,在上述色谱条件下分析,以萝卜硫素含量为横坐标,峰面积为纵坐标作标准曲线。得回归方程Y=7.0575X+210.15,R2=0.9948。
2 结果与分析
2.1 不同西兰花种子中萝卜硫素含量
由实验可知,供试的9 个西兰花参试材料的种子中均检测到萝卜硫素(表1),不同器官的愈伤组织中也全部检测到萝卜硫素,且不同西兰花参试材料间、不同器官的愈伤组织中萝卜硫素含量均存在极显著差异(P <0.01)。经差异显著性分析得出,“玉皇”(香港黄清河有限公司中早生)是萝卜硫素含量最高的西兰花品种,其含量达942.758 μg/g,是其他品种的1.13~5.46 倍左右;含量最低的是“中青9 号”(172.808 μg/g)。
2.2 西兰花不同器官愈伤组织中萝卜硫素含量的比较
由表1 可见,不同材料不同器官获得的愈伤组织中萝卜硫素含量差异极显著(P < 0. 01),“玉皇”子叶获得的愈伤组织中萝卜硫素含量最高,达到840.480 μg/g,分别是“绿冠早生”种子和子叶愈伤组织中(位居第二)的1.156 倍和1.36 倍。由此可见,“玉皇”子叶诱导所得的愈伤组织中萝卜硫素含量是所有品种器官愈伤组织中含量最高的,并且与最低品种“中青9 号”相差达到6.48 倍。
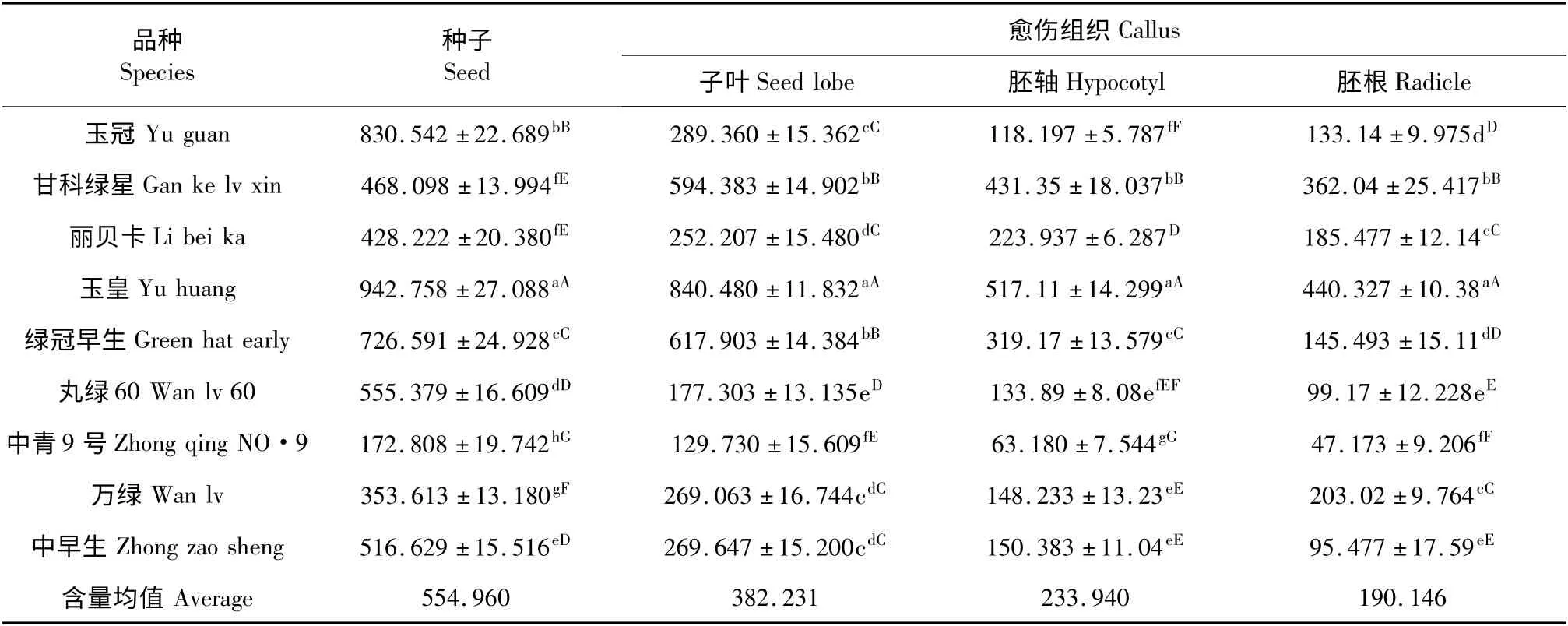
表1 西兰花种子及其愈伤组织中萝卜硫素含量比较Table 1 Comparison of sulforaphane content in seeds of Broccoli species and callus induced from different organs (μg/g)
胚轴、胚根分别获得愈伤组织中萝卜硫素含量最高的仍然是“玉皇”,与最低的“中青9 号”相差达到8.18 倍和9.33 倍。胚根获得愈伤组织中萝卜硫素含量最低,其中“中青9 号”胚根中检测出萝卜硫素最低,为47.173 μg/g,说明西兰花组织器官胚根诱导的愈伤组织不利于萝卜硫素的大量提取。不同材料及各器官获得愈伤组织中萝卜硫素平均含量以种子最高,子叶,胚轴次之,胚根最低,种子中的平均含量分别为各器官愈伤组织平均含量的1.45、2.37和2.92 倍。
3 讨论
研究认为不同西兰花材料间不同器官中均存在显著影响萝卜硫素含量的基因型差异。黄科等2008 研究发现:青花菜新品种“福青1 号”为中晚熟一代杂种,萝卜硫素含量高达984·47 μg/g[10]。前人在西兰花种子中提取萝卜硫素,是植物次生代谢物质的成功经验,为西兰花细胞培养产生萝卜硫素提供了参考。我们的试验结果表明:种子中萝卜硫素含量942.758 μg/g 与其基本一致。但是在我国西兰花种子匮乏,价格相对高昂,而且大部分需进口。因此以西兰花种子为材料进行大量的萝卜硫素提取成本太高,不能成为首选。在西兰花菜、茎、叶废弃物作为提取萝卜硫素原料工业化生产已经初见规模,但是远远不能满足市场需求[11]。
经本试验确立:以西兰花愈伤组织为材料生产萝卜硫素,是目前结合植物组织培养技术的现代生物理论。选择萝卜硫素含量高的西兰花愈伤组织进行资源的深度开发利用有着广阔的市场前景。
1 Iori R,Bernardi R,Gueyrard D,et al. Formation of glucoraphanin by chemoselective oxidation of natural glucoerucin:A chemo enzymatic route to sulforaphane. Bioorg Med Chem Let,1999,10:1047-1048.
2 Fowke JH,Longcope C,Hebert JR. Brassica vegetable consumption shifts estrogen metabolism in healthy postmenopausal women.Cancer Epidemiol Biomarkers Prev,2000,9:773-779.
3 Magnusson C,Barron JA,Correia N,et al.Breast cancer risk following long-term oestrogen and oestrogen-progestin-replacement therapy.Int J Cancer,1999,81:339-344.
4 Li ZY(李志邈),Cao JS(曹家树).Anticancer properties of vegetable.Northern Horticul(北方园艺),2001,4:4-6.
5 Su GY(苏光耀). Separation and identification of sulforaphane hydrolyzed from glucosinolate in broccoli seed.Hanzhou:Dissertation Submitted to Zhejiang Gongshang University(浙江工商大学),MSc.2007.
6 Qi FH(齐凤慧),Zhan YG(詹亚光),Jing TZ(景天忠).A review on elicitors and their regulation on secondary metabolites in plant cell culture.Nat Prod Res Dev(天然产物研究与开发),2008,20:568-573.
7 Xue C(薛冲),Li S(李胜),Ma SY(马绍英),et al.Effects of different light qualities on the callus and its sulforaphen content from broccoli.J Gansu Agric Univ(甘肃农业大学学报),2010,45:95-99.
8 Bertelli D,Plessi M,Braghiroli D,et al.Separation by solidphase extraction and quantification by reverse phase HPLC of sulforaphane in broccoli.Food Chemistry,1998,63:417-421.
9 Matosheski NV,Wallig MA,Juvik JA,et al. Prarative HPLC method for the purification of sulforaphane and sulforaphane nitrile from Rassica oleracea. J Agric Food Chem,2001,49:1867-1872.
10 Huang K(黄科),Wu QY(吴秋云),Li B(李宾),et al. A new broccoli cultivar‘Fu-qing 1’.Acta Horticul Sin(园艺学报),2008,35:1854.
11 Qiu HR(邱海荣). Determination and comparision of glucosinolate content in various broccoli and cauliflower cultivars.Nanjing:College of Horticulture Nanjing Agricultural University(南京农业大学),MSc.2008.
