大黄酸氨基酸衍生物合成及放射增敏作用的初步研究
2013-12-23李济洋朱泽红郝建秀周则卫李瑞峰李光强徐文清
李济洋,朱泽红,郝建秀,周则卫,李瑞峰,李光强,徐文清
中国医学科学院北京协和医学院放射医学研究所药物室,天津300192
放射疗法是现代肿瘤治疗的主要手段,射线照射生物体后,直接损伤生物大分子DNA 或通过其产生的自由基间接损伤DNA 或细胞[1]。由于肿瘤细胞增殖快,导致肿瘤细胞内部的细胞乏氧。这是肿瘤细胞对射线不敏感的重要因素[2]。放射增敏剂能够提高肿瘤中乏氧细胞对射线的敏感性,增强射线对肿瘤的细胞的杀伤效应,对提高临床放疗效果具有重要意义。
近年来的研究表明,大黄酸可通过促进细胞凋亡[3]、细胞周期抑制[4]、阻止DNA 损伤修复[5]、抑制血管生成[6]等作用发挥一定的抗癌活性。由于癌细胞增殖迅速,需要更多的氨基酸,如尝试将大黄酸与各种氨基酸分子连接,组成新的化合物,则有可能更易将目标化合物靶向作用于癌细胞。本文选用大黄酸作为母体,引入肿瘤增殖中大量需要的氨基酸,进行放射增敏活性的研究。希望能从此类化合物中寻找到具有较好放射增敏活性且低毒副作用的候选化合物,为蒽醌类天然产物放射增敏剂的研究奠定基础。
1 材料与方法
1.1 试剂与设备
大黄酸(南京泽朗医药科技有限公司,纯度>98.0%),L-亮氨酸、L-异亮氨酸、L-天冬氨酸、L-谷氨酸,L-色氨酸,L-蛋氨酸,L-脯氨酸(北京鼎国生物技术有限公司,纯度>99.0%);2-氨基丁酸乙酯盐酸盐(上海瀚鸿化工科技有限公司,纯度>99.0%);甲醇、甲苯、甲酸、二氯甲烷、氯仿、石油醚、N,N 二甲基甲酰胺、三乙胺、二氯亚砜、盐酸(天津市化学试剂二厂,分析纯);氢氧化钠(天津市化学试剂三厂,分析纯);硅胶(青岛海洋化工);薄层预制板(烟台江友硅胶开发有限公司)等。盐酸表柔比星(浙江海正药业,10 mg/支);DMEM 培养基(Invitrogen Corporation);胎牛血清(购自中国医学科学院血液研究所);胰酶(Genview);MTT(Genview,纯度>98.0%);DMSO(天津复光精细化工)。肺癌H460 细胞(中国医学科学院基础医学研究所)。137Cs 放射源,剂量率:0.78 Gy/min。
冷阱(河南巩义予华仪器有限公司);超声仪(天津市瑞普电子仪器公司);BUCHI 1535 熔点测定仪(瑞士BUCHI 公司);RE-5299 旋转蒸发仪(巩义市予华仪器有限责任公司);恒温磁力搅拌器(河南巩义市英峪予华仪器有限责任公司);循环水真空泵(河南巩义市英峪予华仪器有限责任公司);水浴锅(北京医疗设备总厂);BS124S 电子天平(Sartorius);高效液相色谱仪(Waters2695);Varian Mercury V×300 型核磁共振仪等。
1.2 实验方法
1.2.1 合成部分
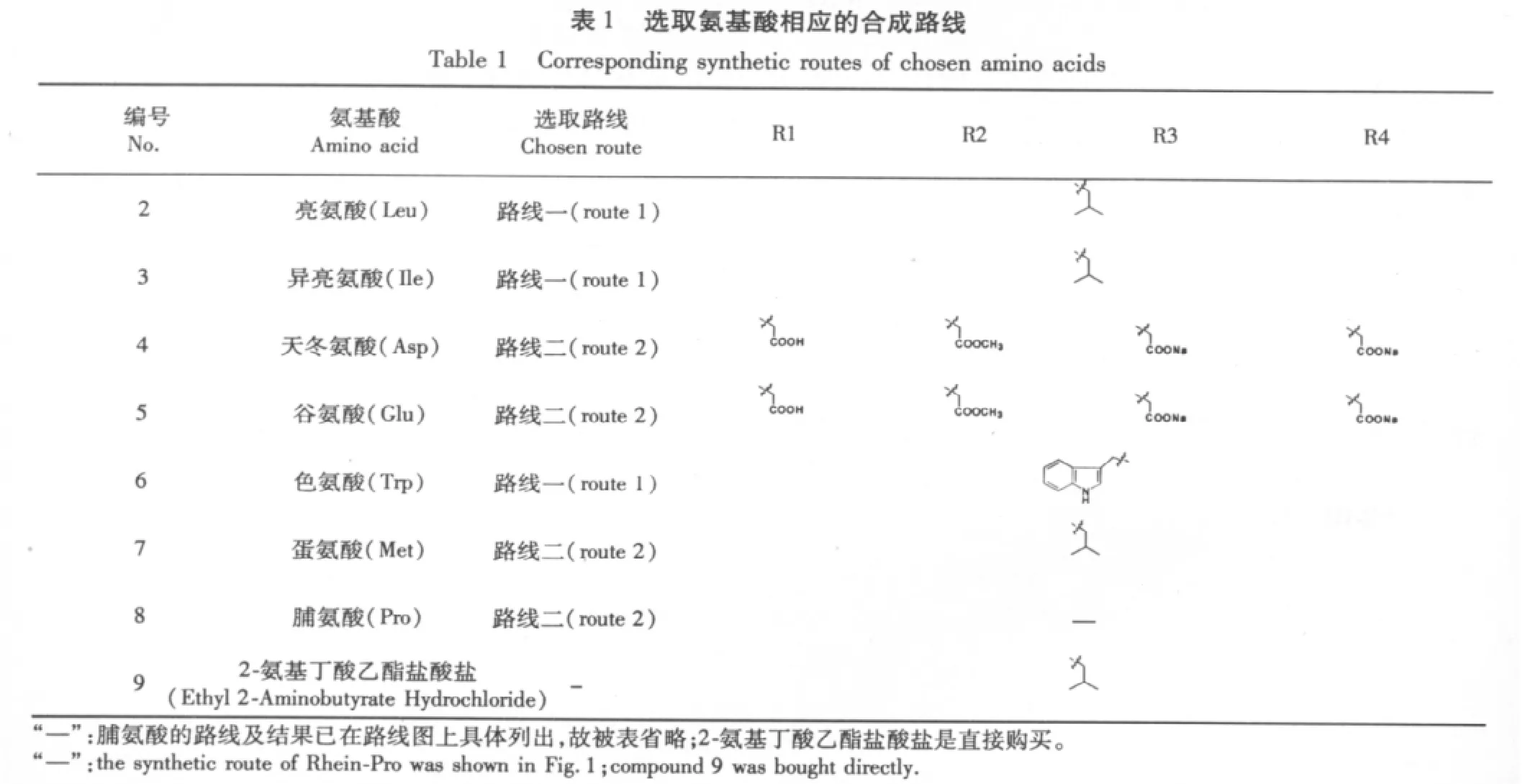
先将氨基酸酯化,保护羧基。再用EDC 和HOBt 在碱性条件下,使大黄酸与氨基酸甲酯缩合。然后碱化脱酯,再酸化得到缩合产物。


?
1.2.2 合成实验过程
1.2.2.1 亮氨酸、异亮氨酸和色氨酸甲酯盐酸盐的合成
加50 mL 甲醇于100 mL 圆底烧瓶中,置于冷阱中15 min,温度计测定烧瓶内甲醇温度保持在-10℃以下。称取1.5 g 亮氨酸(异亮氨酸、色氨酸),加入圆底烧瓶中。沿瓶壁,缓慢多次地加入1.5 eq 的二氯亚砜液体,期间随时监测瓶内温度,保持在-10℃以下。然后冷阱中搅拌至氨基酸溶解后,继续搅拌1 h,再转移至室温,搅拌过夜。发现析出少量白色晶体,减压抽干,加入适量二氯甲烷,反复抽干两次,得到亮氨酸(异亮氨酸、色氨酸)甲酯盐酸盐。测定固体熔点,与文献值比较。
1.2.2.2 天冬氨酸、谷氨酸、蛋氨酸和脯氨酸甲酯的合成
同上,试图合成天冬氨酸(谷氨酸、蛋氨酸、脯氨酸)甲酯盐酸盐。加入二氯亚砜(天冬氨酸和谷氨酸加3 eq),室温搅拌过夜后,发现未析出白色晶体。减压抽滤,无法抽干,得到的是粘稠油状物。向油状物加入一定量的0.5 mol/L NaOH 液体,搅拌溶解,pH 试纸检测pH 至中性或略碱性。用二氯甲烷反复多次萃取该溶液,TCL(氯仿∶三乙胺 = 30∶1),茚三酮显色,与原料比较。只有一个比明显较原料极性小的点时,保留溶液,待用。
1.2.2.3 大黄酰氨基酸甲酯的合成
在50 mL 圆底烧瓶中加入40 mg 大黄酸,38.4 mg EDC(HCl,20 mg HOBt,2eq 的氨基酸盐酸盐或适量的氨基酸甲酯液体,然后加入适量二氯甲烷,再加入4~5 eq 的三乙胺,搅拌,溶解,变紫红色澄清液体。室温搅拌5 h,TCL(氯仿作展开剂)监测反应。过柱,氯仿洗脱,收集第二条带,旋干得大黄酰氨基酸酯。
1.2.2.4 大黄酰氨基酸的合成
向上述大黄酰氨基酸甲酯中,加入1 M NaOH溶液,45 ℃搅拌1 h 后,逐滴加入10%盐酸,紫色溶液变浅,至析出淡黄色固体,再加两滴,至溶液搅拌不再变紫。过滤,再用水冲洗两遍,乙醇冲洗一遍,干燥,得黄色大黄酰氨基酸固体。TCL(甲苯∶乙酸乙酯∶甲酸 = 7.5∶2∶0.5)得只有一个比原料大黄酸极性大的黄点。测算产率,打谱。
1.2.3 抑瘤活性测定
1.2.3.1 待测储备液配制
大黄酸衍生物适量溶于1.2 个当量5% NaHCO3溶液中,水浴蒸干,得到紫色的大黄酰氨基酸钠盐,分别称取其钠盐适量用5%葡萄糖注射液配制成适宜浓度的储备液,0.22 μm 滤膜过滤,除菌后密封冷藏备用。同理,配制了大黄酸钠的储备液作为1 号化合物,以及表柔比星阳性对照液。
1.2.3.2 MTT 法测IC50和IC20值
肺癌H460 细胞接种于含10%牛血清的DMEM培养基中,于37 ℃、5%CO2培养箱中培养,每2~3 d 更换培养液,细胞铺满培养瓶后传代。取对数生长期细胞,经0.25%胰蛋白酶消化制成单细胞悬液,计数并稀释成2 ×104个/mL 细胞液,按200 μL/孔接种于96 孔培养板中,37 ℃、5% CO2的培养箱培养24 h 使细胞贴壁生长。用各化合物贮备液逐级稀释6~7 个浓度梯度给药,每组5~6 个复孔,培养24、48 h 后,加入MTT 试液(5 mg/mL)15 μL,继续培养4 h,吸出培养液,加入DMSO 150 μL/孔,振摇5 min,酶标仪492 nm 处测定吸收值,根据下式计算生长抑制率,拟合剂量存活曲线,计算各药物IC50及IC20值。

1.2.4 各化合物的放射增敏活性初步评价
由MTT 结果,选取大黄酰亮氨酸钠和大黄酰异亮氨酸钠做初步放射增敏实验,大黄酸钠作原料对比,表柔比星作为阳性对照。选取这四个化合物的48 h IC15和IC20值作放射增敏测试浓度。按2 ×104个/mL 细胞液,200 μL/孔接种于96 孔培养板中,37℃、5%CO2的培养箱培养24 h 使细胞贴壁生长。加药,培养24 h 后照射。分五个剂量组,0、1、2、4、6 Gy,照射后继续培养24 h,加入15 μL MTT(5 mg/mL)试液,培养4 h,吸出培养液,加入DMSO 150 μL/孔,振摇5 min,酶标仪492 nm 处测定吸收值。用单因素方差分析法比较单纯照射组和照射合并给药组,初步判断是否有放射增敏作用。
2 结果与讨论
2.1 合成实验结果
2.1.1 HPLC 纯度测定结果
色谱条件:ODS 色谱柱(4.6 mm × 150 mm,5 μm);流动相:甲醇∶0.1%磷酸水溶液(85∶15);流速:l mL/min;柱温:30 ℃;检测波长:254 nm;进样量:10 μL。样品浓度:10~20 μg/mL。面积归一化法计算,各化合物纯度均大于95.0%。
2.1.2 产率和结构鉴定结果
化合物2 黄色粉末状固体;mp. 201~205 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ (ppm):12. 69 (s,1H,4'-COOH),11. 89(s,2H,1 and 8-OH),9.10-9.07 (d,1H,2'-H),8.17-8.16 (s,1H,4-H),7.85~7.73 (m,3H,5,6,7-H),7.42-7.39 (d,1H,2-H),4.49-4.42 (m,1H,3'-H),1.84-1.58 (m,3H,5'-H,6'-H),0.95~0.88 (dd,6H,7'-H,8'-H),产率64.3%。
化合物3 黄色粉末状固体;mp. 210~212 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ (ppm):12. 73 (s,1H,4'-COOH),11. 91(s,2H,1 and 8-OH),9.00~8.97 (d,1H,2'-H),8.12 (s,1H,4-H),7.85~7.72 (m,3H,5,6,7-H),7. 42~7. 39 (d,1H,2-H),4. 36-4. 31 (t,1H,3'-H),1.97 (s,1H,5'-H),1.34~1.22 (m,2H,7'-H),0.96-0.86 (m,6H,6'-H,8'-H),产率60.2%。
化合物4 黄色粉末状固体;mp. 214~218 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ (ppm):12. 72 (s,2H,4'and 6'-COOH),11.87 (s,2H,1 and 8-OH),9.23-9.20 (d,1H,2'-H),8.13 (s,1H,4-H),7.84-7.72 (m,3H,5,6,7-H),7.41~7.33 (t,1H,2-H),4.80~4.72 (q,1H,3'-H),2. 91-2. 70 (m,2H,5'-H),产率28.9%。
化合物5 黄色粉末状固体;mp. 221~225 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ (ppm):12. 42 (s,2H,4'and 7'-COOH),11.83~11.81 (d,2H,1 and 8-OH),9.05~9.03(d,1H,2'-H),8.12 (s,1H,4-H),7.80~7.68(m,3H,5,6,7-H),7.36~7.39 (d,1H,2-H),4.44 (s,1H,3'-H),2.40~2.36 (t,2H,6'-H),2.14~1.95 (m,2H,5'-H),产率35.7%。
化合物6 棕色粉末状固体;mp. 140~142 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ(ppm):12.70 (s,1H,4'-COOH),11.83 (s,2H,1 and 8-OH),10.78 (s,1H,8'-H),9.12 (s,1H,2'-H),8.08 (s,1H,4-H),7.79~7.70 (m,3H,5,6,7-H),7.60~7.57 (d,1H,2-H),7.36~7.28 (m,2H,11' and 14'-H),7.19 (s,1H,7'-H),7.06~6.94 (m,2H,12' and 13'-H),4. 69(s,1H,3'-H),3.35~3.19 (m,2H,5'-H),产率27.8%。
化合物7 黄色粉末状固体;mp. 237~240 ℃(分解);1H NMR (300 MHz;DMSO-d6/TMS,25 ℃)δ(ppm):12. 77 (s,1H,4'-COOH),11. 84 (s,2H,1 and 8-OH),9.08-9.06 (d,1H,2'-H),8.12(s,1H,4-H),7.77~7.68 (m,3H,5,6,7-H),7.37-7.34 (d,1H,2-H),4.55~4.53 (d,1H,3'-H),2.59~2.56 (d,2H,5'-H),2.06 (s,5H,6'and 8'-H),产率33.6%。
化合物8 黄色粉末状固体;mp. 114~117 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ(ppm):12.67 (s,1H,7'-COOH),11.88 (s,2H,1 and 8-OH),8.06 (s,1H,4-H),7.80-7.51(m,3H,5,6,7-H),7.39~7.12 (m,1H,2-H),4.43~4.34 (m,1H,3'-H),3.61-3.49 (m,2H,6'-H),2.30~2.29 (d,2H,4'-H),1.90 (s,2H,5'-H),产率21.5%。
化合物9 黄色粉末状固体;mp. 260~266 ℃(分解);1H NMR (300 MHz,DMSO-d6/TMS,25℃)δ(ppm):12.76 (s,1H,4'-COOH),11.89 (s,1H,1 or 8 -OH),9.08 (s,1H,2'-H),8.16(s,1H,4-H),7.81~7.68 (m,3H,5,6,7-H),7.41~7.31 (d,1H,2-H),4.30 (s,1H,3'-H),1.85-1.64 (m,2H,5'-H),1.03~0.97 (m,3H,6'-H),产率72.4%。
2.2 MTT 实验结果

图3 各化合物对H460 细胞作用24 h 和48 h 后的IC20和IC50值Fig.3 IC20 and IC50 values of each compound after 24 h and 48 h treatment in H460 cells

表2 各化合物分别作用24、48 h 后对H460 细胞的增殖抑制作用结果Table 2 Inhibitory effects of each compound on H460 cells in 24 h and 48 h
如图3 所示,大黄酰亮氨酸钠(化合物2)和大黄酰异亮氨酸钠(化合物3)在24 h 的IC20和IC50值显著小于大黄酸钠的值。虽然48 h 的数值差距变小,但也说明了这两个化合物较原料大黄酸钠有更显著的抑制作用。而其他化合物的抑制作用较原料无明显提高,甚至有明显下降(化合物4 和5)。详细数据可见表2。该部分实验数据使用SPSS 17.0单因素ANOVA 方差分析检验,P <0.05 具有显著性差异。
2.3 增敏实验结果
由图4 所见,相对于单纯照射组,大黄酸钠和大黄酸亮氨酸钠并未表现出放射增敏作用。而照射合并大黄酸异亮氨酸钠(化合物3)组的吸收值虽大于阳性对照组,但小于单纯照射组。说明大黄酰异亮氨酸钠表现出了放射增敏作用。表3 所列的是选取化合物合并照射作用得到的详细OD(492 nm)吸收值。括号内数字是各化合物的给药浓度,单位为μmol/L。

图4 所选取化合物的放射增敏结果Fig.4 Radiosensitizing results of selected compounds
表3 所选取化合物合并照射所得OD492吸收值(n = 6,±s)Table 3 OD492 values obtained by combining selected compounds with radiation(n = 6,±s)

表3 所选取化合物合并照射所得OD492吸收值(n = 6,±s)Table 3 OD492 values obtained by combining selected compounds with radiation(n = 6,±s)
注:与单纯对照组相比,(P <0.01;* P <0.05Note:Compare with control,#P <0.01;* P <0.05
剂量(dosage)单纯照射组(radiation alone)照射合并表柔比星(combine radiation with Epirubicin )照射合并大黄酸钠(combine radiation with sodium rhein)照射合并大黄酰亮氨酸钠(combine radiation with sodium rhein-Leu)照射合并大黄酰亮氨酸钠(combine radiation with sodium rhein-Leu )IC15(1.01) IC20(1.42) IC15(40.87)IC20(55.89) IC15(7.07) IC20(11.47)IC15(52.71) IC20(66.45)01.926 ±0.089 1.019 ±0.057*1.099 ±0.199*1.876 ±0.068 1.810 ±0.102 1.996 ±0.234 1.921 ±0.044 1.696 ±0.044*1.587 ±0.079*1.416 ±0.079*21.436 ±0.028 11.719 ±0.048 0.767 ±0.123*0.583 ±0.059*1.526 ±0.071*1.427 ±0.049*1.709 ±0.085 1.728 ±0.077 1.513 ±0.103*1.107 ±0.113*41.199 ±0.041 0.557 ±0.060*0.433 ±0.060*1.334 ±0.437*1.309 ±0.037*1.405 ±0.038 1.407 ±0.038 1.226 ±0.056*0.877 ±0.081*60.877 ±0.052 0.500 ±0.029*0.348 ±0.043*1.115 ±0.079*1.033 ±0.031*1.078 ±0.034*1.084 ±0.035*0.953 ±0.057*0.345 ±0.069*0.290 ±0.035*0.821 ±0.122 0.840 ±0.066 0.832 ±0.087 0.830 ±0.043 0.743 ±0.048*0.692 ±0.043*
2.4 讨论
近年来的研究发现,大黄酸对乳腺癌[7]、宫颈癌[8]、结肠癌[9]、鼻咽癌[10]、肝癌[4]细胞均有一定的抑制增殖作用。故本文以大黄酸为母体化合物,接入肿瘤增殖中大量需要的氨基酸,希望能从中寻找到具有较好放射增敏活性且低毒副作用的放射增敏剂。由于大黄酸和所得的大黄酰氨基酸在水和脂性试剂中均不溶,所以将它们都转换成钠盐,改善水溶性,以期达到更好的抗肿瘤活性。结果显示,大黄酸钠和所得的大黄酰氨基酸钠盐表现出明显的时间和浓度依赖性抗癌活性。与大黄酸钠相比,大黄酰亮氨酸钠和大黄酰异亮氨酸钠对H460 细胞的IC50值更小,说明有更强的抑制增殖的作用。而其他大黄酰氨基酸钠盐并无此表现。甚至在测定大黄酰色氨酸钠24、48 h 和大黄酰脯氨酸钠48 h 时,低浓度可显著地促进增殖。
初步的放射增敏结果显示,在相应化合物的48 h IC15和IC20浓度,阳性对照表柔比星有明显的放射增敏作用,大黄酰异亮氨酸也已表现出放射增敏作用,而大黄酸钠和大黄酰亮氨酸钠没有显示出放射增敏作用。但这只是初步完成了放射增敏测定,后续还需克隆形成实验进一步验证结果。
1 Gao CL(高春玲),Gao CL(高春丽),Song WF(宋维芳),et al.放射增敏剂的增敏机制.J Mod Oncol(现代肿瘤医学),2007,15:890-892.
2 Peng F(彭芳),Chen M(陈明).抗血管生成和肿瘤血管正常化的研究进展.Chin J Lung Cancer(中国肺癌杂志),2009,12:799-804.
3 Chang CY,Chan HL,Lin HY,et al.Rhein induces apoptosis in human breast cancer cells. Evid Based Complement Alternat Med,2012,Accepted.
4 Shi P,Huang Z,Chen G. Rhein induces apoptosis and cell cycle arrest in human hepatocellular carcinoma BEL-7402 cells.Am J Chin Med,2008,36:805-813.
5 Chen YY,Chiang SY,Lin JG,et al.Emodin,aloe-emodin and rhein inhibit migration and invasion in human tongue cancer SCC-4 cells through the inhibition of gene expression of matrix metalloproteinase-9.Int J Oncol,2010,36:1113-1120.
6 Fernand VE,Losso JN,Truax RE,et al.Rhein inhibits angiogenesis and the viability of hormone-dependent and -independent cancer cells under normoxic or hypoxic conditions in vitro.Chem Biol Interact,2011,192:220-232.
7 Lin YJ,Zhen YS. Rhein lysinate suppresses the growth of breast cancer cells and potentiates the inhibitory effect of Taxol in athymic mice. Anticancer Drugs,2009,20(1):65-72.
8 Ip SW,Weng YS,Lin SY,et al.The role of Ca+2 on rheininduced apoptosis in human cervical cancer Ca Ski cells.Anticancer Res,2007,27:379-389.
9 Ge X,Luo X,Chen Y,et al.Rhein induces apoptosis of HCT-116 human colon cancer cells via activation of the intrinsic apoptotic pathway.African J Biotech,2011,10:13244-13251.
10 Lin ML,Chen SS,Lu YC,et al. Rhein induces apoptosis through induction of endoplasmic reticulum stress and Ca2+-dependent mitochondrial death pathway in human nasopharyngeal carcinoma cells. Anticancer Res,2007,27:3313-3322.
