人颗粒裂解肽突变子在大肠埃希菌中的构建与表达研究
2013-12-23李邦印张灵霞
赵 铭 刘 冰 王 臻,2 李邦印▲ 张灵霞
1.解放军第三〇九医院,北京 100091;2.江西农业大学,江西南昌 330045
最初是由Jongstra等发现的一种短肽,称为519,1997年Pena等把这种短肽命名为颗粒裂解肽(NKG5)[1-2];NKG5是一种细胞毒性效应蛋白,属于SAPLIP(saposin like protein)家族成员,它能够选择性地在NK细胞和激活后的T淋巴细胞中表达,其天然肽和重组肽都具有广谱抗菌活性,对G+和G-细菌、真菌、寄生虫均有杀菌活力,如鼠伤寒沙门菌、单核李司特菌、大肠埃希菌、金黄色葡萄球菌,真菌有新型隐球菌、白念珠菌,寄生虫有利什曼虫,尤其是对分枝杆菌有直接的细胞毒性[1],它与穿孔素和粒酶在溶淋巴颗粒上有协同作用[3]。
引起笔者注意的是NKG5在体外不仅表现为对结核分枝杆菌很强的杀伤作用,且协同穿孔素对细胞内的结核杆菌也有很强的杀伤能力[3-5]。文献报道,颗粒裂解肽在72 h内可以杀灭90%的哺乳动物结核菌素(MTB),其杀灭作用呈剂量依赖性[6]。
众所周知,对结核杆菌有效的药物最早是30年前发现的,更为严重的是结核杆菌对为数很少的治疗药物均已产生了不同程度的耐药性。全球亟需对付结核杆菌的有效措施,包括预防性和治疗性疫苗与新型药物,而NKG5有可能成为抗结核病的一种新型生物制剂。因此,笔者所在课题组开展了一系列针对NKG5的研究。本论文根据从Genebank中报道的NKG5基因序列,设计把NKG5的部分氨基酸编码Cys69、96、107、132、138位变为Ser,采用寡核苷酸合成方式,通过分子生物学技术拼接成为NKG5-Ser编码序列,然后在原核细胞中融合表达,拟为进一步对比研究颗粒裂解肽杀灭结核菌的功能提供基础。
1 材料与方法
1.1 材料
PCR产物纯化试剂盒购于Qiagen,限制性内切酶XhoⅠ和BamHⅠ、T4 DNA连接酶购自NEB,2×pfu、Master Mix、DNA mole wheight marker、羊抗小鼠GST单抗和HRP标记的羊IgG购自天根生物技术(北京)有限公司,发光试剂盒购、GST纯化树脂和还原型谷胱甘肽购自威格拉斯生物技术(北京)有限公司,Red Taq购自赛百盛生物技术有限公司;pGEX-4T-1、大肠埃希菌BL21(DE3)pLysS、DH5α由解放军第三〇九医院结核病研究所分子生物学实验室保存。
1.2 方法
1.2.1 引物设计 搜索Gene bank中hNKG5的cDNA序列(登录号:NM 006433),设计合成氨基酸编码全序列并设计一对引物,其序列如下(下划线部分为BamHⅠ和XhoⅠ酶切位点)上游引物5′-CTACTAGCTAGCGGATCCGGCCGTGACTACCGCACC-3′,下游引物5′-CATCGCTCG AGCTCATTATGGACCTGTAGAAGGGATACTCAAACGGAGGTCCTCG C-3′。
1.2.2 颗粒裂解肽氨基酸编码序列的克隆及序列测定 采用合成的寡核苷酸序列,拼接成NKG5-Ser目的基因,将纯化的目的片段连接到克隆载体pGEMT中,转化入处于感受态的大肠埃希菌DH5α,涂布于含有相应抗生素的LB琼脂培养基上,以蓝白斑筛选方法初步筛选阳性克隆,挑取准阳性的单个白色菌落,提取质粒,进行PCR鉴定,并且对阳性重组子进一步提取质粒后进行双酶切确定其重组片段的大小,最后选择重组质粒(pGEMT-NKG5-Se)在ABI PRISMTM 3700型DNA自动测序仪上测序(由上海生工生物工程技术服务有限公司生产)。
1.2.3 原核表达载体的构建及其表达 用BamHⅠ、XhoⅠ双酶切重组质粒pGEMT-NKG5-Ser,回收目的基因,将其进一步克隆到被同样双酶切的原核表达载体pGEX-4T-1中,构建重组的原核表达载体(pGEX-4T-1-NKG5-Ser),转化大肠埃希菌,用PCR方法及双酶切琼脂糖电泳图进行鉴定。
1.2.4 融合蛋白的表达及条件优化 用灭菌牙签挑取重组菌落BL21(DE3)pLysS,接种于含氨苄青霉素的LB培养基中,培养过夜,取培养物按1∶50比例转种于新鲜含氨卞西林的LB培养液中,37℃震荡培养至OD600值为0.6~0.8,加入IPTG至终浓度1mmol/L诱导表达。继续培养,分不同时间,分批取1 mL诱导培养物,离心集菌体沉淀,用100μL 2×SDS样品缓冲液重悬沉淀,然后100℃水浴5 min,12 000 r/min离心10 min,取10μL进行12% SDS-PAGE,观察表达量,其结果是获得优化对IPTG诱导时间。
1.2.5 蛋白纯化 接种pGEX-4T-1-NKG5-Ser/BL21菌,37℃、200 r/min振摇过夜,以1∶50比例接种于500 mL的LB培养基,37℃、200 r/min振摇4 h后,加入IPTG至终浓度1mmol/L,28℃、200 r/min继续培养4 h,收集菌液,用预冷的PBS溶液重悬菌体沉淀,进行超声破菌后,加入TritonX-100至终浓度为1%,高速离心取上清。上清加入预装有还原型谷胱甘肽亲和层析柱,5倍柱床体积的PBS,最后用含有还原性谷胱甘肽的洗脱液洗出GST-NKG5-Ser,对洗脱蛋白进行SDS-PAGE分析。
1.2.6 免疫印迹(Western blot)分析 纯化后的融合蛋白进行SDS-PAGE后,电转移于硝酸纤维素(NC)膜上(半干状态可以密封低温保存),用双蒸水漂洗NC膜;加入封闭液(含5%脱脂奶粉和0.05%Tween20的pH7.5的TBS),37℃孵育1 h;用TBS在37℃洗膜3次,每次10 min,然后依次加鼠GST单克隆抗体(37℃1 h,洗膜同前)和HRPO标记的羊抗鼠二抗(37℃1 h,洗膜4次,每次15 min),双蒸水冲洗,终止反应,取出,按照试剂盒操作步骤进行化学发光检测,压片,洗片,观察印迹结果。
2 结果
2.1 PCR扩增获得目的基因
利用合成寡核苷酸的方法拼接得目的基因,大小约为240 bp的颗粒裂解肽片段(图1)。

2.2 重组质粒pGEM-T-NKG5-Ser的鉴定
目的基因克隆到载体pGEMT中,重组子质粒经双酶切及PCR鉴定均可以得260 bp大小的片段(图2)。连接了重组质粒由上海生物工程公司进行DNA序列测定。测序结果表明,所克隆的DNA片段所编码的氨基酸序,与预期的氨基酸序列一致,成功地将半胱氨酸定位突变为Ser。与突变子氨基酸序列相应的NKG5氨基酸部分为:GRDYRTCLTIVQKLKKMVDKPTQRSVSNAATRVCRTGRSR WRDVCRNFMRRYQSRVIQGLVAGETAQQICEDLRLCIPST GPL。

图2 pGEMT-NKG5-SerER鉴定
2.3 表达载体的构建
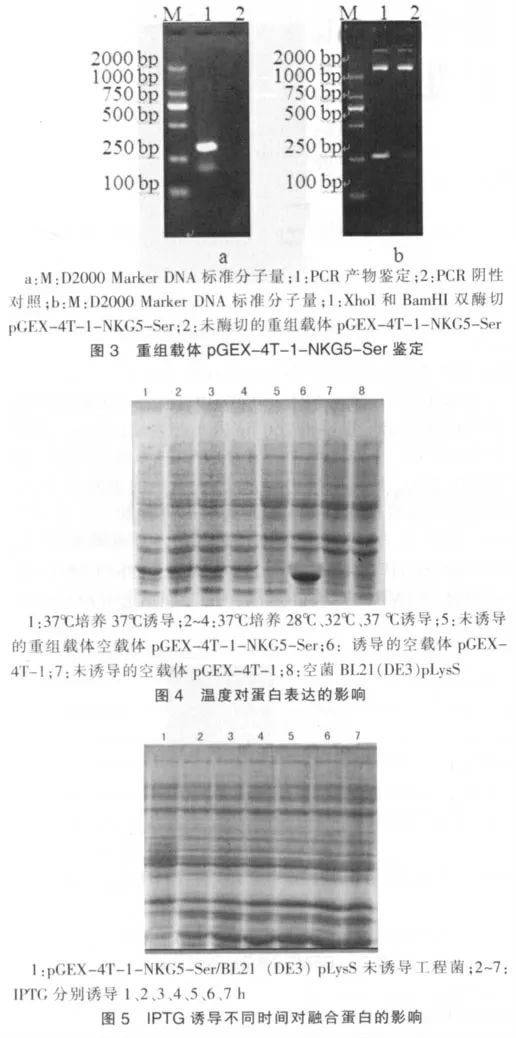
将双酶切重组质粒r获得的DNA片段,亚克隆到同样双酶切的原核表达载体pGEX-4T-1r中,构建重组原核表达载体pGEX-4T-1-NKG5-Ser,重组子质粒进行PCR鉴定及双酶切鉴定其琼脂糖电泳图分别见于图3a和见图3b。
2.4 原核表达及条件优化[6]
将重组菌接种于LB+1%甘油培养液,分别采用24、28、32、37℃进行连续培养诱导,37℃培养28℃诱导及37℃培养32℃诱导,1、2、3、4、5、6、7 h诱导;结果表明:温度和诱导时间对蛋白表达量有显著影响(图4、5)。
2.5 蛋白纯化
对所表达的蛋白进行纯化后,得到纯度达95%以上的重组蛋白,通过SDS-PAGE分析,发现得到一条分子量约为35 kD的融合蛋白条带(图6)。
2.6 Western Blot印迹分析
为证实NKG5-Ser基因得到表达,采用Western Blot杂交技术对原核重组表达产物进行了鉴定,结果显示分子量约为29 kD的蛋白条带能特异性地与鼠抗GST单克隆抗体反应(此为GST反应),在分子量约为35 kD的位置出现一条特异性反应带(应该为GST-Ser融合蛋白)(图7);进一步证实该重组蛋白的分子量大小正确。

3 讨论
NKG5是一种低分子量多肽,体外实验表明具有抗微生物功能及杀伤肿瘤细胞的作用,其分子机制可能是通过神经酰氨、caspase依赖/非依赖途径等来实现其功能的,而且它的杀伤功能与其自身二级结构变化及所携带正电荷氨基酸含量亦相关[7]。有文献已经展开了重组NKG5实验研究,且体外实验表明重组的9 kD NKG5多肽可以杀伤细菌、真菌、原虫(比如革兰阴性或阳性细菌、大型利什曼原虫、新型的隐球菌)等[6-8]。
笔者在以往的实验基础上,发现NKG5在大肠埃希菌中表达的过程中可能由于二硫键太多,多表达为包涵体,且影响分子的复性,其可能会影响以后的生物活性实验。因此在本试验中,笔者合成了全序列编码的寡核苷酸片段,将某些位点突变为ser,拟进行可溶性表达探索。实验中通过SDS-PAGE和免疫印迹分析发现在分子量约35 kD处可见一条特异性条带,证明NKG5融合蛋白得到表达,但表达量不够理想。
影响原核表达系统重组蛋白表达效率的因素很多,除了载体系统之外,可能还由外源基因本身的特性决定。颗粒裂解肽是具有广谱的抗病原微生物及杀伤肿瘤细胞的阳离子抗菌肽[9]。有学者等对颗粒裂解肽的晶体结构研究发现,颗粒裂解肽含有5个α-螺旋(H1-H5)结构,较多的正电荷与稳定的两性α-螺旋相结合有助于提高杀菌活性[10-11]。某些结构域可能造成大肠杆菌部分细胞的破裂[12-13],推测其机制可能是从细胞内部作用于内膜和外膜。而破裂细胞中的少量外源蛋白可能大多被蛋白酶降解,未被降解的微量外源蛋白作用于其他细胞的外膜[14]。另一方面,外源蛋白还可能抑制DNA的复制和转录[11],进而抑制细胞的生长和代谢。因此,可能是重组肽的结构本身直接或者间接影响了工程菌的表达活性。
综合上述,笔者获得了重组蛋白的生物工程菌,足以为进一步实验提供产品。实验中提出了其重组蛋白在原核系统表达量偏低的问题,若提高NKG5-ser表达量,使之高效表达为可溶性的活性肽,可能还需要使用其他载体系统,或者在人源性或动物源性永生化细胞系中进行体外真核细胞表达的研究,这值得进一步探索。
[1]Alan M,Krensky Granulysin.A Novel Antibacterial Peptide of Cytolytic T Lymphocytes and Natural Killer Cells[J].Biochemical Pharmacology,2000,59:317-320.
[2]Jongstra J,Schall TJ,Dyer BJ,et al.The isolation and sequence of a novel gene from a human functional T cell line[J].J Exp Med,1987,165(3):601.
[3]Pena SV,Krensky AM,Granulysin.A new human cytolytic granuleassociated protein with possible involvementin cell-mediated cytotoxicity[J].Semin Immunol,1997,9(2):117.
[4]谢建平,王洪海.结核杆菌的克星——颗粒裂解肽[J].中国药学杂志,2001,36(4):225-226.
[5]SHE Kaufmann.Protection against tuberculosis:cytokines,T cells,and macrophages[J].ARD BM Journal,2005,10(1):54-58.
[6]Steffen S,Dennis AH,Rachel T,et al.An antimicrobial activity of cytolytic T cells mediated by granulysin[J].Science,1998,282(5386):121.
[7]Gamen S,Hanson DA,Kaspar A,et al.Granulysin induced apoptosis I.Involvement of at least two distinct pathways[J].J Immunol,1998,161(4):1758-1764.
[8]Stenger S,Rosat JP,Bloom BR,et al.Granulysin:a lethal weapon of cytolytic T cells[J].Immunol Today,1999,20(8):390.
[9]Huang LP,Lyu SC,Clayberqer C,et al.Granulysin-mediated tumer rejection in transgenic mice[J].J Immunol,2007,178(1):77-84.
[10]Anderson DH,Sawaya MR,Cascio D,et al.Granulysin crystal structure and a structure-derived lytic mechanism[J].J Mol Biol,2003,325(2):355-365.
[11]查向东,徐康森,刘兢.阳离子抗菌肽研究进展[J].中国药理学通报,2003,19(7):735-740.
[12]杨金环,查向东,方红,等.颗粒裂解肽G13结构域的表达及其对大肠杆菌活力的影响[J].中国生物制品学杂志,2008,21(6):467-470.
[13]梁琳,张萍萍,刘兢,等.颗粒裂解肽G13结构域引发细菌SOS反应[J].中国抗生素杂志,2011,36(5):380-384.
[14]Park Y,Hahm KS.Antimicrobial peptides(AMPs):peptide structure and mode of action[J].J Biochem Mol Biol,2005,38(6):507-516.
