Toll样受体系统在肾脏衰老中的表达变化
2013-12-23白雪源陈香美
邵 枫 白雪源 陈香美
解放军总医院肾病科 肾脏疾病国家重点实验室,北京 100853
Toll受体(Toll-like receptors,TLRs)是天然免疫系统的受体之一,在启动和调节天然免疫应答及诱导获得性免疫中发挥重要作用。在哺乳动物中已发现11种TLRs成员。TLRs是一种特定的模式识别受体(pattern cognition receptors,PRRs),能识别细菌等病原体的相关分子结构如脂多糖与脂蛋白等分子,然后激活其下游信号通路分子髓样分化因子MyD88(myeloid differentiation factor 88)[1]。MyD88是TLRs信号通路重要的信号适配器,当被活化后可进一步激活IKK-NF-κB信号通路或JNK-NF-κB信号通路,促进免疫炎性因子的表达[2-3]。TLR3则通过激活MyD88非依赖性信号通路促进炎症分子的表达。
虽然已经提出多种衰老学说如氧化应激(oxidative stress)等,但是目前衰老的机制还不是很清楚[4-5],近年研究表明免疫炎症可能与衰老的发生有关[6]。肾脏是人体内能量代谢非常活跃的器官,因此肾脏易于发生衰老,老年人肾脏功能随年龄的增加逐渐降低[7],但是肾脏器官衰老的机制并不清楚。TLRs系统和肾脏衰老的关系目前尚不清楚。
本研究拟通过研究TLRs及其下游MyD88信号通路分子炎症因子在3、12、24月龄Fischer 344(F344)大鼠肾脏组织中的表达变化以探讨TLRs在肾脏衰老中的作用及其机制。
1 材料与方法
1.1 实验动物与标本处理
2月龄清洁级近交系雄性F344大鼠(体重180~190 g)购自北京市维通利华实验动物中心。实验动物分3月龄组(青年组),12月龄组(中年组)和24月龄组(老年组),每组各20只。每笼4只,饲养于温度(22±1)℃、湿度40%环境中,自由饮食,12 h光照周期。待各组大鼠分别饲养至3、12、24个月后称量体重,用戊巴比妥钠(40 mg/kg)腹腔麻醉,留取血样,然后分别取出肾脏经冰生理盐水灌洗除去残留血迹,称取肾重。肾上极的肾组织投入10%的中性福尔马林中固定,用于免疫组化和肾脏病理。肾下极快速投入OCT复合物中,用于免疫荧光染色。剩余的肾组织切除小块投入液氮中,用于Western blot和qRT-PCR分析。
1.2 生化检测
取血后3000 r/min离心10 min,收集血清,检测血尿素氮(BUN)、血肌酐(SCR)、血糖(GLU)、三酰甘油(TG)及胆固醇(CHOL)。用比色法检测BUN和TG;酶法检测SCR和CHOL;己糖激酶法检测GLU。取尿液测定尿蛋白/肌酐比值,邻苯三酚红钼法测定尿蛋白,肌氨酸氧化酶法测定尿肌酐。
1.3 Western blot分析
用预冷的RIPA裂解液(含50mmol/L Tris pH 7.5,150mmol/L NaCl,1% NP-40,0.1%十二烷基磺酸钠(SDS),10mmol/L乙二胺四乙酸(EDTA),1mmol/L苯甲基磺酰氟(PMSF)及蛋白酶抑制剂(2 mg/L aprotinin,2 mg/L leupeptin)提取肾组织总蛋白,进行蛋白浓度测定和变性蛋白。取上样量80~100μg,转膜后用Western blot检测各指标变化。用5%牛血清蛋白(BSA)室温封闭1 h,一抗TLR4、TLR6、TLR8、TLR10和TLR11(1∶200稀释);TLR9(1∶250稀释);TLR1、TLR3、TLR5、NF-κB p65和phospho-NF-κB p65(1∶500稀释);TLR2、TLR7和IK-Bα(1∶1000稀释),4℃过夜。二抗分别加辣根过氧化物酶标记的抗羊、抗兔或抗鼠IgG(1∶1000稀释),室温孵育1 h,ECL显影。结果以β-Actin的蛋白表达为内参照,用AlphalmagerTM 2200凝胶图象分析系统,进行半定量分析。
1.4 RNA提取和逆转录
Trizol法提取肾脏组织RNA,按1 mL/100 mg组织在研磨 器 中 加 入Trizol试 剂(Invitrogen,Carlsbad,CA,USA)。RNA用紫外分光光度计测定浓度。用逆转录试剂盒(北京,全式金生物技术有限公司)将RNA反转录为cDNA模板。
1.5 实时定量聚合酶链反应(qRT-PCR)
用Takara公司DRR081A系统检测甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),白介素-12b(IL-12b),IL-6,趋化因子配体3(CCL3),CCL4,CCL5,细胞间黏附分子-1(intercellular adhesion molecule,ICAM-1),CD80和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA的表达。GAPDH为内参照。各基因引物序列见表1。反应体系20μL,包括:50 ng cDNA,0.4μmol/L引物和10μL 2×SYBR green buffer。每个样本重复3次。反应条件为94℃5 s、60℃30 s和72℃30 s,共40个循环。
数据分析采用CT值法[8],ΔCT=CT(靶基因)-CT(内参基因)。ΔCT值越高,表示表达量越低。△△CT=(CT靶基因-CT内参基因)实验组-(CT靶基因-CT内参基因)对照组。本实验对照组为3月龄组大鼠,实验组为12月龄组和24月龄组大鼠。相对于3月龄组大鼠,12月龄组和24月龄组大鼠改变的倍数(fold change)=2-ΔΔCT。

表1 qRT-PCR引物序列和产物长度
1.6 统计学方法
采用统计软件SPSS 17.0对数据进行分析,正态分布的计量资料以均数±标准差表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肾脏功能变化
12月龄组和24月龄组体重、肾重和尿蛋白/肌酐比值高于3月龄组,差异有统计学意义(P<0.05);24月龄组大鼠血BUN水平高于3月龄组,差异有统计学意义(P<0.05);而血SCR、GLU和CHOL水平三组差异无统计学意义(P>0.05)。24月龄组肾重和尿蛋白/肌酐比值高于12月龄组差异有统计学意义(P<0.05)。见表2。
表2 大鼠肾脏功能和代谢功能变化(±s)
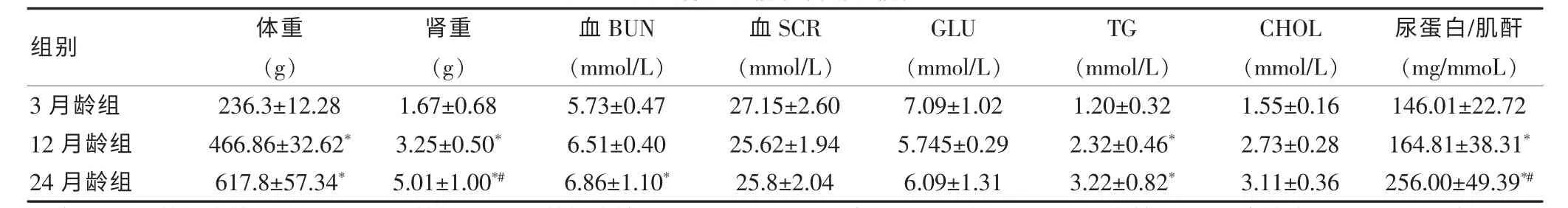
表2 大鼠肾脏功能和代谢功能变化(±s)
注:与3月龄组比较,*P<0.05;24月龄组与12月龄组比较,#P<0.05。BUN:尿素氮;SCR:血肌酐;GLU:血糖;TG:三酰甘油;CHOL:胆固醇
组别 体重(g)肾重(g)血BUN(mmol/L)血SCR(mmol/L)GLU(mmol/L)TG(mmol/L)CHOL(mmol/L)尿蛋白/肌酐(mg/mmoL)3月龄组12月龄组24月龄组236.3±12.28 466.86±32.62*617.8±57.34*1.67±0.68 3.25±0.50*5.01±1.00*#5.73±0.47 6.51±0.40 6.86±1.10*27.15±2.60 25.62±1.94 25.8±2.04 7.09±1.02 5.745±0.29 6.09±1.31 1.20±0.32 2.32±0.46*3.22±0.82*1.55±0.16 2.73±0.28 3.11±0.36 146.01±22.72 164.81±38.31*256.00±49.39*#
2.2 大鼠肾脏组织中TLRs分子表达水平变化
12月 龄 组 和24月 龄 组TLR2、TLR3、TLR4、TLR5、TLR11表达水平均高于3月龄组,24月龄组TLR1和TLR3水平高于3月龄组,24月龄组TLR9水平高于3月龄组,差异均有统计学意义(P<0.05);三组TLR6、TLR7、TLR10水平差异无统计学意义(P>0.05);TLR8未检测到。24月龄组TLR1、TLR2、TLR3、TLR4、TLR5、TLR11水平高于12月龄组,差异均有统计学意义(P<0.05)。见图1。
2.3 TLRs信号通路分子MyD88在衰老大鼠肾脏组织中的表达改变
12月龄组和24月龄组MyD88水平高于3月龄组,差异有统计学意义(P<0.05);24月龄组MyD88水平高于12月龄组,差异有统计学意义(P<0.05)。见图1。
2.4 NF-ΚB信号通路在在大鼠肾脏组织中的表达变化
利用Western blot检测了NF-κB信号通路分子的表达变化,12月龄组和24月龄组IK-Bα和活化的磷酸化NF-κB p65(Phospho-NF-κB p65)水平高于3月龄组,差异有统计学意义(P<0.05);24月龄组NF-κB p65水平高于3月龄组,差异有统计学意义(P<0.05)。24月龄组NFκB p65和Phospho-NF-κB p65水平高于12月龄组,差异有统计学意义(P<0.05)。见图2。
2.5 炎症因子在3组大鼠肾脏组织中的表达
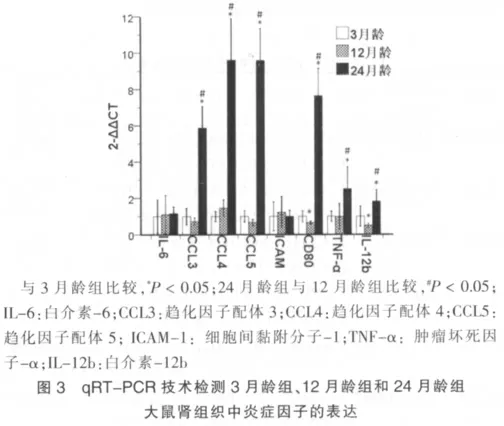
24月龄组CCL3、CCL4、CCL5、CD80、TNF-α和IL-12b水平高于3月龄组,差异有统计学意义(P<0.05);12月龄组CD80和IL-12b水平低于3月龄组,差异有统计学意义(P<0.05)。24月龄组CCL3、CCL4、CCL5、CD80、TNF-α和IL-12b高于12月龄组,差异有统计学意义(P<0.05)。见图3。
3 讨论
天然免疫(固有免疫)系统是由于其可以启动炎症和免疫反应以消除感染和修复受损组织而首先被发现的。TLRs在天然免疫和获得性(适应性)免疫诱导中发挥重要作用。TLRs广泛表达于树突状细胞、中性粒细胞、单核细胞、T细胞和B细胞等免疫细胞,也可表达于一些组织器官细胞。已发现肾小管上皮细胞可表达TLR1~TLR4和TLR6。TLRs亦可表达于肾小球细胞。例如TLR4 mRNA可以在足细胞、鲍曼氏囊和系膜细胞表达[9]。
TLRs(除TLR3)与病原体分子配体结合后可通过形成二聚体激活下游信号分子MyD88[10]。在静止状态下,IκBα和NF-κB结合而抑制NF-κB,使NF-κB在细胞质中处于静止状态。当MyD88被活化后可激活IKKβ,从而导致IκBα的素化而从IκB/NF-κB复合物中释放出来,NF-κB由此活化并转位入核,从而激活一系列致炎因子基因如IL-6、CCL3、CCL4、CCL5、ICAM1、CD80、TNF-α和IL-12b等的表达[11-12]。TLR3则可通过MyD88依赖性信号通路激活NF-κB。
近年研究发现TLRs与肾脏疾病的发生密切相关[13]。在系统性红斑狼疮性肾小球肾炎中TLR7和TLR9表达显著升高[14]。TLR2和TLR4在缺血再灌注肾损伤中发挥重要作用。研究发现TLR2基因缺失的小鼠可以免受功能性和组织性局部缺血的损害[15]。TLR1和TLR9在去铁铁蛋白(Apoferritin)诱导的肾炎中表达升高,且发现TLR9多态性和人类多种疾病包括IgA肾病相关[16]。研究发现,TLR3配体可以通过NF-κB信号通路诱导CD80在人类肾脏足细胞的表达[17]。TLR2和TLR4在糖尿病肾病中发挥重要作用,特别是在高脂饮食的大鼠糖尿病模型中,TLR4和其下游的IKKβ/NF-κB通路明显被激活[18-20]。但是,目前对TLRs系统在衰老肾脏中的作用尚不清楚。

本研究首次系统地分析了在大鼠肾脏衰老过程中TLRs信号通路分子、NF-κB信号通路分子以及炎症因子CCL3、CCL4、CCL5、CD80、TNF-α和IL-12b的表达变化情况,发现在衰老肾脏中TLR1、TLR2、TLR3、TLR4、TLR5和TLR11的表达显著升高,而TLR6、TLR7和TLR10则未见明显变化。随后检测了TLRs信号通路下游分子MyD88表达,发现在衰老肾脏中MyD88水平也显著升高。NF-κB是细胞内调控各种促炎因子表达的关键性转录因子,已发现TLR活化后可以激活NF-κB信号通路。本实验发现在衰老肾脏中NF-κB信号通路分子IκBα、NF-κB与Phospho-NF-κB表达明显升高,相应地,也发现在衰老肾脏组织中促进炎症因子CCL3、CCL4、CCL5、CD80、TNF-α和IL-12b的表达明显上调。这些结果显示TLRs系统可能通过激活NF-κB信号通路、促进炎症因子表达而在肾脏衰老过程中发挥重要作用。
近年研究表明免疫炎症可能与衰老相关性疾病的发生有关。已发现在老年人群体内炎症因子如TNF-α、IL-6、C-反应蛋白的血清水平显著增加,但是对炎症通过什么机制参与组织器官衰老则不太清楚。本研究显示TLRs系统与肾脏器官衰老的发生密切相关,这为今后进一步明确肾脏衰老的机制提供了一种新方向。
[1]Wang CY,Cusack JC,Liu R,et al.Control of inducible chemoresistance:enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-kappaB[J].Nat Med,1999,5(4):412-417.
[2]Kleinridders A,Schenten D,Konner AC,et al.MyD88 signaling in the CNS is required for development of fatty acid-induced leptin resistance and diet-induced obesity[J].Cell Metab,2009,10(4):249-259.
[3]Takeuchi O,Akira S.Pattern recognition receptors and inflammation[J].Cell,2010,140(6):805-820.
[4]Cai W,He JC,Zhu L,et al.Oral glycotoxins determine the effects of calorie restriction on oxidant stress,age-related diseases,and lifespan[J].Am J pathol,2008,173(2):327-336.
[5]Baylis C.Changes in renal hemodynamics and structure in the aging kidney;sexual dimorphism and the nitric oxide system[J].Expl gerontol,2005,40(4):271-278.
[6]Davalos AR,Coppe JP,Campisi J,et al.Senescent cells as a source of inflammatory factors for tumor progression[J].Cancer Metastasis Rev,2010,29(2):273-283.
[7]Coresh J,Selvin E,Stevens LA,et al.Prevalence of chronic kidney disease in the United States[J].JAMA,2007,298(17):2038-2047.
[8]Lee EJ,Schmittgen TD.Comparison of RNA assay methods used to normalize cDNA for quantitative real-time PCR[J].Anal Biochem,2006,357(2):299-301.
[9]Brown HJ,Lock HR,Wolfs TG,et al.Toll-like receptor 4 ligation on intrinsic renal cells contributes to the induction of antibody-mediated glomerulonephritis via CXCL1 and CXCL2[J].J Am Soc Nephrol,2007,18(6):1732-1739.
[10]Anderson KV.Toll signaling pathways in the innate immune response[J].Curr Opin Immunol,2000,12(1):13-19.
[11]Kawai T,Akira S.Signaling to NF-kappaB by Toll-like receptors[J].Trends Mol Med,2007,13(11):460-469.
[12]Judge S,Jang YM,Smith A,et al.Age-associated increases in oxidative stress and antioxidant enzyme activities in cardiac interfibrillar mitochondria:implications for the mitochondrial theory of aging[J].FASEB J,2005,19(3):419-421.
[13]Robson MG.Toll-like receptors and renal disease[J].Nephron Exp Nephrol,2009,113(1):e1-7.
[14]Smith KD.Toll-like receptors in kidney disease[J].Curr Opin Nephrol Hypertens,2009,18(3):189-196.
[15]Leemans JC,Stokman G,Claessen N,et al.Renal-associated TLR2 mediates ischemia/reperfusion injury in the kidney[J].J Clin Invest,2005,115(10):2894-2903.
[16]Lafyatis R,Marshak RA.Toll-like receptors and innate immune responses in systemic lupus erythematosus[J].Arthritis Res Ther,2007,9(6):222.
[17]Shimada M,Ishimoto T,Lee PY,et al.Toll-like receptor 3 ligands induce CD80 expression in human podocytes via an NF-kappaBdependent pathway[J].Nephrol Dial Transplant,2012,27(1):81-89.
[18]Lin M,Yiu WH,Wu HJ,et al.Toll-like receptor 4 promotes tubular inflammation in diabetic nephropathy[J].J Am Soc Nephrol,2012,23(1):86-102.
[19]Li F,Yang N,Zhang L,et al.Increased expression of toll-like receptor 2 in rat diabetic nephropathy[J].Am J Nephrol,2010,32(2):179-186.
[20]Milanski M,Degasperi G,Coope A,et al.Saturated fatty acids produce an inflammatory response predominantly through the activation of TLR4 signaling in hypothalamus:implications for the pathogenesis of obesity[J].J Neurosci,2009,29(2):359-370.
