胃癌患者外周血中CK-19的表达及其临床意义
2013-12-23陈玉敏王金林师锁江
陈玉敏 王金林 师锁江 崔 杰
1.陕西省安康市中心医院肿瘤科,陕西安康 725000;2.广东省东莞市人民医院普外科,广东东莞 523059;3.陕西省安康市中心医院肾病科,陕西安康 725000
胃癌是最常见的恶性肿瘤之一,有发病率高、转移率高、病死率高、早期诊断率低、根治切除率低、5年生存率低等特点。胃癌的死亡大多由于手术及化疗后的复发和转移,因此肿瘤微残留或微转移是影响胃癌患者预后的重要因素。RT-PCR已广泛应用于检测肿瘤患者在外周血、淋巴结、骨等病灶的微转移,且显示了较高的敏感性和特异性[1]。在影像学意义上,当肿瘤细胞还没有形成转移结节前,某些肿瘤相关标志物就会出现在外周血内。因此,选择合适的RT-PCR扩增标志物是关键之处。角蛋白家族(CK)及多形上皮细胞粘蛋白(polymorphic epothelial mucin)是目前研究较多的胃癌微转移肿瘤标志物[2],二者都在上皮来源的恶性肿瘤中有表达。CK-19作为细胞角蛋白家族的一种主要分布于上皮组织内,是构成细胞骨架的中间微丝[3],其已被认为是检测循环癌细胞的敏感标志物[4]。MUC-1是多形上皮细胞黏蛋白(polymorphic epothelial mucin)的核心蛋白基因,已有人将其应用于RT-PCR检测乳腺癌细胞淋巴结微转移[5]。本研究用荧光定量RT-QPCR方法探讨早期胃癌患者外周血CK-19 mRNA及MUC-1 mRNA的表达的意义。
1 材料与方法
1.1 标本采集和保存
采集陕西省安康市中心医院2009年3月~2012年3月期间住院的96例初治胃癌患者,男56例,女40例;腺癌37例,鳞癌23例,腺鳞癌21例,其他类型15例;年龄>60岁71例,≤60岁25例;分期Ⅰa期13例,Ⅰb期24例,Ⅱ期59例;并采集30例胃良性疾病患者和30例健康人的外周血作为对照组。比较三组人群在年龄、病理类型、性别和原发部位等一般情况,其差异不存在统计学意义(上述4个因素均P>0.05,表2)。胃腺癌MGC-803细胞株为本单位保存。血液标本均为空腹外周静脉血,负压抽取,并弃首1 mL,以防上皮细胞污染标本,后抽取约1 mL外周血标本(肝素抗凝)。将血液标本和对照细胞抽提总RNA后逆转录成cDNA分成2份,于-20℃冻存保存,在6个月内进行下一步的RT-PCR反应。
1.2 实验方法
1.2.1 外周血总RNA的抽提 外周血中总RNA用吸附柱抽提后,通过紫外分光光度法和1%琼脂糖凝胶凝胶电泳检测RNA,确定其浓度、纯度及完整性。由Genebank中查得相应序列,并查阅相关文献[6-7],设计CK-19 mRNA及MUC-1 mRNA的引物,3-磷酸甘油醛脱氢酶(GAPDH)内参照引物,由Takara生物科技公司合成,序列如下:CK-19 mRNA(正 义 链):5’-AGGTGGATTCCGCTCCGGGCA-3’;CK-19 mRNA(反义链):5’-ATCTTCCTGTCCCTCGAGCA-3’;扩增片段460bp;MUC-1mRNA(正义链):5’-ATGCCAGTAGCACT CACCATAG-3;MUC-1 mRNA(反义链):5’-CAGCCAAG GCAATGAGATAGAC-3’;扩增片段510 bp;GAPDH(正义链):5-ACCACAGTCCATGCCATCAC-3’;GAPDH(反义链):5-TCCACCACCCTGTTGCTGTA-3’;扩增片段452 bp。为保证本部分实验筛选出的标本能够符合RT-QPCR实验的要求,本部分用于RT-PCR与RT-QPCR实验使用的引物序列应保持一致,
1.2.2 cDNA一条链的制备 根据测得的RNA浓度加入2μg作为模板,RNA,总反应体系为20μg,照循cDNA合成试剂盒(Tiangen Biotech)说明,合成cDNA,于-20℃保存。
1.2.3 逆转录PCR反应 RT-PCR反应体系为20μL:DEPC水12μL,cDNA 2.5μL,正反义链引物(浓度为10μmol/L)各1μL,TakaRa Taq酶0.5μL,dNTP 2.0μL,10×PCR Buffer 2.0μL。CK-19 PCR扩增:95℃预变性2 min;95℃变性15 s、60.5℃退火10 s、70℃延伸45 s,30个循环;70℃终延伸2 min。MUC-1的反应条件为:95℃预变性5 min;94℃变性45 s,55℃退火45 s,68℃延伸1 min,35个循环,68℃终延伸7 min。1%琼脂糖凝胶电泳进行结果观察,在460 bp处有条带的为CK-19阳性表达样本,否者为阴性;在510 bp处有条带的为MUC-1阳性表达样本,否则为阴性。实验组中,阳性对照为MGC-803细胞株。根据结果,筛选出有CK-19mRNA表达的cDNA,进行下一步的RTQPCR反应。
1.2.4 RT-QPCR反应 实验中每个样本都有内标。模板来自RT-PCR反应筛选结果,44例CK-19 mRNA阳性表达的cDNA。其中T1N0期胃癌患者中:高分化1例,中分化1例、低分化2例,未分化0例;T1N1期胃癌患者:高分化1例,中分化3例,低分化6例,未分化5例;Ⅱ期胃癌患者:高分化2例,中分化4例,低分化10例,未分化9例。RTQPCR实验中,根据Golden Easy PCR Kit试剂盒(Tiangen Biotech)说明书,反应体系为25μL:20×SYBR solution与2.5×Real Master Mix混合后取11.25μL、水10.75μL、正反义链引物(浓度为10μmol/L)各1μL、模板1μL。RTQPCR反应条件,参考RT-PCR反应条件设定:95℃预变性2 min、95℃变性15 s、60.5℃退火30 s,30个循环;最后阶段:94℃变性15 s、60℃退火30 s、72℃延伸30 s。
1.3 统计学方法
本文使用SPSS 16.0软件对RT-PCR反应的结果进行分析,对数据的χ2检验,并用Fisher确切概率法处理,以P<0.05为差异具统计学意义。对44例胃癌患者的RT-QPCR反应结果数据统计后,用MedCalc统计分析软件进行分析,统计绘制受试者工作特征曲线(ROC曲线),计算AUC(当AUC在0.7~0.9时具一定准确性),选定分界值,从而找出诊断试验最佳特异性和微转移诊断敏感性的效果临界值。
2 结果
2.1 抽提总RNA的检测
抽提的总RNA的检测 对试验中抽提的RNA,在1%琼脂糖凝胶上电泳溴化乙锭(EB)染色,测定OD260nm,OD260nm/OD280nm。凝胶电泳结果,两条RNA主带清晰,28s条带约是18s条带亮度的2倍,并且测得OD260nm/OD280nm值在1.80~1.99之间。说明抽提的RNA可用于逆转录合成cDNA。结果见图1。
图1 部分样本RNA提取结果
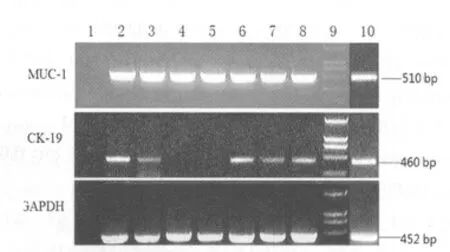
图2 实验组及对照组RT-PCR电泳
2.2 RT-PCR的结果及其分析
2.2.1 CK-19 mRNA、MUC-1 mRNA在外周血中的表达 部分外周血标本经RT-PCR,凝胶电泳结果见图2。凝胶电泳后,在成像系统下,有MUC-1,CK-19 mRNA表达的标本分别在510 bp和460 bp处有条带出现。
2.2.2 CK-19 mRNA及MUC-1mRNA在外周血中的表达 96例胃癌患者、30例胃部良性疾病患者、30例健康人外周血标本中,CK-19 mRNA、MUC-1 mRNA的阴性,阳性样本数据分析,合并后与胃癌组比较采用χ2检验,可见CK-19 mRNA组差异具有高度统计学意义(P<0.01),MUC-1 mRNA组差异无统计学意义(P>0.05)。结果见表1。

表1 外周血中CK-19 mRNA、MUC-1mRNA的表达(例)
2.2.3 影响CK-19 mRNA表达的临床相关因素 因MUC-1 mRNA无统计学意义(P>0.05)不适合作为胃癌在外周血中微转移的分子标志,故不再进行后续的分析。χ2检验CK-19 mRNA的表达与临床相关因素的相关性,早期胃癌外周血中CK-19 mRNA的表达,与胃癌的分化程度、TNM分期差异有统计学意义(P<0.05),而与年龄、性别、是否吸烟、病理类型等无关(P>0.05)。见表2。
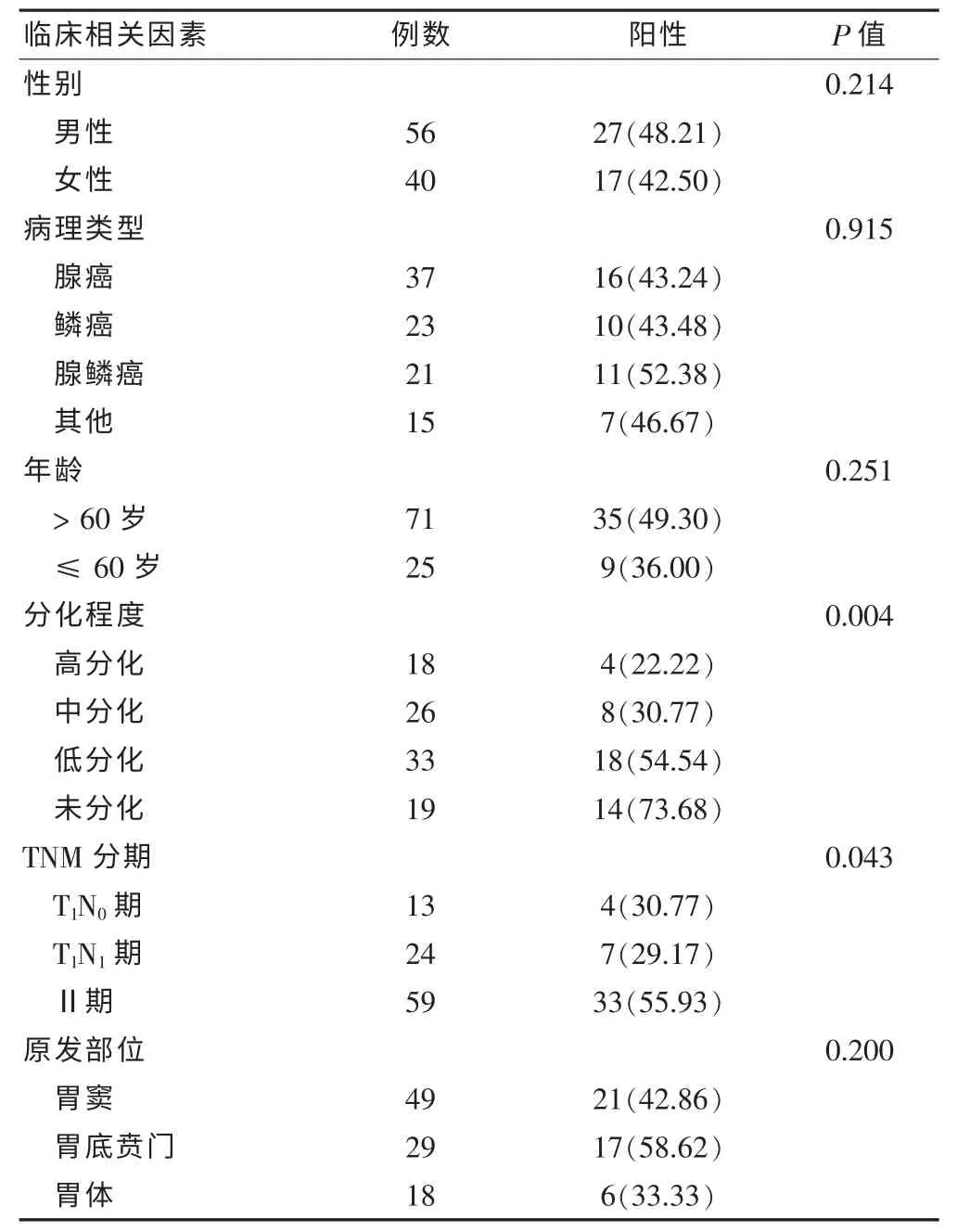
表2 CK-19 mRNA表达与临床相关因素[n(%)]
2.3 RT-QPCR反应结果
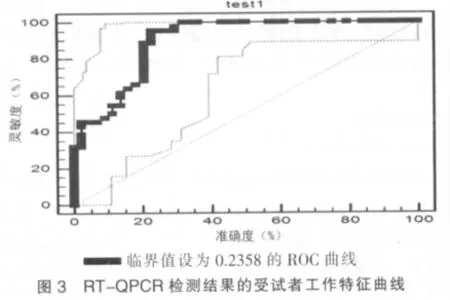
ROC曲线分析:于置信区间(95%)内,效果临界值设为0.2358时,44例RT-QPCR阳性样品,42例高于此截断值,假阴性2例。ROC曲线准确度和灵敏度分别为77.37%和95.45%,AUC值为0.897,具一定准确性。结果见图3。
3 讨论
3.1 CK-19作为胃癌外周血微转移的分子标志
目前确定微转移的主要方法是对外周血中肿瘤标志物的检测[8]。CK-19作为角蛋白中的一种,主要分布在单层上皮细胞中,在胃癌细胞当中角蛋白的含量升高[9]。而外周血中不含有上皮细胞,即无CK-19蛋白表达,故如果在胃癌患者的外周血中检测到CK-19 mRNA,即可诊断为微转移[7-10]。
使用外周血肿瘤标志物诊断微转移,是只需要患者提供血液样本,并可进行高通量,高灵敏度的检测[11-12]。本研究使用CK-19 mRNA作为分子标志物,通过RT-QPCR技术来检测早期胃癌患者外周血微转移,实验发现外周血中CK-19 mRNA的表达与胃癌的统计学相关性较大,较MUC-1 mRNA更适合作为分子标志物。通过RT-QPCR技术来检测其表达,监测早期胃癌患者外周血微转移是有效可行的。
3.2 CK-19 mRNA在外周血表达的诊断意义
ROC曲线的评价方法,是根据实际情况,把结果分别划分为正常、大致正常、可疑、大致异常和异常五个区间,再进行进一步的统计分析。根据分界值以假阳性率(1-特异度)为横坐标、真阳性率(灵敏度)为纵坐标绘制ROC曲线;该曲线坐标左上角的准确性最高,提示假阳和假阴性的总数最少,而AUC的正常值应在0.5~1.0,并且越接近于1,则诊断效果越接近真实。笔者以44例胃癌患者的数据,绘制ROC曲线,将健康对照组均值的95%可信区间的上限作为分界值,找出诊断试验效果最好即特异性和敏感性最高的临界值,并计算AUC。
本研究是用通过RT-QPCR法检测初治早期的胃癌患者的外周血微转移,期望在目前没有统一的仪器、实验方法、实验试剂且各研究结果之间存在一定的分歧的研究现状下,为临床诊断微转移提供一个方法。外周血中CK-19 mRNA可以作为胃癌微转移的一个较理想的分子标志。而在诊断结果的判读上使用ROC曲线,由于其不固定分类界值,是依靠使用者的专业知识来分析确定。标准过于放宽可能会将正常的样本纳入阳性的范围;标准过于严格,又可能会错误判断,耽误患者治疗或者是漏掉阳性。笔者期望今后能进行更大样本量的分析,以进一步完善诊断模型。且若存在微转移情况是否预示着该患者后续病情会更差,或是在手术后胃癌更容易复发,暂时还没有研究进行探究,需要有足够样本数量的临床研究以及患者后续的观察记录进一步验证。
[1]杨士军,陆卫平,鲍艳梅,等.血清CK18及CA72-4水平在胃癌诊治中的临床价值[J].国际检验医学杂志,2012,33(13):1593-1594.
[2]丁明锋,许军,刘昶.RT-PCR扩增细胞角质蛋白CK20mRNA诊断胃癌腹膜微转移的研究[J].现代肿瘤医学,2012,20(6):1152-1154.
[3]何成全,詹乾钢,单水阳,等.胃癌患者外周血中CK19,CK20表达的临床研究[J].中国肿瘤临床,2005,32(7):401-403.
[4]彭云香,毛静涛,魏君,等.CK19和EpCAM在胃癌组织中表达的循证分析[J].吉林大学学报:医学版,2011,37(2):296-299.
[5]王永强,欧阳晓辉,王万祥.巢式PCR检测胃癌患者外周血CK19mRNA的临床意义[J].内蒙古医学杂志,2011,43(3):268-270.
[6]Peck K,Sher YP,Shih JY,et al.Detection and quantitation of circulating cancer cells in peripheral blood of lung cancer patients[J].Cancer Res,1998,58(13):2761-2765.
[7]章希炜,范萍,杨宏宇,等.胃肠道恶性肿瘤外周血微转移的检测及其临床意义[J].中华肿瘤杂志,2003,25(1):66-68.
[8]赵宏伟,刘宏斌,韩晓鹏,等.流式细胞术在胃癌腹膜转移诊断中的应用价值[J].中国肿瘤临床,2009,(12):661-664.
[9]Suo Z,Holm R,Nealand JM,et al.Squamous cell carcinomas:an immunohistochemical study of cytokeratina and involucrin in primary and metastatictumors[J].Histopathology,1993,23(1):45-54.
[10]Benlloch S,Galbis J,Peiro FM,et al.Role of CEA,PLUNC and CK19 mRNA expression in lymph nodes from resected stage I non-small celllungcancer(NSCLC)patients(p)asmarkersofoccultmicrometastasis:a pilot etudy[J].Jpn J Clin Oncol,2005,23(16S):9654.
[11]Pelkey TJ,Frison HF,Bruns G,et al.Molecular and immunological detection of circulating tumor cells and micrometastasis from solid tumor[J].Clin Chem,1996,2(9):1369-1381.
[12]侯睿哲,彭云香,毛静涛,等.胃癌表达EpCAM和CK19临床意义的研究[J].中国实验诊断学,2010,14(5):707-709.
