维生素C 对CD4 + 效应记忆性T 细胞体外扩增的影响*
2013-12-23张译文罗海华
张译文, 罗海华, 张 旭, 张 辉, 刘 超
(中山大学人类病毒学研究所,热带病防治研究教育部重点实验室,广东 广州510080)
人类免疫缺陷病毒1 型(human immunodeficiency virus 1,HIV-1)感染导致的艾滋病疗法(acquired immune deficiency syndrome,AIDS)是本世纪威胁人类健康的重大传染病。目前,国际上多采用高效抗逆转录病毒疗法(highly active antiretroviral therapy,HAART)治疗艾滋病。HAART 可在短期内将病毒载量控制在较低的水平,改善艾滋病患者的生存质量,但不能完全清除体内病毒,需终身服药,且HAART费用昂贵,有严重的副作用,易耐药[1]。随着我国HIV-1 感染人数的日益增加,亟待研发新的行之有效的抗病毒治疗方法。
近年来,利用免疫细胞过继治疗的方法成为了HIV-1 临床治疗的一大热点。随着研究的不断深入,发现特异性T 淋巴细胞对艾滋病患者的病毒清除和免疫重建疗效显著[2]。人体内的特异性T 淋巴细胞分为CD4+T 细胞和CD8+T 细胞。CD4+T 细胞通过提呈抗原并介导体液免疫和细胞免疫。T 淋巴细胞分为3 个亚群,初始T 淋巴细胞、效应性T 淋巴细胞及记忆性T 淋巴细胞[3]。而记忆性T 细胞则又可以根据是否具有快速的效应功能和表达相应的归巢受体C-C 趋化因子受体7(C-C chemokine receptor 7,CCR7)和L-选择素(L-selectin,CD62L)划分为2 个功能亚群:中央记忆性(central memory T cells,TCM)和效应记忆性T 细胞(effector memory T cells,TEM)[4-7]。在HIV-1 病毒感染过程中,虽然记忆性T细胞介导的免疫反应在清除HIV-1 病毒方面发挥了关键性作用,但是TEM 在病毒控制上效果更为显著[8]。由于TEM 细胞在T 细胞的总数中占的比例非常小,用传统的体外扩增方法难以获得。维生素C(vitamin C,VC)作为一种小分子药物,最早在临床上用于坏血病的治疗,其抗氧化作用被广泛应用。近年来的研究发现,VC 在抑制肿瘤生长[9-10]上发挥了一定的作用,并且可高效地维持干细胞的存活和自我更新[11-12]。为了在体外获得大量的CD4+TEM,提高过继免疫治疗的效果,本研究首次利用VC 在体外成功地促进了CD4+TEM 的大量扩增。
材 料 和 方 法
1 材料
人的外周成分血由广州市血液中心提供,随机选取了10 份健康人的血液。主要试剂:RPMI-1640培养基购于Invitrogen;胎牛血清购于Gibco;VC 购于Sigma;淋巴细胞分离液购于天津灏阳生物制品有限责任公司;流式细胞仪检测抗体anti-CD4-PE、anti-CD27-FITC、anti-CCR7-PECY5 和5,6-羧基荧光素二乙酸盐琥珀酰亚胺脂(5,6-carboxyfluorescein diacetate succinimidyl ester,CFSE)购于BD;anti-CD45RAECD 购于Beckman;CD4+T 细胞阴性选择磁珠购于BD;CellTiter 96 AQueous One Solution 试剂盒购自Promega。
2 仪器
倒置生物显微镜(Leica)、CO2细胞培养箱(Thermo Scientific)、台式高速离心机(Eppendorf Centrifuge 5810R)、生物安全柜(Thermo Scientific)、流式细胞仪(Beckman Coulter)和磁珠分选磁力架(BD Pharmigen)。
3 主要方法
3.1 细胞分离 将外周成分血与PBS(含2% BSA和0.5% EDTA)按1∶4 混合均匀;然后将稀释后的成分血液以1∶1 比例缓慢加入淋巴细胞分离液的上方;1 450 r/min 离心45 min;小心吸取单核细胞,加入另一离心管中,用5 倍体积的PBS(含0.5% BSA和2% EDTA)稀释,混合均匀后,300 × g 离心15 min;重复上一步骤1 次;孵育CD4+T 细胞阴选试剂I 抗,15 min;用10 倍体积的PBS(含0.5% BSA 和2% EDTA)稀释,300 ×g 离心15 min;磁珠II 抗孵育,30 min;进行过柱细胞分选,得到CD4+T 细胞,加入含10%胎牛血清的RPMI-1640 重悬细胞,计数细胞后调整细胞至所需浓度。
3.2 培养条件 将5 ×106cells/well CD4+T 细胞置于1 mL 含10%胎牛血清的RPMI-1640 中培养。在5% CO2、饱和湿度及37 ℃下进行。
3.3 添加VC 及细胞因子 将分离好的CD4+T 细胞进行计数并分为2 组;每组均以5 ×106cells /well铺于12 孔板中,每孔加入anti-CD3、anti-CD28、IL-7和IL-15;在实验组的每孔细胞中额外加入不同浓度的VC(50 mg/L、75 mg/L、100 mg/L 和125 mg/L)。
3.4 细胞亚群分析及细胞数量的检测 细胞培养第0 天、10 天和15 天,吸取培养孔中的细胞,用细胞计数仪进行计数;再将细胞,300 ×g 离心15 min,用PBS 洗涤细胞2 次,孵育检测CD4+TEM 的流式抗体(CD45RA、CD27 和CCR7)30 min;加入5 倍体积的PBS 稀释,300 ×g 离心10 min 洗掉流式抗体,加入PBS 重悬至需要的细胞密度,使用流式细胞仪进行检测。对照组与实验组均为同一供体的CD4+T细胞。从CD4 阳性(F 区域)和CD45RA 阴性(L 区域)的细胞中选取CD27 与CCR7 双阴性的细胞(J3区域),即为所要观察的CD4+TEM,见图1。
3.5 流式细胞术检测细胞增殖 从分选得到的不同供体的CD4+T 细胞中吸取细胞5 ×105个,300 ×g 离心15 min,用PBS 洗涤细胞2 次,孵育检测增殖的流式抗体CFSE 30 min,细胞严格避光培养5 d,加入PBS 洗涤细胞2 次,稀释到使用浓度,运用流式细胞术检测。对照组与实验组均为同一供体来源的CD4+T 细胞。
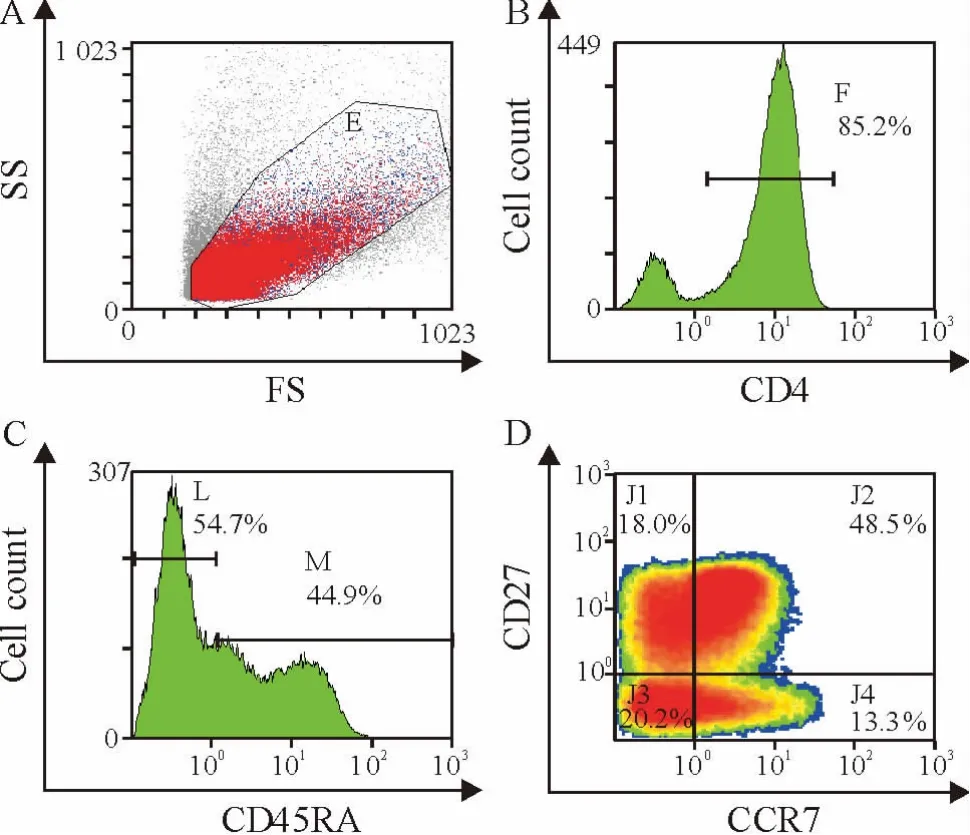
Figure 1. Detection of CD4 + TEM by flow cytometry. A:prepared cells were gated with E region;B:prepared cells were stained for CD4 and regated with F region from E region to get CD4-positive cells;C:prepared cells were staining for CD45RA and regated with L region from E region to get CD45RA-negative cells;D:prepared cells were stained for CCR7 and CD27,and regated with J3 region from F and L regions to get CCR7 - CD27 - cells.图1 流式细胞术检测CD4 + TEM
3.6 MTS 法测定细胞活性 将分离好的CD4+T 细胞进行计数并分为2 组;每组均以1 ×105cells /well铺于96 孔板中,每孔加入anti-CD3、anti-CD28、IL-7和IL-15;在实验组的每孔细胞中加入100 mg/L VC,培养15 d 之后,每孔加入20 μL MTS[3-(4,5-dimethylthiazol-2-yl )-5-(3-carboxymethoxyphenyl )-2-(4-sulfophenyl)-2H-tetrazolium,inner salt]溶液,在5%CO2、饱和湿度及37 ℃下孵育3 h 后测定490 nm 吸光度(absorbance,A)。
4 统计学处理
采用SPSS 13.0 分析软件。数据用均数±标准差(mean±SD)表示。组间均数比较使用t 检验或单因素方差分析,以P <0.05 为差异有统计学意义。
结 果
1 VC 对于CD4+ T 细胞总数扩增效果的检测
VC 处理第10 天对照组细胞数量为(9.29 ±0.81)×106;加50 mg/L VC 的细胞数量为(9.43 ±0.41)×106;加75 mg/L VC 的细胞数量为(9.13 ±0.76)×106;加100 mg/L VC 的细胞数量为(9.21 ±0.15)×106;加125 mg/L VC 的细胞数量为(8.75 ±0.16)×106。对扩增结果进行CFSE 检测,表示增殖的阳性峰在对照组和实验组之间没有差异。上述实验结果均显示,VC 对于CD4+T 细胞的总量扩增没有显著影响,见图2。
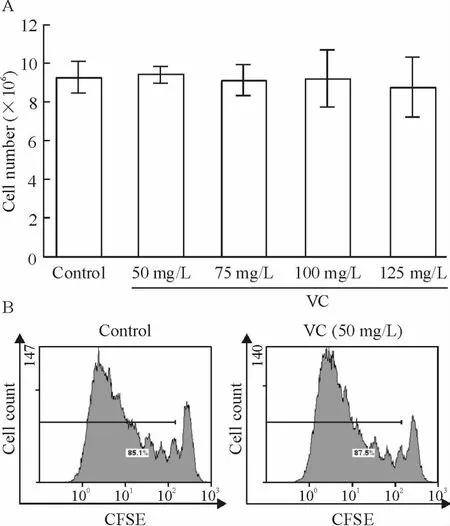
Figure 2. Effect of VC on CD4 + T cell amplification.A:CD4 + T cells were treated with 500 μg/L anti-CD3,500 μg/L anti-CD28,1 mg/L IL-7 and 1 mg/L IL-15,and cultured for 10 days with different concentrations (50 mg/L,75 mg/L,100 mg/L and 125 mg/L)of VC. Cells were analyzed by cell counter. B:CD4 + T cells were stained with CFSE and subsequently activated and expanded with or without VC (50 mg/L)for 5 days.The mean CFSE fluorescence of CD4 + T cells was measured by flow cytometry. Mean±SD. n=10.图2 VC 对CD4 + T 细胞扩增的影响
2 VC 对CD4+ TEM 在CD4+ T 细胞中所占比例的影响
在CD4+T 细胞中,CD4+TEM 的比例随着VC浓度的增加而逐渐增加。对照组CD4+TEM 在CD4+T 细胞中占13.10%;VC 50 mg/L 组CD4+TEM 在CD4+T 细胞中占17.9%;VC 75 mg/L 组CD4+TEM 在CD4+T 细胞中占27.6%;VC 100 mg/L 组CD4+TEM 在CD4+T 细胞中占38.6%;VC 125 mg/L 组CD4+TEM 在CD4+T 细胞中占30.1%。上述结果表明,VC 对于CD4+TEM 细胞的比例扩增作用在低于100 mg/L 的情况下存在剂量依赖的趋势,并且100 mg/L 是促进TEM 细胞比例增加的最佳浓度,见图3。
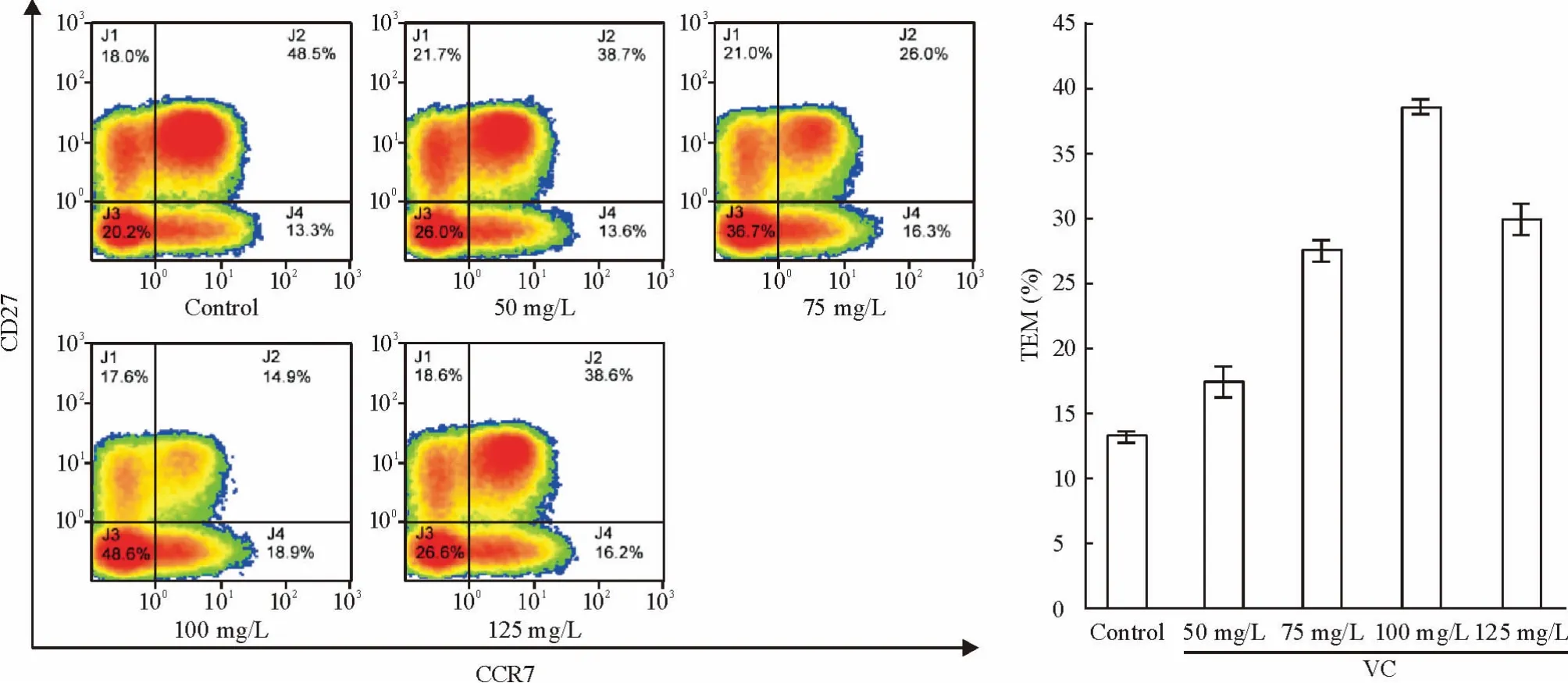
Figure 3. Effect of different concentrations of VC on the proportion of CD4 + TEM in CD4 + T cells.CD4 + T cells were cultured with indicated treatments for 10 days. Mean±SD.n=10.图3 VC 对CD4 + TEM 细胞比例的影响
3 VC 对CD4+ TEM 数量的影响
100 mg/L VC 处理细胞后,第0 天,对照组和实验组细胞数量为均1 ×105;第10 天,对照组细胞数量为(1.23 ±0.15)×106,实验组细胞数量为(3.56±0.35)×106;第15 天,对照组细胞数量为(1.85 ±0.75)× 106,实验组细胞数量为(5.47 ± 0.11)×106,见图4。选取扩增效果达到最高点(第15 天)的2 组CD4+TEM 细胞数量进行比较,对照组为(1.85±0.75)×106,实验组为(5.47 ±0.11)×106,2 组间细胞数量差别有统计学意义(P <0.01)。
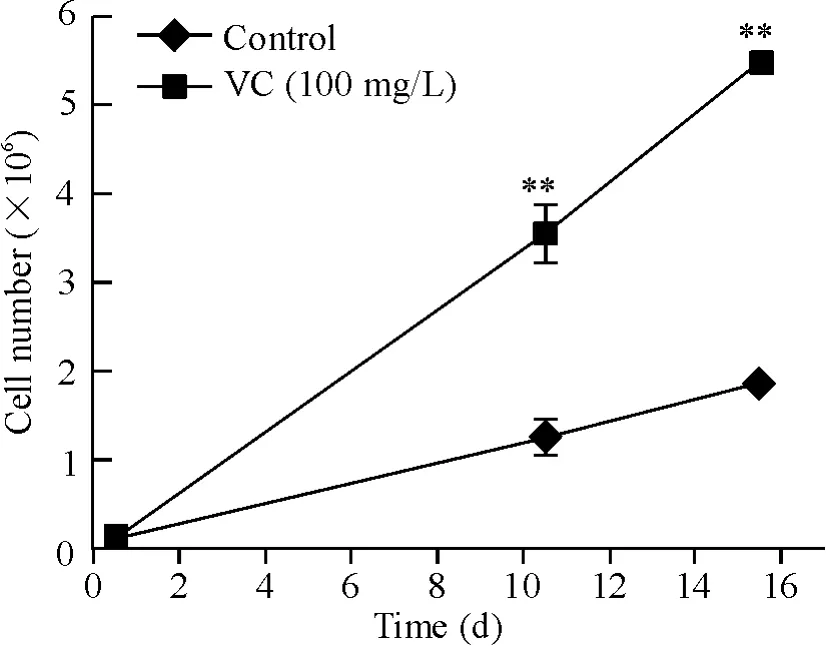
Figure 4. Effect of VC on CD4 + TEM number at different time points. Mean±SD.n=3. **P <0.01 vs control at the same time point.图4 VC 对CD4 + TEM 数量的影响
4 VC 对细胞活性的影响
100 mg/L VC 处理细胞后,第15 天对照组的吸光度值为0.715 ±0.010,实验组的吸光度值为0.676±0.010,两组间没有显著差异,见图5。
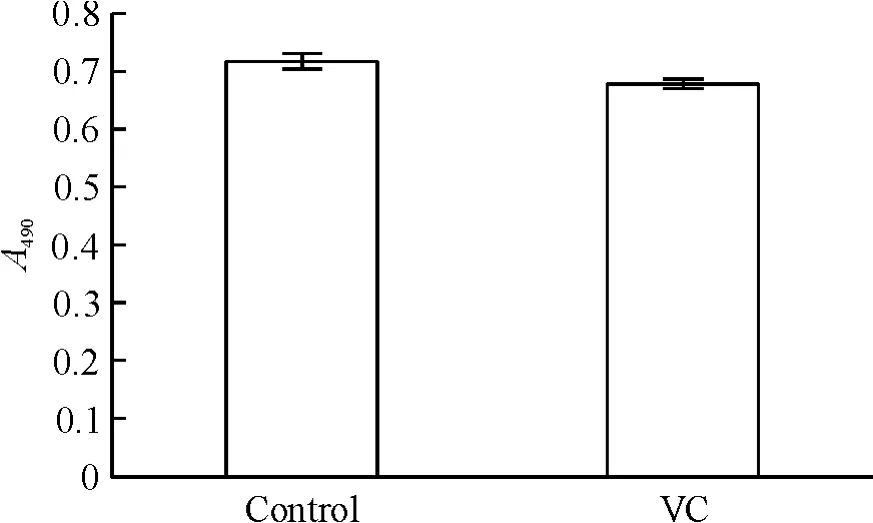
Figure 5. Effect of VC on CD4 + T cell viability. CD4 + T cells were treated with 100 mg/L VC. After 15 days of culture,the cell viability was tested by MTS assay.Mean±SD.n=3.图5 VC 对细胞活性的影响
讨 论
T 细胞的体外扩增一直是免疫过继治疗的一大热点,目前一些研究者使用人工抗原来提呈细胞,在体外提高T 细胞的增殖并用于过继治疗,但是此技术成本高且尚无法保证临床治疗的安全性[13]。在本研究中,我们首次利用小分子药物VC 促进CD4+TEM 细胞在体外的扩增。实验组中,CD4+T 细胞的总数没有明显变化;但较之对照组,其CD4+TEM 细胞的比例在CD4+T 细胞中显著升高;通过对CD4+TEM 数量的检测,在实验组中发现CD4+TEM 细胞数量显著增多。
T 细胞的免疫过继治疗当中,如果大量的过继转移T 细胞会产生过激反应,在实验过程中,我们找到了在T 细胞总数不变的情况下,将大量初始T 细胞转化为CD4+TEM 细胞的方法。实验中我们也进一步找出了VC 可促进CD4+TEM 在体外扩增的最适浓度:VC 100 mg/L。我们发现,使用较低剂量的VC处理细胞后,CD4+TEM 在CD4+T 细胞中的比例上升存在显著的剂量依赖趋势;而当VC 的浓度达到125 mg/L 时,CD4+TEM 在CD4+T 细胞中的比例上升的效果却开始明显下降(图3),这可能是由于药物浓度过大使得细胞的生长环境发生了较大改变从而影响了细胞的正常生长。本实验选取VC 处理细胞10 d 以后进行计数和检测是由于在外周血中CD4+TEM 的起始数量非常少,CD4+T 细胞需要较长的时间才能在anti-CD3 与anti-CD28 共同刺激下逐渐形成较多的CD4+TEM。实验结果也表明选择培养较长时间后进行检测可获得更好的效果(图2、4)。同时,我们采用MTS 法对使用最佳扩增浓度100 mg/L 的VC 刺激细胞15 d 的细胞活性进行了检测,对照组和实验组在490 nm 处的吸光度值没有显著差异(图5)。由此也证明,使用100 mg/L VC 在体外长时间扩增TEM 细胞不会使细胞活性受到损害。
VC 作为一种抗氧化剂,无毒副作用,易获得,作为常用的小分子药物具有较高的生物安全性,广泛用于临床医疗[14-15]。VC 对CD4+TEM 的体外扩增作用可作为新型的过继免疫治疗方式用于艾滋病的临床治疗当中,其作用机制还有待进一步研究。
[1] 李太生,王爱霞,邱志峰. 艾滋病的免疫发病机制和免疫重建[J]. 中华医学杂志,2001,81(5):310-313.
[2] 张 政,王福生. 过继性免疫细胞治疗HIV 感染者/艾滋病患者的研究进展[J]. 中华医学杂志,2005,85(47):3378-3381.
[3] Lanzavecchia A,Sallusto F. Dynamics of T lymphocyte responses:intermediates,effectors,and memory cells[J].Science,2000,290(5489):92-97.
[4] 徐 林,熊思东. 中枢记忆性T 细胞和效应记忆性T细胞[J]. 科技导报,2006,24(12):20-22.
[5] Pepper M,Jenkins MK. Origins of CD4+effector and central memory T cells[J]. Nat Immunol,2011,12(6):467-471.
[6] Sallusto F,Geginat J,Lanzavecchia A. Central memory and effector memory T cell subsets:function,generation,and maintenance[J]. Annu Rev Immunol,2004,22:745-763.
[7] Masopust D,Kaech SM,Wherry EJ,et al. The role of programming in memory T-cell development[J]. Curr Opin Immunol,2004,16(2):217-225.
[8] Hansen SG,Ford JC,Lewis MS,et al. Profound early control of highly pathogenic SIV by an effector memory Tcell vaccine[J]. Nature,2011,473(7348):523-527.
[9] Frei B,Lawson S. Vitamin C and cancer revisited[J].Proc Natl Acad Sci U S A,2008,105(32):11037-11038.
[10]Chen Q,Espey MG,Sun AY,et al. Pharmacologic doses of ascorbate act as a prooxidant and decrease growth of aggressive tumor xenografts in mice[J]. Proc Natl Acad Sci U S A,2008,105(32):11105-11109.
[11] Chung TL,Brena RM,Kolle G,et al. Vitamin C promotes widespread yet specific DNA demethylation of the epigenome in human embryonic stem cells[J]. Stem Cells,2010,28(10):1848-1855.
[12]Esteban MA,Wang T,Qin B,et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells[J]. Cell Stem Cell,2010,6(1):71-79.
[13]Maus MV,Thomas AK,Leonard DG,et al. Ex vivo expansion of polyclonal and antigen-specific cytotoxic T lymphocytes by artificial APCs expressing ligands for the Tcell receptor,CD28 and 4-1BB[J]. Nat Biotechnol,2002,20(2):143-148.
[14]李学礼,李永渝,杨翠香. 二硫代氨基吡咯烷和维生素C 对急性胰腺炎模型大鼠胰肝细胞粘附分子及超氧化物歧化酶表达的影响[J]. 中国病理生理杂志,2003,19(10):1331-1336.
[15]徐世侠,叶广俊,薛 彬. 维生素A 及维生素C 对放线菌素D 诱发的肺巨噬细胞凋亡的影响[J]. 中国病理生理杂志,1999,15(10):953-954.
