美托洛尔对心力衰竭大鼠心肌细胞磷酸化缝隙连接蛋白43 表达及心肌细胞凋亡的影响*
2013-12-23李自成邝素华黄伟青黄敏坚林俊敏梁子敬
梁 庆, 李自成, 邝素华, 黄伟青, 黄敏坚, 林俊敏, 梁子敬
(1暨南大学第一临床医学院心血管内科,广东 广州510632;广州医科大学附属第一医院2急诊科,3心脏外科,广东 广州510120)
连接蛋白43(connexin 43,Cx43)是心脏中表达最丰富的连接蛋白,其构成的间隙连接(gap junction,GJ)通道在心肌细胞中的电耦联及化学信息交流中起着非常重要的作用。近期,Salameh 等[1]的研究发现美托洛尔(metoprolol,Meto)不同异构体均能阻止GJ通道Cx43 的降解而上调离体乳鼠心肌细胞GJ 通道Cx43 表达。Cx43 的磷酸化与去磷酸化对GJ 通道的功能有着非常重要的调控作用。β 肾上腺素受体阻滞剂可对抗心力衰竭(heart failure,HF)时神经内分泌的长期持续激活诱导的心肌细胞凋亡,而其内在机制是否与Cx43 表达及磷酸化调控相关,目前仍不清楚。本文观察Meto 对心力衰竭大鼠在体心肌细胞磷酸化Cx43(phosphorylated connexin 43,p-Cx43)表达水平及心肌细胞凋亡影响,并探讨其可能机制。
材 料 和 方 法
1 心力衰竭模型的复制及实验分组
SPF 级雄性SD 大鼠100 只,体重180 ~200 g,由中山大学实验动物中心提供(合格证号为0096235)。动物随机化分为5 组:(1)假手术组(sham,n=20);(2)心力衰竭模型组(HF,n =20);(3)美托洛尔治疗低剂量组(MetoA,n =20);(4)美托洛尔治疗中剂量组(MetoB,n =20);(5)美托洛尔治疗高剂量组(MetoC,n =20)。施行腹主动脉次全结扎术,将7 号注射针头(去尖)与大鼠左肾动脉上方1.0 ~1.5 cm 处的腹主动脉紧贴并共同结扎后抽出针头,造成腹主动脉狭窄70% ~80%,从而建立压力负荷型心力衰竭动物模型,sham 组不结扎腹主动脉,其余操作同模型组。大鼠术后喂养8 周,美托洛尔治疗组大鼠术后第4 周开始每日分2 次灌胃给药(酒石酸美托洛尔片,阿斯利康制药有限公司)(日剂量:MetoA 组1.25 mg·kg-1·d-1;MetoB 组5 mg·kg-1·d-1;MetoC 组20 mg·kg-1·d-1),sham 组和HF 组正常喂养。术后4 周及8 周行心脏超声心动图测定心功能,术后8 周测定心功能后取大鼠心脏进行下游实验。大鼠的处置符合暨南大学医学院实验动物伦理委员会的相关管理规定。
2 常规心电图和心脏超声心动图动态监测
术后第4 周及第8 周用6 ~12 MHZ 高频线阵探头取各组大鼠胸骨旁左室长轴切面及腹主动脉长轴切面连续检测左心室舒张末期内径(left ventricular internal diastolic diameter,LVIDd),舒张末期室间隔厚度(interventricular septal diastolic thickness,IVSd)和左室后壁厚度(left ventricular posterior wall diastolic thickness,LVPWd)及左室射血分数(ejection fraction,EF)。所有超声心动图检查均由一位具有丰富超声心动图检查经验的心脏专科医生完成。造模术前与术后4 周、8 周常规心电监测。
3 大鼠心脏取材
大鼠术后8 周检测心功能后,立即开胸取出心脏,置冰上去除心耳心房,平行于房室沟于左室长轴中点处将心室分为心尖部和心底部,心尖部用于Western blotting 检测;心底部用4%多聚甲醛固定12 h 后,石蜡包埋,切片后HE 和Masson 染色观察心脏结构改变及胶原纤维增生情况,末端脱氧核糖核苷酸转移酶介导的dUTP 缺口末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)检测心肌细胞凋亡。
4 Western blotting 半定量检测p-Cx43 表达
冰上提取大鼠心尖部左心室总蛋白后测定总蛋白质浓度,每孔加入50 μg 总蛋白质,进行SDS -PAGE(10%分离胶)电泳,电转膜,5%脱脂奶粉室温下封闭2 h。1∶400 p-Cx43 兔抗鼠多克隆抗体(购自Cell Signaling Technology)4 ℃孵育过夜,洗膜后加入辣根过氧化酶标记羊抗兔Ⅱ抗(1∶2 000)室温下孵育2 h,以GAPDH(1∶2 000)抗体作内参照。洗膜后ECL 试剂显影。
5 TUNEL 法检测心肌细胞凋亡
采用TUNEL 检测试剂盒(购自南京凯基生物科技有限公司)检测各组大鼠心肌组织中的凋亡细胞。光镜下正常细胞核显蓝色,凋亡细胞核呈深浅不一棕黄色(TUNEL 阳性)。每只大鼠观察4 张切片,每张切片上随机选取计数5 个视野(×400),计算每个视野内凋亡阳性细胞核数占总细胞总数百分比,取其平均值为心肌细胞凋亡指数(apoptotic index,AI)。
6 统计学处理
使用SPSS 16.0 统计软件分析,计量资料以均数±标准差(mean ±SD)表示,组间比较采用单因素方差分析,方差齐采用LSD 法,方差不齐采用Games-Howell 法;变量间的相关性作Pearson 直线相关分析。以P <0.05 为差异有统计学意义。
结 果
1 美托洛尔对心功能的影响
各实验组术中无大鼠死亡,腹主动脉次全结扎术后喂养8 周,各组大鼠存活只数如下:(1)sham 组18 只;(2)HF 组14 只;(3)MetoA 组16 只;(4)MetoB 组18 只;(5)MetoC 组15 只,见表1。
从表1 中可见,在第8 周(给药4 周后),与sham组相比,HF 组及Meto 治疗组的心率均有减慢(P <0.01);而与HF 组相比,MetoA 组的心率无明显减慢(P >0.05),MetoB 组(P <0.05)及MetoC 组(P <0.01)显著减缓心衰大鼠心率,Meto 治疗组间比较有显著差异。HF 组和Meto 治疗组的LVIDd 较sham组明显增大,Meto 治疗组的LVIDd 较HF 组显著缩小。Meto 治疗组间进一步比较显示,中剂量MetoB组LVIDd 较小剂量MetoA 组进一步缩小(P <0.05),而大剂量MetoC 组较中剂量组LVIDd 差异无统计学意义(P >0.05)。HF 组及Meto 治疗组的IVSd 和LVPWd 较sham 组明显增厚,Meto 治疗组的IVSd 和LVPWd 均较HF 组显著减小,Meto 治疗组间比较显示,中剂量组IVSd 和LVPWd 较小剂量组进一步减小(P <0.05),而大剂量组IVSd 和LVPWd 较中剂量组差异无统计学意义(P >0.05)。与sham 组相比,HF 组EF 为(44.71 ±9.68)%,心功能明显恶化(P <0.01);MetoA 组及MetoB 组的心功能较HF组显著改善(P <0.01),而MetoC 组心功能较HF 组无明显改善(P >0.05)。从上述结果可见本实验压力负荷型心力衰竭大鼠建模成功,心肌出现不同程度的肥厚、重塑等结构改变,且心功能恶化明显;与HF 组比较,经中、小剂量Meto 治疗后大鼠心脏LVIDd 缩小,IVSd 和LVPWd 增厚减轻,心功能改善明显,而大剂量Meto 治疗显著减缓心衰大鼠心率,心功能较HF 组无明显改善,且大剂量组较中剂量组LVIDd 缩小及IVSd 和LVPWd 增厚程度均无显著差异,显示美托洛尔治疗对心衰大鼠血流动力学改变有“天花板效应”。
表1 各组大鼠心脏结构及血流动力学指标的比较Table 1. Rat cardiac structure and hemodynamic indicators in various groups (Mean±SD)
2 心肌病理结果
HE 染色(图1)可见,sham 组心肌细胞形态规则,心肌纤维排列整齐,心肌间质无增生。而HF 组心肌细胞炎性细胞浸润,心肌细胞肥大明显,心肌间质增生明显,部分心肌细胞出现空泡样变性、细胞溶解及出现纤维化并呈现波浪状,排列紊乱,局部断裂,有出血和炎症表现,进一步Masson 染色(图2)显示心肌胶原纤维(标示为蓝色部分)增生明显。而HE 染色(图1)可见各Meto 治疗组缺血区心肌细胞肥大、排列紊乱、空泡样变性、细胞溶解及炎症细胞浸润均较HF 组改善明显,且随剂量增加心肌细胞病理改变有进一步改善。Masson 染色(图2)亦显示随Meto 治疗剂量的增加心肌胶原纤维增生得到进一步抑制。上述病理表现提示美托洛尔治疗对于心肌重塑改变的逆转有“剂量依赖效应”,在治疗剂量范围内剂量的增加可有效逆转心力衰竭时心肌肥大、坏死、纤维化,以及心肌胞外间质、胶原纤维网的增生。

Figure 1. Myocardial HE staining in various groups (×200).A:sham group;B:HF group;C:MetoA group;D:MetoB group;E:MetoC group.图1 各组大鼠心肌HE 染色
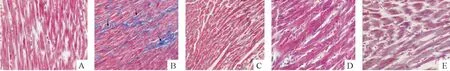
Figure 2. Myocardial Masson staining in various groups (×200).A:sham group;B:HF group;C:MetoA group;D:MetoB group;E:MetoC group.图2 各组大鼠心肌Masson 染色
3 Western blotting 结果
图3 显示,在分子量43 kD 处可见p-Cx43 清晰的表达条带。HF 组p-Cx43 条带较sham 组明显增粗,予Meto 治疗后p-Cx43 条带随治疗剂量的增加而变细变淡。进一步半定量分析显示,HF 组中p-Cx43表达量较sham 组显著升高(P <0.01),而Meto 各治疗组较HF 组p-Cx43 表达量均显著降低(MetoA vs HF,P <0.05;MetoB vs HF,P <0.01;MetoC vs HF,P <0.01),Meto 各治疗组间两两比较亦有显著差异(P <0.01)。
4 大鼠心肌细胞凋亡的变化
大鼠心肌细胞凋亡的变化如下:sham 组心肌细胞凋亡指数为(4.62 ±1.60)%;HF 组心肌细胞凋亡指数为(51. 17 ±6. 94)%,较sham 组明显升高(P <0.01);MetoA 组凋亡指数为(40.60 ±4.15)%,MetoB 组凋亡指数为(30.66 ±4.00)%,MetoC 组凋亡指数为(22. 24 ±5. 69)%,均较HF 组显著下降(P <0.01),Meto 各治疗组间两两比较亦有显著差异(P <0.01),见图4。
5 大鼠心肌细胞p-Cx43 表达程度与凋亡水平的相关性分析

Figure 3. Expression of phosphorylated connexin 43 (p-Cx43)in rat left ventricle in various groups detected by Western blotting. Mean ± SD. ** P <0.01 vs sham group;#P <0.05,##P <0.01 vs HF group.图3 各组大鼠左心室磷酸化connexin 43 蛋白的表达水平
Pearson 直线相关分析显示,吸光度比值(p-Cx43/GAPDH)与心肌细胞凋亡指数呈明显的正相关(r=0.905,P <0.01),见图5。
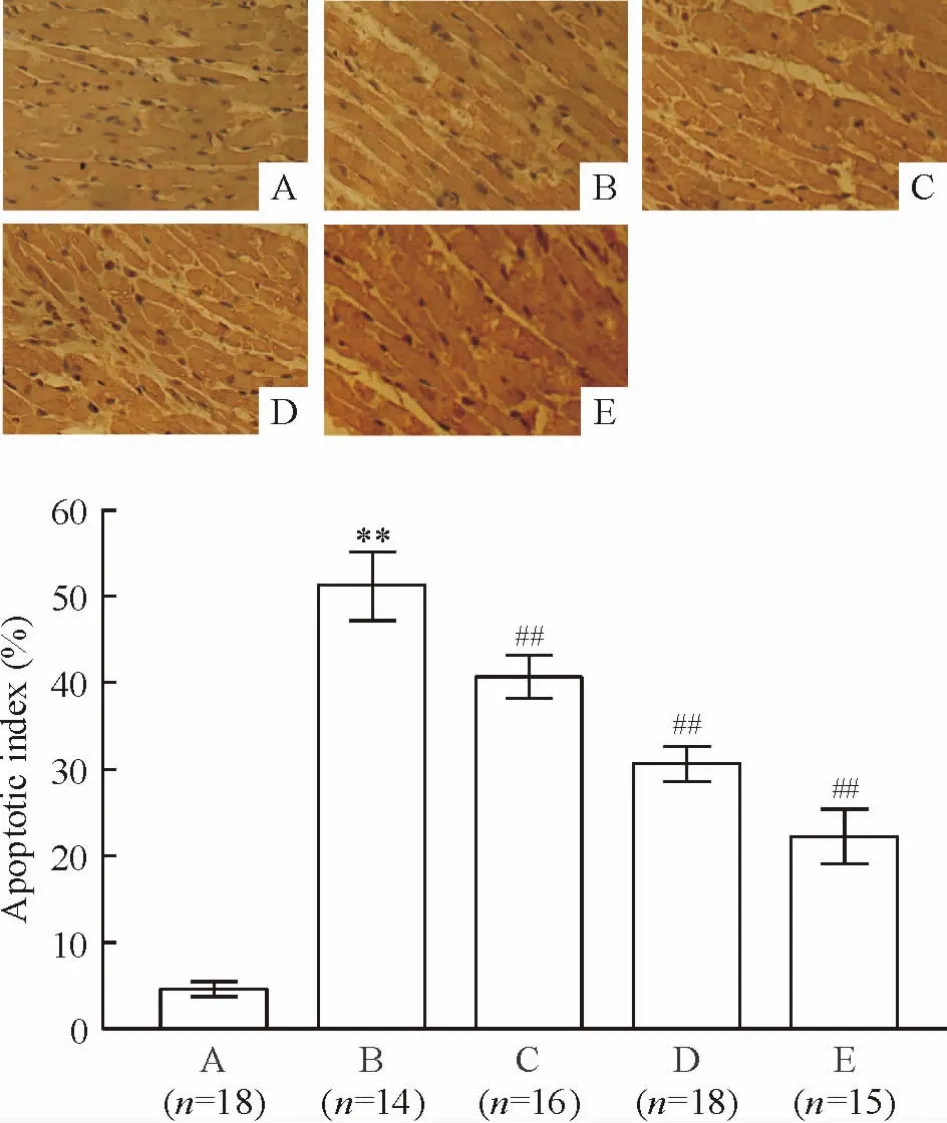
Figure 4. Myocardial tissue TUNEL staining (×400)and apoptotic index in various groups. A:sham group;B:HF group;C:MetoA group;D:MetoB group;E:MetoC group. Mean ±SD. **P <0.01 vs sham group;##P <0.01 vs HF group.图4 各组心肌组织TUNEL 染色和凋亡指数
Figure 5. The expression of p-Cx43 and myocardial apoptotic index were positively correlated.图5 p-Cx43 的表达与心肌细胞凋亡指数的相关性分析
讨 论
HF 患者中神经体液的一个主要特点是神经内分泌的长期持续激活,特别是交感神经兴奋及血浆中去甲肾上腺素(norepinephrine,NE)水平的升高及尿中儿茶酚胺排泄的增加,而NE 诱导心肌细胞凋亡是HF 发生的一个重要发病机制[2-3]。因此通过抑制NE 的心脏毒性从而抑制心肌细胞凋亡给HF 的治疗带来新希望,而已知β 肾上腺素受体阻滞剂可对抗HF 动物模型或患者中神经内分泌的长期持续激活诱导心肌细胞凋亡这一效应[4-5]。且大量动物研究发现无论在缺血缺氧前或缺血缺氧中施加GJ通道的阻断剂,均可显著限制心肌梗死的范围和面积[6]。
GJ 通道的基本结构单位是连接小体(connexon),由6 个Cx 围成,小体中央形成直径1.5 nm 的亲水管道(hydrophilic channel),即为Cx 半通道。相邻细胞间的Cx 半通道对接而组成完整GJ 通道。Cx构成的心脏GJ 通道是心肌细胞间通讯的结构基础,分子量小于1 kD、直径小于1.5 nm 的多种物质如代谢物、离子、第二信使、水分子等都可通过,并可在电兴奋组织中传导电冲动。Cx43 是心脏中表达最丰富的Cx,其构成的GJ 通道在心肌细胞中的电偶联及化学信息交流(GJ 通道介导的细胞间通讯)中起着非常重要的作用[7]。Cx43 的磷酸化与去磷酸化对GJ通道的功能有着非常重要的影响作用[8]。我们前期的研究表明Cx43 的羧基末端241 ~382 为主要的磷酸化区,也是多种激素的识别位点,大多数蛋白质相互作用发生于此,羧基末端丝/苏氨酸残基的磷酸化程度决定着GJ 通道的通透性[9]。在心肌细胞,Cx43的磷酸化使GJ 通道关闭,去磷酸化使该通道开放。在心肌细胞,去磷酸化不仅可使GJ 通道开放,而且是通道解聚的关键点,Cx43 一旦去磷酸化,通道即开始解聚为Cx 亚单位,Cx 亚单位可进一步降解或转入胞内储存。
近年Salameh 等[10-11]探讨了美托洛尔对心肌细胞Cx43 表达的影响,对新生鼠心肌细胞采用美托洛尔单独或与异丙肾上腺素共同处理,结果显示:美托洛尔不同异构体均能上调GJ 通道Cx43 的表达,认为:美托洛尔可阻止GJ 通道Cx43 的降解而发挥作用,且可能通过有丝分裂原激活蛋白激酶(mitogenactivated protein kinase,MAPK)信号转导通路来实现这一调控作用。新近研究发现在Cx43 半通道的开放及胞内细胞外信号调节激酶(extracellular signalregulated kinases,ERKs)的激活抑制了骨细胞及成骨细胞的凋亡,这与维持细胞间生存信号(intracellular survival signaling)的交流和细胞稳态有关[12-14]。
本实验研究中压力负荷型HF 大鼠中给予美托洛尔治疗后,虽在血流动力学的改善方面有“天花板效应”,而在逆转心肌肥厚、重塑病理改变方面提示美托洛尔治疗有“剂量依赖效应”,在治疗剂量范围内剂量的增加可有效逆转HF 时心肌肥大、坏死和纤维化,以及心肌胞外间质、胶原纤维网的增生。进一步的研究发现HF 对照组大鼠左心室p-Cx43 表达明显增加,予美托洛尔治疗后p-Cx43 表达量随治疗剂量的增加而显著减少,且心肌细胞凋亡水平与p-Cx43 表达水平呈正相关,随着美托洛尔治疗剂量的增加p-Cx43 表达减少,心肌细胞凋亡指数亦减小。结合上述背景资料和本研究结果,我们推测美托洛尔对NE 诱导心肌细胞凋亡的抑制可能与维持心脏Cx43 的去磷酸化状态而使得Cx43 降解减少和保持GJ 通道开放,从而保证细胞间生存信号的交流有关。
总之,美托洛尔对抗HF 时神经内分泌长期持续激活诱导的心肌细胞凋亡的内在机制与Cx43 表达调控特别是磷酸化状态的调控密切相关。对其参与细胞凋亡调控机制的研究将为临床应用肾上腺素受体阻滞剂治疗HF 提供实验依据。
[1] Salameh A,Blanke K,Dhein S,et al.Cardiac gap junction channels are upregulated by metoprolol:an unexpected effect of beta-blockers[J]. Pharmacology,2010,85(4):203-210.
[2] Singh K,Xiao L,Remondino A,et al.Adrenergic regulation of cardiac myocyte apoptosis[J]. J Cell Physiol,2001,189(3):257-265.
[3] 付德明,吕吉元,康玉明,等.洛沙坦抑制β-肾上腺素能刺激诱导的大鼠心肌细胞凋亡的机制研究[J].中国病理生理杂志,2009,25(8):1463-1468.
[4] Rehsia NS,Dhalla NS. Mechanisms of the beneficial effects of beta-adrenoceptor antagonists in congestive heart failure[J].Exp Clin Cardiol,2010,15(4):e86-e95.
[5] 成 蓓,张秀娥,Wiedemann J,等.β-肾上腺素能刺激促进离体小鼠心脏缺氧/复氧诱导的细胞凋亡[J].中国病理生理杂志,2006,22(2):270-273.
[6] Miura T,Miki T,Yano T.Role of the gap junction in ischemic preconditioning in the heart[J]. Am J Physiol Heart Circ Physiol,2010,298(4):H1115-H1125.
[7] 乔英艳,王晋青,张 玖.脂联素对大鼠缺血再灌注心肌缝隙连接蛋白43 表达的影响[J].中国病理生理杂志,2012,28(3):464-469.
[8] Solan JL,Lampe PD.Connexin 43 phosphorylation:structural changes and biological effects[J].Biochem J,2009,419(2):261-272.
[9] 梁 庆,林吉进,李玉光.心脏连接蛋白43 羧基末端相互作用蛋白的酵母双杂交筛选[J].心脏杂志,2007,19(3):280-285.
[10]Salameh A,Krautblatter S,Karl S,et al.The signal transduction cascade regulating the expression of the gap junction protein connexin43 by β-adrenoceptors[J].Br J Pharmacol,2009,158(1):198-208.
[11] Salameh A,Dhein S. Adrenergic control of cardiac gap junction function and expression[J]. Naunyn Schmiedebergs Arch Pharmacol,2011,383(4):331-346.
[12]Civitelli R. Connexin43 modulation of osteoblast/osteocyte apoptosis:a potential therapeutic target?[J]. J Bone Miner Res,2008,23(11):1709-1711.
[13]Lezcano V,Bellido T,Plotkin LI,et al.Role of connexin 43 in the mechanism of action of alendronate:dissociation of anti-apoptotic and proliferative signaling pathways[J].Arch Biochem Biophys,2012,518(2):95-102.
[14]Bivi N,Condon KW,Allen MR,et al.Cell autonomous requirement of connexin 43 for osteocyte survival:consequences for endocortical resorption and periosteal bone formation[J].J Bone Miner Res,2012,27(2):374-389.
