咪达唑仑通过下调p300 抑制人咽鳞癌FaDu 细胞增殖
2013-12-23窦云凌许静红舒海华
窦云凌, 陈 祯, 许静红, 江 楠, 舒海华
(中山大学附属第一医院麻醉科,广东 广州510080)
头颈部肿瘤发病率在恶性肿瘤中占第6 位,90%以上为鳞状细胞癌[1],它的生长速度和侵袭性都很高,但发病机制并不清楚。已报道的可能机制有:表皮生长因子受体(epidermal growth factor receptor,EGFR)/信号转导子及转录激活子(signal transducers and activators of transcription,STATs)信号通路过度激活而诱导癌基因的表达[2];抑癌基因如p27[3]、p16[4]及脆性组氨酸三联体(fragile histidine triad protein,FHIT)[5]被抑制而导致咽鳞癌发生等。咽鳞癌的治疗仍以常规的手术治疗和放化疗为主,效果并不理想,5 年生存率不高[6-7]。临床上正在尝试采用新的手段对咽鳞癌进行治疗,已报道的有分子靶向治疗、基因治疗、免疫治疗、微创治疗和干扰素治疗等。这些新的手段已为头颈部肿瘤治疗带来了新希望,然而,绝大多数的新治疗方法尚处在实验室或临床试验阶段,要成为常规治疗手段尚需进一步的验证和评价。因而,寻找咽鳞癌治疗的新方法及策略仍是目前研究的热点。
咪达唑仑(midazolam)是临床上广泛应用于手术麻醉的苯二氮卓类药物[8-9],其作用的主要靶器官是中枢神经系统,具备极好的穿透血脑屏障的能力。临床作用主要包括:抗焦虑,作为术前用药广泛使用;镇静,用于术前、术中和术后ICU 镇静;抗惊厥,用于局部麻醉药中毒和癫痫发作的一线用药;肌肉松弛作用,包括经脊髓介导的骨骼肌松弛作用和作用于平滑肌而产生的血管扩张作用。除了以上提到的药物作用,在该药使用的过程中还会产生顺行性遗忘作用。此外,研究表明咪达唑仑还可以通过抑制炎症反应通路抑制免疫反应产生中枢保护作用。在前期的研究中我们发现咪达唑仑能抑制咽鳞癌FaDu 细胞增殖,但具体机制仍未阐明[10]。本研究旨在探讨咪达唑仑抑制人咽鳞癌FaDu 细胞增殖的机制,为咪达唑仑用于咽鳞癌治疗提供理论依据和思路。
材 料 和 方 法
1 材料
人咽鳞癌细胞FaDu 从中国细胞库购买;咪达唑仑购于江苏恩华医药公司;DMEM 培养基、胎牛血清、青链霉素购自Invitrogen;MTT 及DMSO 细胞购自Sigma-Aldrich;6 孔培养板、24 孔培养板及96 孔培养板购自Corning;BrdU 掺入细胞增殖试剂盒购自Promega;视网膜母细胞瘤(retinoblastoma,Rb)抗体、p-Rb 抗体、p21 抗体、p27 抗体及微管蛋白(tubulin)抗体购自Cell Signaling Technology;p300 抗体购于Abcam;p300 PCR 引物由上海Invitrogen 合成;siRNA片段由上海吉玛生物有限公司合成;蛋白定量及ECL 试剂盒购于广州永诺生物科技有限公司。
2 方法
2.1 FaDu 细胞的培养与传代 FaDu 细胞在含10%FBS 、1 ×105U/L 青霉素及100 mg/L 链霉素的DMEM 完全培养基于5 % CO2、37 ℃恒温密闭式孵箱(相对湿度95%)内培养传代,倒置显微镜观察生长情况。大约2 ~4 d 传代1 次,取处于对数生长期的细胞用于实验。
2.2 细胞活性检测( MTT 法) 对数生长期FaDu细胞(3 ×107/L)细胞悬液接种在96 孔板,咪达唑仑处理后每孔加入MTT 10 μL(5 g/L),继续孵育4 h,吸去上清,加入DMSO 100 μL/well 终止反应,酶标仪于波长570 nm 检测吸光度(A)。
2.3 RT-PCR 检测 采用Trizol 法提取细胞mRNA,采用试剂盒将mRNA 逆转录为cDNA。p300 上游引物5'-AATCCTTTCCATACCGAACC-3',下游引物5'-GAGGGCAGTCAGAGCCATAC-3';按如下条件进行扩增:94 ℃5 min,94 ℃30 s,58 ℃30 s,72 ℃45 s,24个循环;72 ℃10 min,扩增产物为108 bp;β-actin 上游引物5'-GACTTAGTTGCGTTACACCCTTTC-3',下游引物5'-TGCTGTCACCTTCACCGTTC-3',按如下条件进行扩增:94 ℃5 min,94 ℃30 s,60 ℃30 s,72 ℃45 s,18 个循环;72 ℃10 min,扩增产物为160 bp。产物用2%琼脂糖电泳分析。
2.4 沉默p300 根据公认的设计原则,确定p300干扰序列。si-p300-1:5’-GCAATGGACAAGGGATAAT-3’;si-p300-2:5’-GCAGCTCAACCATCCACTA-3’。合成以上片段,采用Lipofectamine 转染细胞,片段量为100 pmol/well,转染时间为72 h。
2.5 Western blotting 将FaDu 细胞种植在6 孔培养板,咪达唑仑处理后200 μL 裂解液裂解细胞,收集细胞裂解液至1.5 mL EP 管,采用Bradford 方法进行蛋白定量,煮沸样本5 min,冰上冷却后10 000 ×g离心30 s,取上清进行SDS-PAGE,然后100 V 转膜1 h,0.5%(W/V)脱脂牛奶室温封闭PVDF 膜1 h,4 ℃Ⅰ抗孵育过夜,0.1%(V/V)TBST 洗膜2 次后,室温孵育Ⅱ抗1 h ,洗膜3 次后即用ECL 显色曝光。
3 统计学处理
数据以均数±标准差(mean±SD)表示,组间比较采用方差分析,应用SPSS 软件包进行统计处理,以P <0.05 为差异有统计学意义
结 果
1 咪达唑仑抑制FaDu 细胞的增殖
相差显微镜观察发现:对照组FaDu 细胞单层贴壁生长,排列密集,呈岛屿状分布,细胞呈椭圆形或多边形;而咪达唑仑处理组,数量明显减少,胞体较对照组细胞缩小,呈长梭形,见图1A,表明咪达唑仑可使人咽鳞癌FaDu 细胞发生明显的形态学变化。不同浓度(0、6.25、12.5、25、50、100 μmol/L)咪达唑仑处理FaDu 细胞24 h 或48 h 后进行MTT 检测,结果显示,50 μmol/L 咪达唑仑处理24 h 开始抑制FaDu 细胞的增殖;而6.25 μmol/L 咪达唑仑处理48 h 即可观察到对FaDu 细胞的抑制作用,见图1B,表明咪达唑仑呈时间和剂量依赖性地降低FaDu 细胞的活性。BrdU 摻入检测结果显示,咪达唑仑呈浓度依赖性地抑制FaDu 细胞增殖能力,见图1C。

Figure 1. Midazolam inhibited the viability and proliferation of FaDu cells. A:phase-contrast images of cells treated with 0 (control)and 100 μmol/L midazolam for 48 h(×200);B:dose-and time-dependent effect of midazolam on cell viability detected by MTT assay;C:effect of midazolam on cell proliferation detected by BrdU incorporation assay. Mean ± SD. n = 3. * P <0.05,**P <0.01 vs 0 μmol/L.图1 咪达唑仑抑制FaDu 细胞增殖
2 咪达唑仑抑制p300 的表达
不同浓度(0、25、50、100 μmol/L)咪达唑仑处理FaDu 细胞48 h 后,与对照组比较,咪达唑仑呈浓度依赖性地抑制p300 mRNA 及蛋白的表达,见图2。
3 沉默p300 抑制咽鳞癌FaDu 细胞增殖
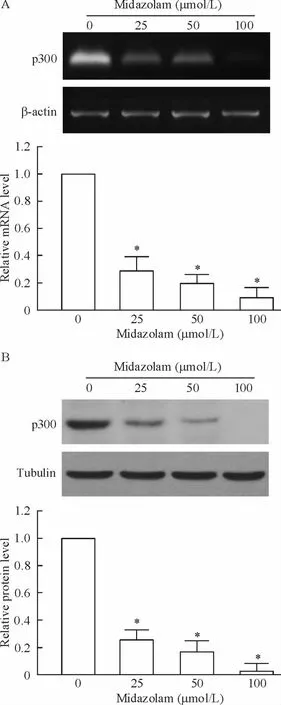
Figure 2. Dose-dependent effect of midazolam on p300 mRNA(A)and protein (B)expression in FaDu cells detected by RT-PCR and Western blotting,respectively.FaDu cells were incubated with 0,25,50 and 100 μmol/L midazolam for 48 h. Mean ± SD. n =3. * P<0.05 vs control (0 μmol/L).图2 咪达唑仑抑制p300 的表达
与对照组比较,转染p300干扰片段后,p300 mRNA 及蛋白表达明显下调,表明沉默p300 成功,见图3A、B;MTT 检测结果显示,与对照组比较,沉默p300 (si-p300-1 及si-p300-2 处理)后FaDu 细胞活性明显减弱,见图3C;BrdU 掺入实验结果显示,沉默p300 抑制FaDu 细胞增殖,见图3D。

Figure 3. Knockdown of p300 inhibited the viability and proliferation of FaDu cells. A:p300 mRNA expression detected by RT-PCR;B:p300 protein expression detected by Western blotting;C:cell viability tested by MTT assay;D:cell proliferation measured by BrdU incorporation assay. Mean±SD. n=3. * P <0.05 vs scrambled.图3 沉默p300 可抑制FaDu 细胞增殖
4 p300 沉默通过细胞周期素依赖性激酶抑制剂(cyclin-dependent kinase inhibitor,CDKI)/Rb 通路抑制FaDu 细胞增殖
FaDu 细胞转染p300 干扰片段(si-p300-1 及sip300-2)及对照组片段(scrambed),72 h 后Western blotting 检测发现,沉默p300 后CDK 抑制蛋白p21及p27 水平上调,而Rb 磷酸化水平则明显下调,见图4。以上结果表明,p300 沉默可能通过CDKI/Rb通路抑制FaDu 细胞增殖。
讨 论
p300 是转录激活组蛋白乙酰转移酶家族的一员,p300 在转录过程中发挥多种作用,催化组蛋白乙酰化组蛋白乙酰转移酶活性[11-12]。p300 参与调节多种细胞过程,如细胞增殖、分化、凋亡、细胞周期调控和DNA 损伤反应[13]。有报道p300 在某些人类恶性肿瘤起到了抑癌作用,包括乳腺癌、肠癌和胃癌[14-15]。然而,最近的研究表明,p300 可促进多种肿瘤的发生[16-18]。p300 可作为辅助因子参与调控p53和低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)水平,从而促进浸润性乳腺癌发生[19];p300 的表达促进前列腺癌的生长,可作为预测前列腺癌症的标记物[20];p300 也是头颈部鳞癌的关键因子,沉默p300 可以抑制肿瘤生长[21]。在本研究中我们发现咪达唑仑下调p300 而抑制人咽鳞癌FaDu 细胞增殖,且其机制可能是通过抑制CDKI/Rb 通路,这与目前p300 在其它肿瘤中的功能报道是一致的,这可为咽鳞癌的治疗提供新的参考。
肿瘤的手术切除是治疗癌症最有效、最直接的治疗手段。然而,围手术期是肿瘤转移最为敏感的时期,一方面是由于手术过程中癌细胞的游离以及手术导致的免疫功能抑制所致,另一方面围手术期的麻醉处理会影响经受手术治疗病人的预后。一些麻醉药物包括氯胺酮、戊硫代巴比妥和氟烷,能抑制自然杀伤细胞的活性并且促进肿瘤的转移;阿片类药物可抑制人免疫系统的功能[22];吗啡也被证实具有在体内外刺激人微血管内皮细胞的增殖和血管生成的作用。我们的研究发现咪达唑仑能够抑制人咽鳞癌细胞FaDu 细胞的生长和增殖,因此手术中应用具有肿瘤抑制作用的麻醉药(例如咪达唑仑)将为肿瘤病人提供更多的保护。
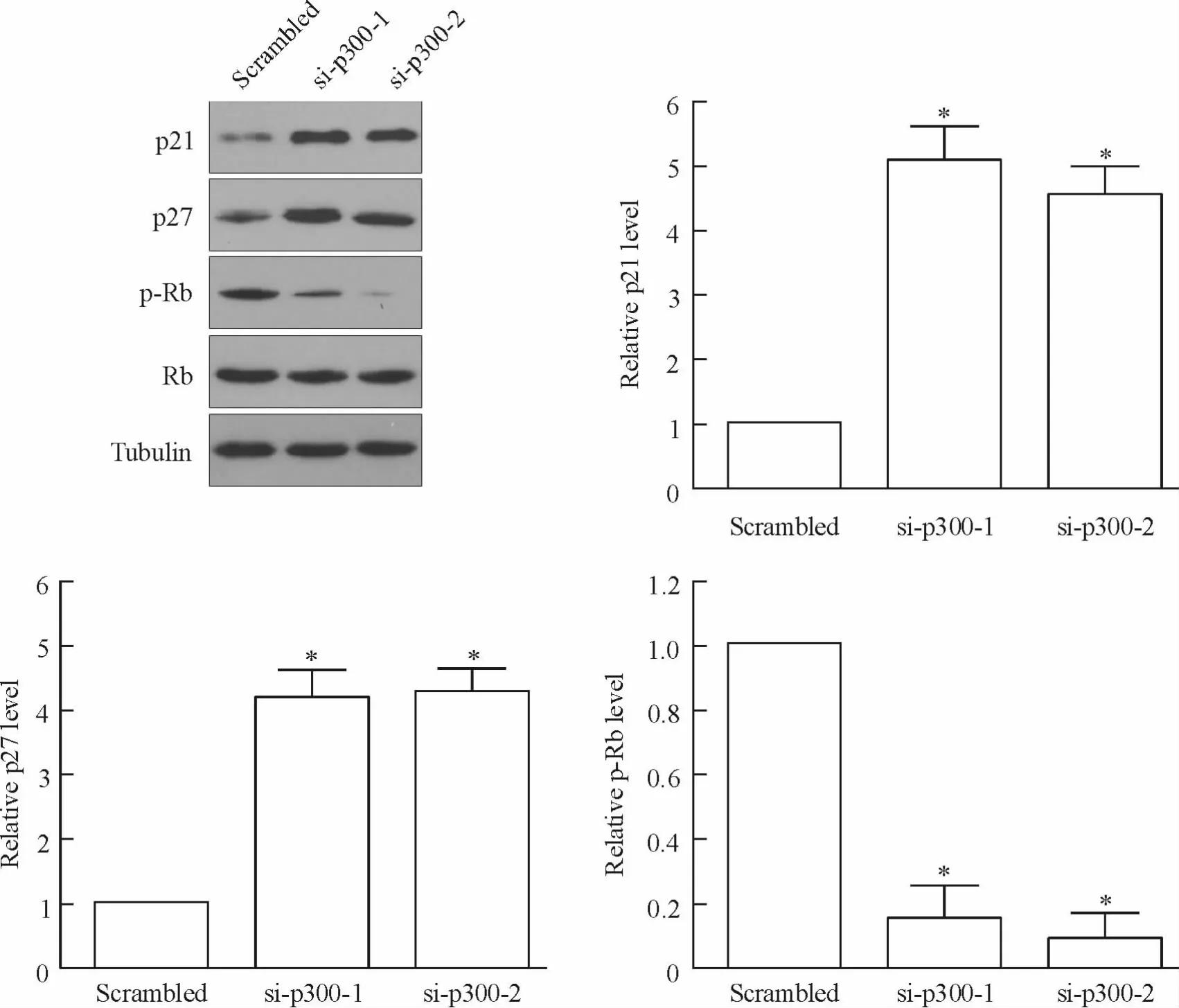
Figure 4. Knockdown of p300 inhibited the proliferation of FaDu cells via CDKI/Rb pathway. The protein expression of p21,p27,Rb and p-Rb was detected by Western blotting 72 h after siRNA transfection. Tubulin was used as a loading control. Mean±SD. n=3. * P <0.05 vsscrambled.图4 p300 沉默通过CDKI/Rb 通路抑制FaDu 细胞增殖
我们前期的实验结果表明咪达唑仑抑制增殖不依赖于苯二氮卓受体激活[10],那么咪达唑仑下调p300 的具体机制是怎样的?已知苯二氮卓类麻醉药(包括咪达唑仑)可靶向一些蛋白[如BET(bromodomain and extra-terminal)蛋白家族中的bromodomain]而抑制蛋白相互作用[23],p300 蛋白中也含有bromodomain,苯二氮卓类化合物可抑制蛋白p53与MDM2(murine double minute 2)相互作用已有证明[24],而p300 可与CITED2(CBP/p300-interacting transactivator with ED-rich tail 2)蛋白相互作用而影响后者在一些细胞周期控制相关基因表达中起作用[25]。咪达唑仑是否通过影响p300 与CITED2 结合而调控FaDu 细胞增殖需进一步证实。
此外,我们发现咪达唑仑是通过下调p300 表达而抑制FaDu 细胞增殖,提示p300 在咽鳞癌的发生中起重要作用,那么在咽鳞癌中p300 是否表达上调有待进一步实验。总之,通过本研究,我们为咽鳞癌的治疗提供了新的线索和思路,同时也为将咪达唑仑开发或改造为高效的抗肿瘤药物提供理论依据。
[1] Hunter KD,Parkinson EK,Harrison PR. Profiling early head and neck cancer[J].Nat Rev Cancer,2005,5(2):127-135.
[2] Leong PL,Xi S,Drenning SD,et al. Differential function of STAT5 isoforms in head and neck cancer growth control[J]. Oncogene,2002,21(18):2846-2853.
[3] 赵 强,张志伟,刘重元,等. LMP1 调节鼻咽癌上皮与鼻咽癌组织中p27 与RPLPO 蛋白的表达[J]. 中国病理生理杂志,2012,28(10):1830-1834.
[4] Yuen PW,Man M,Lam KY,et al. Clinicopathological significance of p16 gene expression in the surgical treatment of head and neck squamous cell carcinomas[J]. J Clin Pathol,2002,55(1):58-60.
[5] Pavelic K,Krizanac S,Cacev T,et al. Aberration of FHIT gene is associated with increased tumor proliferation and decreased apoptosis-clinical evidence in lung and head and neck carcinomas[J]. Mol Med,2001,7(7):442-453.
[6] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[7] Parkin DM,Pisani P,Ferlay J. Global cancer statistics[J]. CA Cancer J Clin,1999,49(1):33-64.
[8] Nordt SP,Clark RF. Midazolam:a review of therapeutic uses and toxicity[J]. J Emerg Med,1997,15(3):357-365.
[9] 钟志越,何岱昆,张 琳,等.右旋美托咪啶镇静治疗对严重创伤后炎症因子的影响[J]. 中国病理生理杂志,2012,28(11):1979-1981,1998.
[10]Dou Y,Li Y,Chen J,et al. Inhibition of cancer cell proliferation by midazolam by targeting transient receptor potenal melastatin 7[J]. Oncol Lett,2013,5(3):1010-1016.
[11]Kundu TK,Palhan VB,Wang Z,et al. Activator-dependent transcription from chromatin in vitro involving targeted histone acetylation by p300[J]. Mol Cell,2000,6(3):551-561.
[12]Vo N,Goodman RH. CREB-binding protein and p300 in transcriptional regulation[J]. J Biol Chem,2001,276(17):13505-13508.
[13]Goodman RH,Smolik S. CBP/p300 in cell growth,transformation,and development[J]. Genes Dev,2000,14(13):1553-1577.
[14] Muraoka M,Konishi M,Kikuchi-Yanoshita R,et al.p300 gene alterations in colorectal and gastric carcinomas[J]. Oncogene,1996,12(7):1565-1569.
[15]Gayther SA,Batley SJ,Linger L,et al. Mutations truncating the EP300 acetylase in human cancers[J]. Nat Genet,2000,24(3):300-303.
[16] Fan S,Ma YX,Wang C,et al. p300 modulates the BRCA1 inhibition of estrogen receptor activity[J]. Cancer Res,2002,62(1):141-151.
[17]Bandyopadhyay D,Okan NA,Bales E,et al. Down-regulation of p300/CBP histone acetyltransferase activates a senescence checkpoint in human melanocytes[J]. Cancer Res,2002,62(21):6231-6239.
[18]Li M,Luo RZ,Chen JW,et al. High expression of transcriptional coactivator p300 correlates with aggressive features and poor prognosis of hepatocellular carcinoma[J]. J Transl Med,2011,9:5.
[19]Vleugel MM,Shvarts D,van der Wall E,et al. p300 and p53 levels determine activation of HIF-1 downstream targets in invasive breast cancer[J]. Hum Pathol,2006,37(8):1085-1092.
[20] Debes JD,Sebo TJ,Lohse CM,et al. p300 in prostate cancer proliferation and progression[J]. Cancer Res,2003,63(22):7638-7640.
[21]Xie X,Piao L,Bullock BN,et al. Targeting HPV16 E6-p300 interaction reactivates p53 and inhibits the tumorigenicity of HPV-positive head and neck squamous cell carcinoma[J]. Oncogene,2013 Mar 11. [Epub ahead of print]
[22] Arain MR,Buggy DJ. Anaesthesia for cancer patients[J]. Curr Opin Anaesthesiol,2007,20(3):247-253.
[23]Filippakopoulos P,Picaud S,Fedorov O,et al. Benzodiazepines and benzotriazepines as protein interaction inhibitors targeting bromodomains of the BET family[J]. Bioorg Med Chem,2012,20(6):1878-1886.
[24] Guo Z,Zhuang C,Zhu L,et al. Structure-activity relationship and antitumor activity of thio-benzodiazepines as p53-MDM2 protein-protein interaction inhibitors[J]. Eur J Med Chem,2012,56:10-16.
[25]Cheung KF,Zhao J,Hao Y,et al. CITED2 is a novel direct effector of peroxisome proliferator-activated receptor γ in suppressing hepatocellular carcinoma cell growth[J].Cancer,2013,119(6):1217-1226.
