辛伐他汀对小鼠胰腺β 细胞功能的影响及机制研究*
2013-12-23李卫华黄峥嵘
杨 希, 李卫华, 黄峥嵘
(1 福建医科大学第一临床医学院,福建 福州350005;2厦门大学附属第一医院心内科,福建 厦门361003;3宁波市医疗中心李惠利医院心内科,浙江 宁波315041)
他汀类药物是3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-coenzyme A,HMG-CoA)还原酶抑制剂,可以降低血浆总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和甘油三酯(triglyceride,TG)水平,升高血浆高密度脂蛋白胆固醇水平(high-density lipoprotein cholesterol,HDL-C)[1]。在过去的20 年间,总计超过170 000 名参与者的多项大型临床试验表明,他汀类药物能够降低心血管事件的发生率[2]。有研究显示,辛伐他汀可通过抑制血清可溶性CD40L(sCD40L)及动脉组织CD40/CD40L 表达途径从而保护血管功能[3]。因此,他汀被广泛应用于动脉粥样硬化性心血管疾病以及卒中的一级和二级预防[4-7]。然而,与他汀类药物对心血管疾病的有益作用相反,基于多项大型随机对照临床试验的荟萃分析表明,和安慰剂组比较,使用他汀类药物能够增加新发糖尿病的发生风险[8-10]。
胰腺β 细胞功能障碍和胰岛素抵抗是2 型糖尿病的两大病理生理机制。目前有关他汀类药物增加新发糖尿病发生风险的相关机制尚未阐明,因此本研究将通过体外培养小鼠胰腺β 细胞株MIN6,从细胞整体水平及分子基因水平探讨辛伐他汀对胰腺β细胞功能的影响并探讨其可能的机制,为深入研究他汀类药物导致胰腺β 细胞功能障碍以及他汀对糖代谢的影响提供相关实验依据。
材 料 和 方 法
1 材料
小鼠胰腺β 细胞株MIN6(以下简称MIN6 细胞,由上海交通大学医学院附属瑞金医院内分泌研究所惠赠)。SW-CJ-1F 超净工作台、恒温水浴锅、3111 型CO2恒温恒湿细胞培养箱、倒置相差显微镜(Olympus)、LD5-2A 型台式低速离心机、低温高速离心机、luminometer(Modulus)、BR680 多功能酶标仪(Bio-Rad)、紫外可见分光光度计、逆转录PCR 仪、Light-Cycler® 480 Real-Time PCR 扩增仪(Roche)、垂直电泳仪、电转仪和电泳与凝胶成像分析系统;高糖DMEM 培养基和胎牛血清(fetal bovine serum,FBS)均购自HyClone;辛伐他汀购自Merck;牛血清白蛋白(bovine serum albumin,BSA)购自Roche;胰岛素放射免疫分析药盒购自北京北方生物技术研究所;ATP检测试剂盒购自碧云天生物技术研究所;BCA 蛋白质定量试剂盒及总RNA 提取试剂盒均购自天根生化科技(北京)有限公司;逆转录试剂盒及荧光定量PCR 试剂盒均购自TaKaRa。引物由Invitrogen 合成。小鼠内向整流钾离子通道6.2(inwardly rectifying potassium channel 6.2,Kir6.2)多克隆抗体、葡萄糖转运体2(glucose transporter 2,GLUT2)多克隆抗体以及山羊抗兔多克隆Ⅱ抗均购自Abcam;电压依赖性钙离子通道1.2(voltage -dependent calcium channel 1.2,CaV1.2)多克隆抗体购自Novus;GAPDH 单克隆抗体购自Cell Signaling。其它化学试剂均购自国药集团化学试剂有限公司。
2 方法
2.1 MIN6 细胞的培养及分组 MIN6 细胞在高糖DMEM 培养基、5%CO2、37 ℃恒温培养箱中培养,培养基中包含15%FBS、1 ×105U/L 青霉素、100 mg/L链霉素、2 mmol/L L-谷氨酰胺和70 μmol/L β-巯基乙醇。接种密度为6 ×108/L,每2 d 更换1 次培养基。实验分为4 组,分别用含0、2、5 和10 μmol/L 辛伐他汀的高糖DMEM 培养基培养48 h。
2.2 胰岛素释放试验及细胞内胰岛素含量的检测
将对数生长期的细胞消化离心后按5 ×104cells/well 接种于12 孔细胞培养板,待细胞长至60% ~70%融合,PBS 洗涤细胞1 次,分别给予不同组处理,在37 ℃、含95%空气和5%CO2的培养箱中孵育48 h 后,行胰岛素释放试验。吸出培养基,无糖Krebs-Ringer 碳酸氢盐缓冲液(KRBB:115 mmol/L NaCl,4.7 mmol/L KCl,1.2 mmol/L MgSO4,1.2 mmol/L KH2PO4,1.3 mmol/L CaCl2,24 mmol/L NaHCO3,0.1% BSA 和10 mmol/L HEPES,pH 7.4)洗涤细胞2 遍,加入无糖Krebs-Ringer 缓冲液,37 ℃孵育2 h,吸出缓冲液,每组分别加入含2.8 mmol/L(低糖)或16.7 mmol/L(高糖)葡萄糖的Krebs-Ringer 缓冲液,37 ℃孵育1 h,小心吸取上清液后4 ℃、1 000 r/min 离心5 min,取上清-70 ℃保存待测或直接用于检测。相应的细胞加入等量的酸醇提取液(75%无水乙醇,1.5%盐酸,23.5%超纯水;4 ℃贮存),4℃冰箱静置过夜,次日取上清离心后测定胰岛素,即为细胞内胰岛素的含量。每组实验均设复孔,重复3次。采用放射免疫分析法(严格按照试剂盒说明书操作)测定胰岛素水平。胰岛素浓度测定结果用细胞总蛋白浓度校正。
2.3 MIN6 细胞内三磷酸腺苷( adenine trisphosphate,ATP) 含量的测定 正常对照组细胞及予以辛伐他汀处理结束的细胞,采用生物化学发光法(萤光素酶方法)检测细胞内ATP 含量。ATP 水平的测定按照ATP 检测试剂盒说明书操作。吸除培养液,12 孔板每孔加入100 μL 裂解液裂解细胞。4 ℃、12 000 ×g 离心8 min,取上清。加100 μL ATP 检测工作液到检测管内,室温放置5 min。加20 μL 样品,迅速用微量移液器混匀,至少间隔2 s 后,立即用luminometer 测定RLU 值。ATP 检测试剂盒购自碧云天生物技术研究所,结果由细胞总蛋白浓度校正。
2.4 Kir6.2、CaV1.2 及GLUT2 mRNA 的检测 用总RNA 提取试剂盒提取MIN6 细胞的总RNA,用TaKa-Ra 逆转录试剂盒进行逆转录,最后cDNA 进行实时荧光定量PCR 扩增。PCR 反应体系为:cDNA 1 μL、上下游引物(10 μmol/L)各0.4 μL、SYBR® Premix Ex TaqTMⅡ(2 ×)5 μL、无核酶水3.2 μL。PCR 反应条件:95 ℃预变性30 s,95 ℃5 s,59 ℃15 s,72 ℃20 s,共55 个循环。每次反应设3 ~4 个复孔,重复3次。由实时荧光定量PCR 仪配套软件算出每个反应的平均荧光值,并除以相应内参照GAPDH 的平均荧光值,得到比值y,将正常对照组y 值的平均值视为100%,即可得出其它辛伐他汀处理组的相对荧光值。Kir6.2 上游引物5'-AAGGGCATTATCCCTGAGGAA-3',下游引物5'-TTGCCTTTCTTGGACACGAAG-3';CaV1. 2 上游引物5'-AGACGCTATGGGCTATGA-3',下游引物5'-AACACCGAGAACCAGATTTA-3';GLUT2 上游引物5'-TCAGAAGACAAGATCACCGGA-3',下游引物5'-GCTGGTGTGACTGTAAGTGGG-3';GAPDH 上游引物5'-AGGTCGGTGTGAACGGATTTG-3',下游引物5'-TGTAGACCATGTAGTTGAGGTCA-3'。
2.5 Kir6.2、CaV1.2 及GLUT2 蛋白表达的检测
采用Western blotting 检测Kir6.2、CaV1.2 及GLUT2蛋白的表达水平。收集细胞后加入细胞裂解液,冰上裂解20 ~30 min,期间振荡数次。13 400 ×g、4 ℃离心20 ~30 min,吸取上清,使用BCA 蛋白质定量试剂盒测定蛋白浓度。向蛋白质样品中加入5 ×上样缓冲液煮沸8 min,直接用于后续电泳或-70 ℃储存备用。Western blotting:取蛋白样品,进行SDSPAGE、转膜、封闭、Ⅰ抗Ⅱ抗反应、洗膜、显影定影。采用Bio-Rad Quantity One 软件分析显影条带,将Kir6. 2/GAPDH、CaV1. 2/GAPDH 及GLUT2/GAPDH的相对灰度值作为Kir6.2、CaV1.2 及GLUT2 的蛋白表达相对水平。
3 统计学处理
采用SPSS 19.0 软件分析。计量资料以均数±标准差(mean ±SD)表示,多组间均数比较采用单因素方差分析或非参数检验,以P <0.05 为差异有统计学意义。
结 果
1 辛伐他汀对MIN6 细胞胰岛素分泌功能及细胞内胰岛素含量的影响
1.1 低糖状态下MIN6 细胞胰岛素的分泌及细胞内胰岛素含量 辛伐他汀处理组MIN6 细胞在低糖状态下细胞内的胰岛素含量、分泌至细胞外的胰岛素量及细胞内外总胰岛素量较正常对照组明显减少(均P <0.05),且胰岛素分泌量呈浓度依赖性减少,见图1。
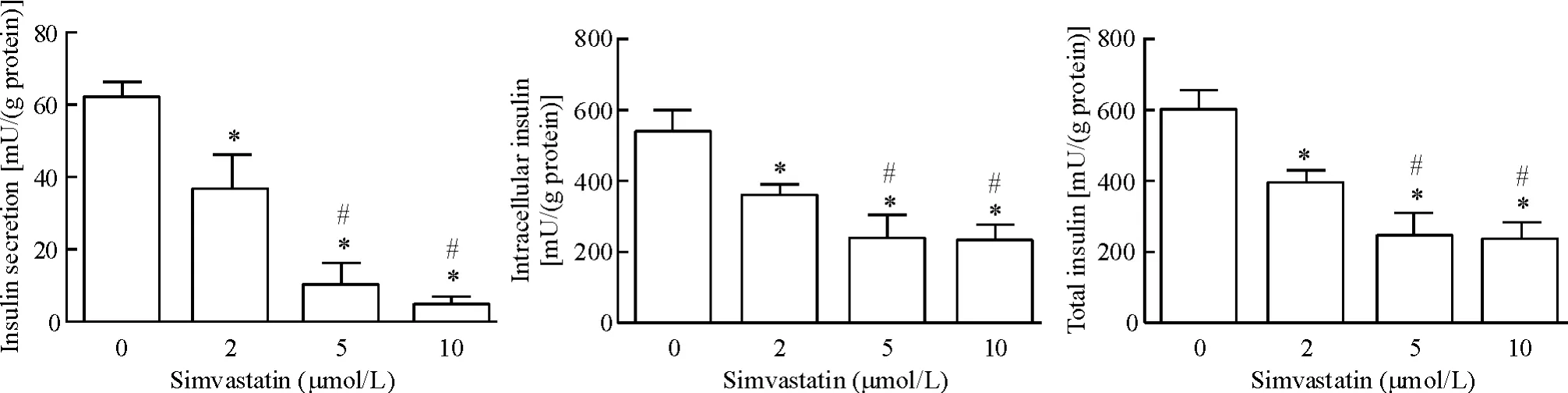
Figure 1. Insulin levels under low glucose condition in MIN6 cells treated with simvastatin at the concentrations of 0,2,5 and 10 μmol/L. Mean±SD.n=6. * P <0.05 vs 0 μmol/L;# P <0.05 vs 2 μmol/L.图1 低糖状态下胰岛素量比较
1.2 高糖刺激下MIN6 细胞胰岛素的分泌及细胞内胰岛素含量 辛伐他汀处理组MIN6 细胞在高糖状态下细胞内的胰岛素含量、分泌至细胞外的胰岛素量及细胞内外总胰岛素量较正常对照组明显减少(均P <0.05),且随着辛伐他汀浓度的增加,MIN6细胞内外总胰岛素量有所降低,高糖刺激下辛伐他汀10 μmol/L 组细胞内的胰岛素含量、分泌至胞外的胰岛素量及细胞内外总胰岛素量较2 μmol/L 组明显降低(均P <0.05),见图2。
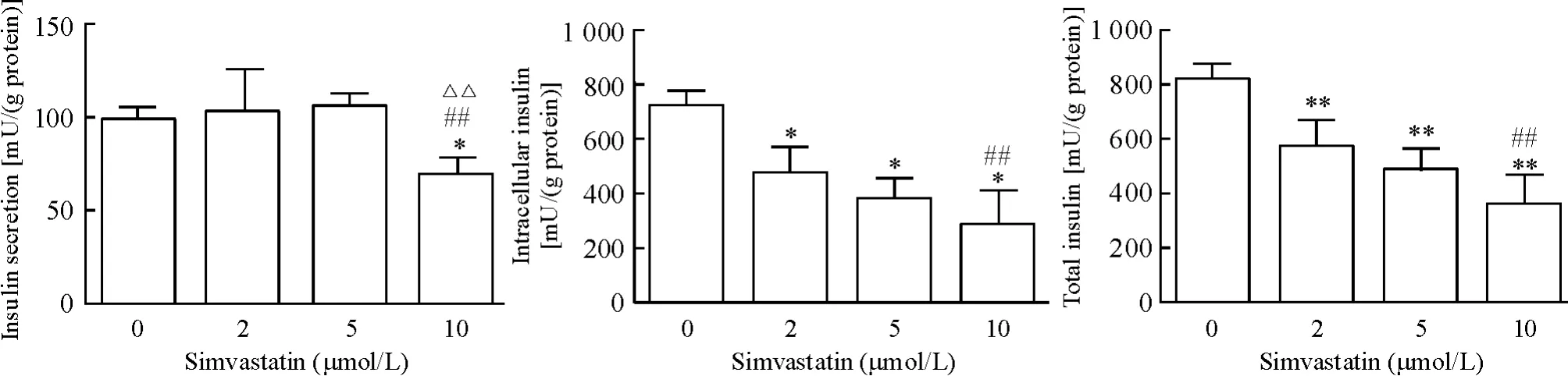
Figure 2. Insulin levels under high glucose condition in MIN6 cells treated with simvastatin at the concentrations of 0,2,5 and 10 μmol/L. Mean±SD.n=6. * P <0.05,**P <0.01 vs 0 μmol/L;##P <0.01 vs 2 μmol/L;△△P <0.01 vs 5 μmol/L.图2 高糖状态下胰岛素量比较
2 辛伐他汀对MIN6 细胞内ATP 水平的影响
与正常对照组比较,辛伐他汀处理后的MIN6 细胞裂解液中ATP 含量明显下降(均P <0.05),辛伐他汀10 μmol/L 组较5 μmol/L 组或2 μmol/L 组、5 μmol/L 组较2 μmol/L 组ATP 含量明显减少,差异有统计学意义(均P <0.05),见图3。
3 Kir6.2、CaV1.2 及GLUT2 的mRNA 水平
与正常对照组(mRNA 水平视为1)相比,辛伐他汀10 μmol/L 处理组MIN6 细胞Kir6.2 mRNA 水平上调为23.97 ±4.09(P <0.01),辛伐他汀5 μmol/L处理组MIN6 细胞CaV1.2 和GLUT2 mRNA 水平分别下调为0.63 ±0.22(P <0.01)和0.50 ±0.21(P <0.05),辛伐他汀10 μmol/L 处理组MIN6 细胞CaV1.2 和GLUT2 mRNA 水平分别下调为0.42 ±0.10(P <0.01)和0.26 ±0.11(P <0.01),辛伐他汀10 μmol/L 处理组Kir6.2 mRNA 水平较2 μmol/L 或5 μmol/L 组明显上调(均P <0.01),10 μmol/L 处理组CaV1.2 mRNA 水平较2 μmol/L 或5 μmol/L 组明显下调(P <0.01 或P <0.05),5 μmol/L 组CaV1.2 mRNA 水平较2 μmol/L 组亦明显下调(P <0.05),10 μmol/L 处理组GLUT2 mRNA 水平较2 μmol/L 组明显下调(P <0.05),见图4。

Figure 3. The content of ATP in MIN6 cells treated with simvastatin at the concentrations of 0,2,5 and 10 μmol/L for 48 h. Mean±SD. n=10. * P <0.05 vs 0 μmol/L;#P <0.05 vs 2 μmol/L;△P <0.05 vs 5 μmol/L.图3 各组MIN6 细胞内ATP 含量的比较
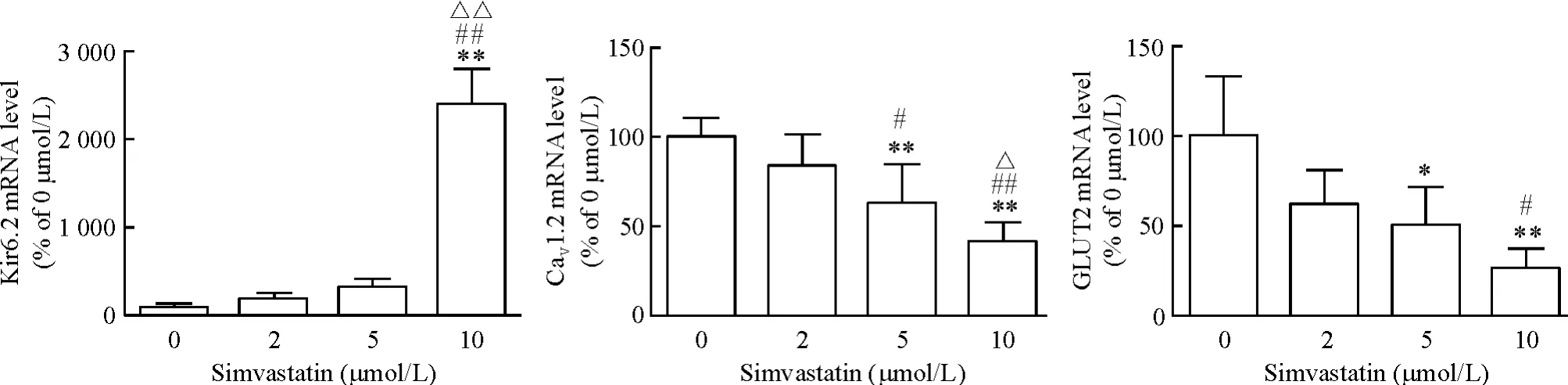
Figure 4. The relative mRNA levels of Kir6.2,CaV1.2 and GLUT2 in MIN6 cells treated with simvastatin at the concentrations of 0,2,5 and 10 μmol/L(group C)for 48 h. Mean±SD. n=10. * P <0.05,**P <0.01 vs 0 μmol/L;#P <0.05,##P <0.01 vs 2 μmol/L;△P <0.05,△△P <0.01 vs 5 μmol/L.图4 各组MIN6 细胞Kir6.2、CaV1.2 和GLUT2 的mRNA 相对水平
4 Kir6.2、CaV1.2 及GLUT2 蛋白的表达水平
与正常对照组相比,辛伐他汀5 和10 μmol/L处理组MIN6 细胞Kir6.2 蛋白表达水平分别上调约66%和91%(均P <0.01),5 和10 μmol/L 处理组Kir6.2 蛋白表达水平较2 μmol/L 组亦分别上调约23%和43%(P <0.05 和P <0.01);与正常对照组相比,辛伐他汀5 和10 μmol/L 处理组MIN6 细胞CaV1.2 蛋白表达水平分别下调约38%和79%(均P <0.01),10 μmol/L 处理组CaV1.2 蛋白表达水平较2 μmol/L 和5 μmol/L 组亦分别下调约73%和67%(均P <0.01);与正常对照组相比,辛伐他汀10 μmol/L 处理组MIN6 细胞GLUT2 蛋白表达水平下调约38%(P <0.01),10 μmol/L 处理组GLUT2蛋白表达水平较2 μmol/L 和5 μmol/L 组亦分别下调约29%和27%(P <0.01 和P <0.05),见图5。
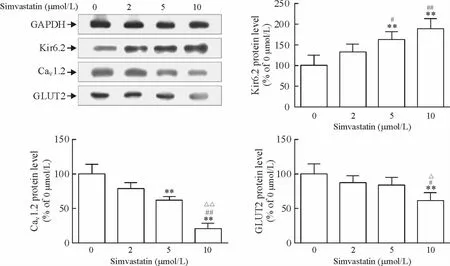
Figure 5. The relative protein levels of Kir6.2,CaV1.2 and GLUT2 in MIN6 cells treated with simvastatin at the concentrations of 0,2,5 and 10 μmol/L for 48 h. Mean±SD. n=3. **P <0.01 vs 0 μmol/L;#P <0.05,##P <0.01 vs 2 μmol/L;△P <0.05,△△P <0.01 vs 5 μmol/L.图5 各组MIN6 细胞Kir6.2、CaV1.2 和GLUT2 蛋白表达相对水平
讨 论
他汀类药物通过特异性抑制胆固醇合成过程中的限速酶——HMG-CoA 还原酶的活性,从而抑制胆固醇合成、降低血浆胆固醇水平,具有稳定血管内粥样斑块、抗动脉粥样硬化作用,因此被广泛应用于心血管科、神经科、内分泌科、肾脏科等领域。有研究显示,阿托伐他汀可以通过抑制蛋白激酶C(protein kinase C,PKC)的活化从而对抗高糖诱导的内皮细胞产生的氧化应激反应[11]。瑞舒伐他汀能显著抑制C-反应蛋白(C-reactive protein,CRP)刺激晚期内皮祖细胞(endothelial outgrowth cells,EOCs)所致的炎症因子白细胞介素8(interleukin-8,IL-8)和单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)以及血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)和细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)的分泌,从而为动脉粥样硬化的防治提供新的靶点[12]。然而,近年来他汀类药物的使用特别是强化剂量的他汀治疗对糖代谢的影响也引发了极大的关注[13-17]。但迄今为止,他汀带来糖尿病风险的机制研究极为匮乏。
他汀类药物影响糖代谢、降低胰岛素敏感性、增加糖尿病发生风险的具体机制,目前尚不清楚。Nakata 等[18]的研究发现,阿托伐他汀能够抑制脂肪细胞的成熟以及GLUT4 的表达,减弱胰岛素在脂肪细胞中的作用,从而导致胰岛素敏感性的降低。他汀对糖代谢的不良影响也可能与其使体内某些代谢产物的减少有关。辅酶Q10不仅在抗氧化和稳定细胞膜方面发挥重要作用,也参与线粒体的氧化磷酸化,在机体的能量代谢中发挥重要作用[19]。已有研究表明,某些他汀类药物能够显著降低血浆辅酶Q10的水平[20-23]。而辅酶Q10的降低会抑制线粒体的氧化磷酸化和ATP 的生成。他汀可以抑制甲羟戊酸途径,不仅阻止了胆固醇的合成,也同样阻止了体内某些甲羟戊酸代谢产物如类异戊二烯和辅酶Q10的生物合成[24],从而影响糖代谢和胰岛素敏感性。
胰腺β 细胞胰岛素的合成和分泌是一个完整有序的过程。目前,对于葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion,GSIS)的共识是:胰腺β 细胞属于电可兴奋性细胞,葡萄糖通过GLUT2 进入胰腺β 细胞,被葡萄糖激酶磷酸化代谢生成ATP,从而使ATP 敏感性钾通道(KATP)关闭,细胞膜去极化,电压依赖性钙通道(CaV)开放,钙离子内流,细胞内钙离子浓度升高,激活胰岛素分泌所需的一系列酶或蛋白,导致胰岛素分泌。因此,胰腺β细胞胰岛素的分泌受到多种因素、多个环节的影响。本研究结果表明辛伐他汀干预48 h 能够明显抑制小鼠胰腺β 细胞株MIN6 在基础葡萄糖水平(2.8 mmol/L)及高糖(16.7 mmol/L)刺激下胰岛素的合成和分泌,这种抑制作用呈明显的剂量依赖性。
本研究对辛伐他汀抑制胰腺β 细胞胰岛素分泌的机制进行了探讨。ATP 是胰腺β 细胞胰岛素分泌的重要调节物质,胰腺β 细胞内ATP 浓度的下降会抑制KATP通道的关闭,抑制细胞膜去极化,进而抑制CaV通道的开放,最终抑制胰岛素的分泌。本实验结果也证实,中、高浓度的辛伐他汀对小鼠胰腺β 细胞内ATP 的生成具有明显的抑制作用且呈剂量依赖性。
ATP 敏感性钾通道(KATP)是一个八聚体,在小鼠胰腺β 细胞中由4 个内向整流钾通道亚单位Kir6.2 和硫脲类药物受体亚单位SUR1 组成。KATP通道把胰腺β 细胞内的糖代谢过程和细胞膜的电活动相偶联[25],在胰岛素的分泌过程中发挥重要的调节作用。KATP通道调控胰岛素分泌的活性有赖于Kir6.2 和SUR1 亚单位在基因和蛋白水平上的协调表达[26]。胰腺β 细胞分泌胰岛素是一个相当复杂而精密的过程,CaV在这一过程中起着非常重要的调控作用。在胰腺β 细胞膜上,CaV通道主要包括L型钙通道和非L 型钙通道,而以L 型钙通道为主[27]。
本实验中,实时荧光定量PCR 结果表明,5 μmol/L 及10 μmol/L 的辛伐他汀干预48 h 后,MIN6细胞Kir6.2 mRNA 表达水平明显升高,而CaV1.2 及GLUT2 mRNA 表达受到明显抑制。Western blotting结果进一步证实,辛伐他汀能够上调Kir6.2 蛋白的表达水平,而下调CaV1. 2 及GLUT2 蛋白的表达。Kir6.2 通道为内向整流钾通道,在维持胰腺β 细胞膜的静息电位及胰岛素分泌过程中都发挥着重要作用。当Kir6.2 通道蛋白表达升高时,细胞膜不易去极化,从而影响CaV1.2 通道的开放,胞外钙离子内流减少,进而抑制胰岛素的分泌。CaV1.2 通道蛋白表达的降低也可以减少胞外钙离子内流,胞浆中钙离子浓度降低,胰岛素分泌减少。GLUT2 蛋白表达的下调,能够降低胰腺β 细胞对葡萄糖的摄取利用,从而影响胰岛素的分泌。
循证医学证据表明,他汀类药物的抗动脉粥样硬化作用与其应用剂量有关[28]。因此,该类药物的临床应用剂量有日益增加的趋势。本研究结果提示,2 μmol/L、5 μmol/L 及10 μmol/L 的辛伐他汀干预48 h 均呈现出明显的胰岛素分泌抑制作用。可见,在长期大剂量应用辛伐他汀时,可能引起辛伐他汀血药浓度的明显升高,此时应注意其对胰腺β 细胞功能的潜在影响。
总之,他汀类药物对于心血管系统的有益作用是毋庸置疑的,但考虑到他汀治疗特别是大剂量他汀强化治疗对糖代谢和胰岛素敏感性的不利影响,因此在临床实践中,应该注意病人血糖的变化,减少他汀对糖代谢不良影响事件的发生。
[1] Sever PS,Dahlöf B,Poulter NR,et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations,in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm(ASCOT-LLA):a multicentre randomised controlled trial[J].Lancet,2003,361(9364):1149-1158.
[2] Cholesterol Treatment Trialists' (CCT)Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol:a meta-analysis of data from 170 000 participants in 26 randomised trials[J]. Lancet,2010,376(9753):1670-1681.
[3] 尹明景,温汉春,叶永维,等. 高盐高脂摄入致大鼠主动脉重构及辛伐他汀的阻断作用[J].中国病理生理杂志,2012,28(2):228-233.
[4] Smith SC Jr,Allen J,Blair SN,et al. AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease:2006 update:endorsed by the National Heart,Lung,and Blood Institute[J]. J Am Coll Cardiol,2006,47(10):2130-2139.
[5] Grundy SM,Cleeman JI,Merz CN,et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines[J]. Circulation,2004,110(2):227-239.
[6] Expert Panel on Detection,Evaluation,and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP)Expert Panel on Detection,Evaluation,and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III)[J]. JAMA,2001,285(19):2486-2497.
[7] Graham I,Atar D,Borch-Johnsen K,et al. European guidelines on cardiovascular disease prevention in clinical practice:executive summary:Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice(Constituted by representatives of nine societies and by invited experts)[J]. Eur Heart J,2007,28(19):2375-2414.
[8] Preiss D,Seshasai SR,Welsh P,et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy:a meta-analysis[J]. JAMA,2011,305(24):2556-2564.
[9] Rajpathak SN,Kumbhani DJ,Crandall J,et al. Statin therapy and risk of developing type 2 diabetes:a meta-analysis[J]. Diabetes Care,2009,32(10):1924-1929.
[10]Sattar N,Preiss D,Murray HM,et al. Statins and risk of incident diabetes:a collaborative meta-analysis of randomised statin trials[J]. Lancet,2010,375(9716):735-742.
[11]柴大军,宁若冰,祝 江,等. 阿托伐他汀通过抑制PKC的激活对抗高糖诱导的人脐静脉内皮细胞氧化应激反应[J].中国病理生理杂志,2012,28(9):1537-1542.
[12]钟钧琳,彭 隆,罗艳婷,等. 瑞舒伐他汀抑制C-反应蛋白诱导的晚期内皮祖细胞炎症因子的表达[J].中国病理生理杂志,2013,29(4):597-602.
[13]Ridker PM,Danielson E,Fonseca FA,et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein[J]. N Engl J Med,2008,359(21):2195-2207.
[14]Heart Protection Study Collaborative Group. MRC/BHF heart protection study of cholesterol lowering with simvastatin in 20 536 high-risk individuals:a randomised placebocontrolled trial[J]. Lancet,2002,360(9326):7-22.
[15]Kjekshus J,Apetrei E,Barrios V,et al. Rosuvastatin in older patients with systolic heart failure[J]. N Engl J Med,2007,357(22):2248-2261.
[16] Waters DD,Ho JE,DeMicco DA,et al. Predictors of new-onset diabetes in patients treated with atorvastatin:results from 3 large randomized clinical trials[J].J Am Coll Cardiol,2011,57(14):1535-1545.
[17] Koh KK,Quon MJ,Han SH,et al. Atorvastatin causes insulin resistance and increases ambient glycemia in hypercholesterolemic patients[J].J Am Coll Cardiol,2010,55(12):1209-1216.
[18]Nakata M,Nagasaka S,Kusaka I,et al. Effects of statins on the adipocyte maturation and expression of glucose transporter 4 (SLC2A4):implications in glycaemic control[J]. Diabetologia,2006,49(8):1881-1892.
[19]Bentinger M,Tekle M,Dallner G. Coenzyme Q:biosynthesis and functions[J]. Biochem Biophys Res Commun,2010,396(1):74-79.
[20]Berthold HK,Naini A,Di Mauro S,et al. Effect of ezetimibe and/or simvastatin on coenzyme Q10 levels in plasma:a randomised trial[J]. Drug Saf,2006,29(8):703-712.
[21]Kawashiri MA,Nohara A,Tada H,et al. Comparison of effects of pitavastatin and atorvastatin on plasma coenzyme Q10 in heterozygous familial hypercholesterolemia:results from a crossover study[J].Clin Pharmacol Ther,2008,83(5):731-739.
[22] Chu CS,Kou HS,Lee CJ,et al. Effect of atorvastatin withdrawal on circulating coenzyme Q10concentration in patients with hypercholesterolemia[J]. Biofactors,2006,28(3-4):177-184.
[23] Watts GF,Castelluccio C,Rice-Evans C,et al. Plasma coenzyme Q (ubiquinone)concentrations in patients treated with simvastatin[J]. J Clin Pathol,1993,46(11):1055-1057.
[24] Kostapanos MS,Milionis HJ,Elisaf MS. An overview of the extra-lipid effects of rosuvastatin[J]. J Cardiovasc Pharmacol Ther,2008,13(3):157-174.
[25]Taneja TK,Mankouri J,Karnik R,et al. Sarl-GTPasedependent ER exit of KATPchannels revealed by a mutation causing congenital hyperinsulinism[J]. Hum Mol Genet,2009,18(13):2400-2413.
[26]Moritz W,Leech CA,Ferrer J,et al. Regulated expression of adenosine triphosphate-sensitive potassium channel subunits in pancreatic β-cells[J]. Endocrinology,2001,142(1):129-138.
[27] Gilbert M,Jung SR,Reed BJ,et al. Islet oxygen consumption and insulin secretion tightly coupled to calcium derived from L-type calcium channels but not from the endoplasmic reticulum[J]. J Biol Chem,2008,283(36):24334-24342.
[28]Pedersen TR,Cater NB,Faergeman O,et al.Comparison of atorvastatin 80 mg/day versus simvastatin 20 to 40 mg/day on frequency of cardiovascular events late (five years)after acute myocardial infarction (from the Incremental Decrease in End Points through Aggressive Lipid Lowering[IDEAL]trial)[J]. Am J Cardiol,2010,106(3):354-359.
