绿原酸对体外培养成骨细胞活性的影响
2013-12-22王朝元易继凌魏甜甜唐俊龙杨光忠
王朝元,易继凌,宋 超,魏甜甜,唐俊龙,杨光忠
(1 中南民族大学 生命科学学院,武汉430074;2中南民族大学 药学院,武汉430074)
接骨草(Sambucuschinensis)为忍冬科接骨木属,又名陆英、杜仲.主要分布于华北、华南、陕西、甘肃、四川、宁夏等省区.接骨草的根、茎、叶、花和果实均可入药,有祛风除湿、活血化瘀之功效.在传统中医药中,它可治疗风湿疼痛、痢疾、黄疸、慢性气管炎、风疹瘙痒、丹毒、跌打损伤和骨折[1,2],目前关于接骨草防治骨质疏松和促进成骨细胞增殖的报道较多[3],但其促进骨折愈合的有效成分尚不清楚.
绿原酸(chlorogenic acid ,CGA)是接骨草的化学成分之一,通常存在于杜仲、金银花、葵花籽粕等植物中[4,5].现有研究表明:CGA具有广泛的生理活性和药理活性,如利胆、抗菌、降压、增加白血球和兴奋中枢系统,抗肿瘤,清除自由基等[6-8].故本实验以成骨细胞MC3T3-E1为体外模型,研究CGA对成骨细胞活性、ALP活性和成骨分化相关基因的影响,以阐明其是否具有促成骨作用,为接骨草的临床应用提供理论依据.
1 材料和方法
1.1 试剂和仪器
CGA(SIGMA-ALDRICH公司),α-MEM培养基(Thermo赛默飞世尔生化制品有限公司),胎牛血清(杭州四季青公司),0.25%的胰蛋白酶(Thermo),青链霉素(Thermo),DMSO(Amresco,0231),MTT(Amerro),碱性磷酸酶试剂盒(南京建成生物工程研究所),BCA蛋白试剂盒(碧云天生物技术研究所),反转录试剂盒(Thermo),SYBR Green荧光染料(日本TOYOBO公司).
细胞培养瓶(美国Corning公司),96孔、24孔、6孔培养板(美国Corning公司),CO2培养箱(HF90/240型,利康生物医疗科技控股集团),倒置显微镜(Motic AE21型,重庆光学仪器),酶联免疫分析仪(MULTISKAN ASCENT 354型,thermo),PCR仪(Biometra),凝胶成像分析仪(JS-380A,上海培清科技),荧光定量PCR仪(ABI,7500 fast).
1.2 不同浓度CGA的制备
称取0.05g CGA溶于50 mL α-MEM培养基(无血清),配制成浓度为1 mg/mL的储备液.再用含10%血清的α-MEM培养基将CGA储备液倍比稀释为11.02,22.05,44.09,88.19μmol/L等处理细胞.
1.3 成骨细胞 MC3T3-E1的培养
取液氮冻存的成骨细胞MC3T3-E1复苏后,用含有10%胎牛血清的α-MEM完全培养基,置于37℃培养箱中培养,每隔3~4d更换1次培养基,待细胞90%铺满瓶底时,用0.25%的胰蛋白酶消化,按1︰2传代培养.
1.4 CGA对成骨细胞增殖率的影响
将生长状态良好的MC3T3-E1细胞以5×103/孔接种于96孔板中,置于37℃,5% CO2培养箱中培养.细胞贴壁后,分别加入含上述浓度CGA的培养基,设不加药为对照组,每组5个复孔,分别培养0,1,3 d后,每孔分别加入20 μL MTT,置于37℃,5% CO2培养箱中进行培养,反应4 h,小心吸出上清液,每孔加入150 μL DMSO,吹打均匀后,在37℃培养箱中温育10 min,使其紫色结晶完全溶解,用酶标仪在492nm波长处测定其OD值.
1.5 CGA对成骨细胞碱性磷酸酶活性的影响
将生长状态良好的成骨细胞MC3T3-E1按105/孔接种到24孔板中,置于37℃,5% CO2培养箱中培养.待细胞贴壁后加入22.05,44.09 μmol/L药物(该浓度下对成骨细胞增殖促进作用较好)设不加药为对照组,每组3个复孔,分别培养2,4,6 d后,按照ALP试剂盒和BCA蛋白试剂盒的操作步骤测定细胞中ALP活性.
1.6 CGA对成骨细胞成骨分化相关基因表达的影响
将生长状态良好的MC3T3-E1细胞按2×105/孔接种到6孔板中,置于37℃,5% CO2培养箱中培养.待细胞贴壁后加入药物,设不加药为对照组,每组3个复孔,分别培养2,4,6 d后,用Trizol法提取总RNA,用反转录试剂盒合成cDNA,并进行real-time PCR.反应条件:95℃,15s;60℃,15s;72℃,45s;40个循环.以看家基因GAPDH为内参,每个样品设3个复孔,采用2﹣ΔΔCt法[9]检测成骨分化相关基因的表达,不同骨相关基因PCR引物序列如见表1.

表1 荧光定量PCR引物序列
1.7 统计学处理
根据公式F=2﹣[(待测组目的基因平均Ct值-待测组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)],计算出目的基因的相对表达量.用单因素方差分析(one-way ANOVA)对结果进行显著性差异分析.
2 结果与分析
2.1 CGA对成骨细胞增殖的影响
不同浓度CGA对成骨细胞增殖的影响结果见图1.如图1所示,CGA浓度为11.02~88.19μmol/L时,对成骨细胞的增殖均有较好的促进作用,选择22.05,44.09 μmol/L两个浓度用于后续实验.

1)control;2~5)依次为11.02,22.05,44.09,88.19μmol/L CGA
2.2 CGA对成骨细胞ALP活性的影响
CGA对成骨细胞ALP活性的影响见图2.由图2可见,培养2 d时,44.09 μmol/L的CGA能促进成骨细胞MC3T3-E1ALP活性的表达(P<0.01).培养4 d时,CGA对成骨细胞MC3T3-E1ALP活性无显著影响(P>0.05).随着培养时间的增加,培养至6d时,22.05、44.09 μmol/L CGA对成骨细胞ALP活性的影响具有抑制作用(P<0.05).
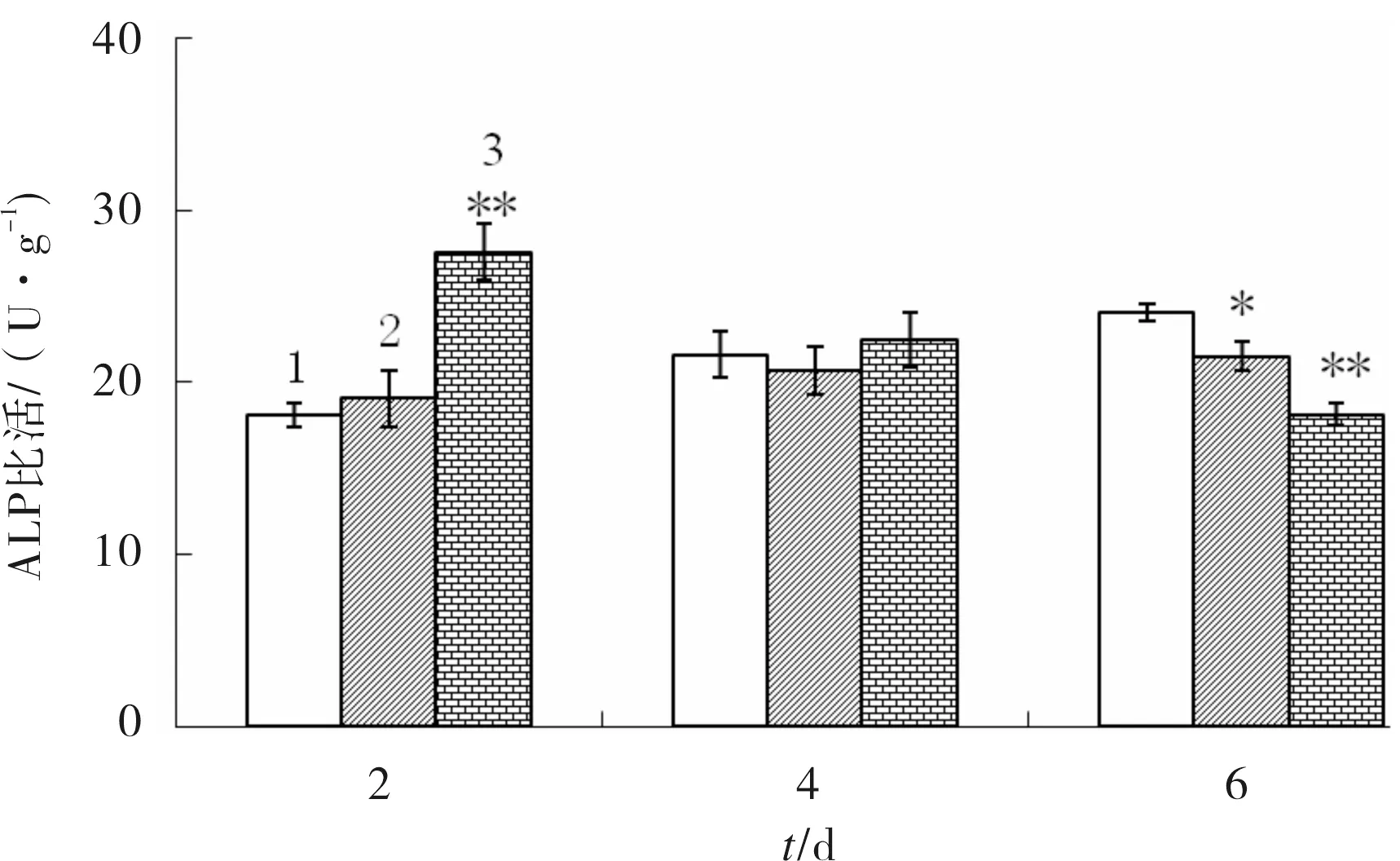
1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA
2.3 CGA对成骨细胞成骨分化相关基因mRNA表达的影响
CGA对c-fos基因mRNA表达的影响见图3.由图3可见,培养2d时,2种浓度的CGA对c-fos基因的表达均有极显著促进作用(P<0.01);4d时,44.09 μmol/L CGA对c-fos基因表达的影响逐渐由促进转为抑制(P<0.05);6d时,22.05 μmol/L CGA对c-fos基因表达明显抑制(P<0.01),呈时间依赖性.
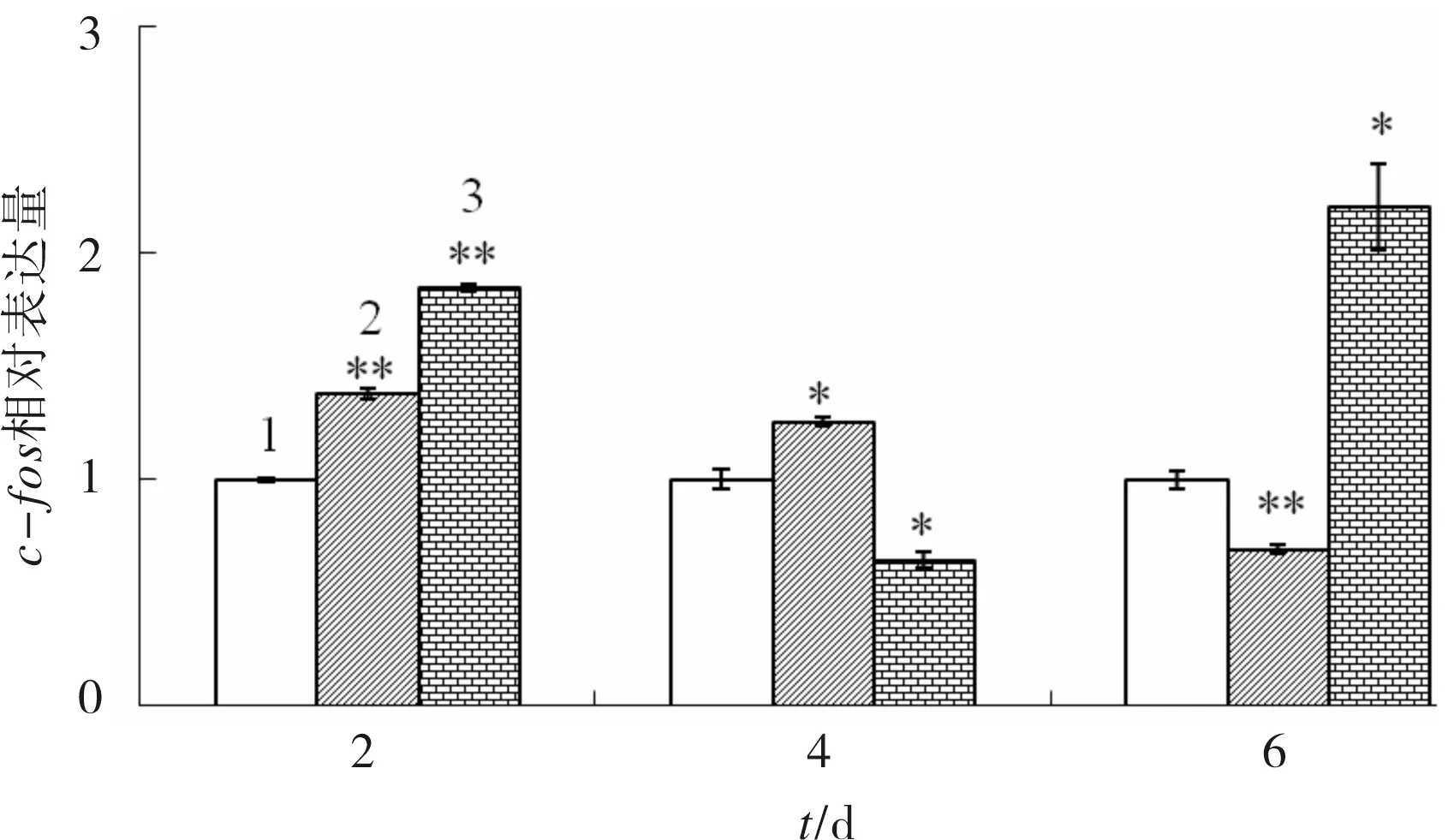
1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA
CGA对c-jun基因表达的影响见图4.由图4可见,22.05 μmol/L CGA短期处理(2~4 d)不影响c-jun基因表达(P>0.05),长期处理(6 d)则表现为抑制作用(P<0.05).44.09 μmol/L CGA处理2 d可显著促进c-jun基因表达(P<0.01),长期处理(4~6 d)则具有显著的抑制作用(P<0.01).故CGA对成骨细胞c-jun基因表达亦呈明显的时间依赖性.

1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA 与对照组比较,*P<0.05,**P<0.01,n=3
CGA对Runx2基因表达的影响见图5.由图5可见,其影响呈明显的时间依赖性.22.05 μmol/L CGA培养2~4d时,对Runx2 基因的表达呈上调作用(P<0.01),至6 d时,则表现为强烈的抑制作用(P<0.01).44.09 μmol/L的CGA在短期处理(2d)时,显著促进Runx2 基因的表达(P<0.01),但是随着培养时间的延长,促进作用变成抑制(P<0.01)或没有显著影响(P>0.01).

1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA
如图6所示,CGA对osterix基因表达的影响也具有明显的时间依赖性.两种浓度的CGA短期处理(2 d)时,均极显著地促进Osterix基因的表达(P<0.01).随着培养时间的增加(4~6 d),两种浓度的CGA处理对成骨细胞osterix表达的促进作用显著减弱,直至抑制作用(P<0.01).

1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA
如图7显示,与CGA对ALP基因表达的影响与osterix基因类似,也具有明显的时间依赖性.培养2 d,2种浓度的CGA均促进ALP基因的表达(P<0.05); 4~6 d时,2种浓度的CGA对ALP基因的表达均具有不同程度的抑制(P<0.05).

1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA
图8中CGA对Col-I基因表达的影响也呈明显的时间依赖性.但与CGA对Osterix和ALP基因表达的影响相反,随着培养时间的延长,CGA对Col-I基因表达的促进作用增强.在2~6 d,22.05 μmol/L CGA对Col-I基因表达的影响由抑制转为促进(P<0.01);而44.09 μmol/L的CGA对Col-I基因表达的影响始终具有促进作用(P<0.05),随着培养时间的增加,促进作用愈发显著(P<0.01).

1)control;2)22.05 μmol/L CGA;3)44.09 μmol/L CGA
3 讨论
MC3T3-E1细胞系是由C57BL/6小鼠颅骨细胞建株的成骨细胞,具有碱性磷酸酶活性,I型胶原合成和基质钙化等成骨细胞的生物学特性,常作为骨代谢研究的细胞模型[10].故本研究以MC3T3-E1细胞系来探讨CGA对成骨细胞增殖及活性的影响.
本实验中,11.02~ 88.19 μmol/L的CGA在不同的时间点对成骨细胞的增殖均具有一定的促进作用,以22.05,44.09 μmol/L的CGA在2个浓度的CGA进行进一步研究.
ALP的表达是成骨细胞分化早期的主要特征之一,是成熟成骨细胞的标志,其活性的高低可反映成骨细胞的活性状况[11].故本文研究了CGA对ALP活性的影响.在2~6 d,随着处理时间的延长,22.05 μmol/L CGA对ALP活性的影响由不影响变为抑制,44.09 μmol/L CGA对成骨细胞ALP活性的影响则由促进变为抑制,并与随后的CGA对ALP基因表达的影响结果一致.说明CGA对成骨细胞ALP活性的调控主要通过对其mRNA转录的调控来实现.
Runx2是干细胞向成骨细胞早期分化的重要标志基因,高表达Runx2可激活骨钙蛋白、骨桥蛋白和骨涎蛋白的转录和表达,从而促进成骨细胞成熟[12].Osterix是一种成骨细胞特异性表达的锌指结构转录因子,对成骨细胞的分化起着重要作用.Osterix转录受Runx2正性调控,直接促进前成骨细胞向成骨细胞分化.Osterix能调控许多重要成骨细胞晚期表型和功能蛋白的表达,如骨钙蛋白、骨桥蛋白、骨涎蛋白及I型胶原[13].在本研究中,CGA对Runx2和Osterix基因的表达具有显著的时间依赖性,短期处理可以促进Runx2和OsterixmRNA的表达,随着处理时间的延长,则表现为抑制作用.这一结果说明CGA短期处理可能促进干细胞向成骨细胞的分化,而长期处理则不利于干细胞向成骨细胞的分化.
十分有意义的是,CGA可以促进成骨细胞Col-I的表达.I型胶原蛋白是成骨细胞分泌的骨主要有机成分,是成骨细胞的分化标志之一[14].本实验中,除了短期培养(2 d)时,低浓度(22.05μmol/L)的CGA对Col-I基因的表达具有一定抑制作用(P<0.05),4~6 d,CGA均能显著促进Col-I基因的表达,并呈时间依赖性.说明合适浓度的CGA对成骨细胞成熟具有正向调控作用,有助于骨基质的形成和骨生长.
原癌基因c-fos产物与其他一些转录因子如c-jun表达的癌蛋白结合,形成活性蛋白-1(AP-1),进而调控其他基因的转录,导致一系列生物学效应的产生,进而促进细胞的分裂增殖[15].在成骨细胞中,c-jun调控相关基因如骨钙素、I型胶原、碱性磷酸酶和组蛋白转录[16],故c-jun是调节成骨细胞增殖分化的基因之一.本研究中,CGA对c-fos和c-jun表达影响具有一定的复杂性,尚需进一步的研究阐明其机理.
综上所述,CGA具有调控成骨细胞增殖和分化的能力,CGA可促进成骨细胞的增殖,抑制成骨细胞ALP活性;CGA长期处理不利于干细胞向成骨细胞的分化,它通过促进I型胶原的表达而促进骨成熟分化.故CGA具有一定的成骨活性,是接骨草的成骨活性成分之一.
[1]蔡凌云.接骨草黄酮成分的初步研究[J].凯里学院学报,2010,28(6):62-65.
[2]张金昕.杜仲和续断在骨伤科中的应用[J].陕西中医学院学报,2009,32(1):74-75.
[3]钱维娜,张艳红.杜仲对体外培养大鼠骨髓基质细胞增殖和分化的影响[J].安徽农业科学,2009,37(14):6461-6462.
[4]李胜华,李爱民,伍贤进.接骨草化学成分研究 [J].中草药,2011,42( 8):1502-1504.
[5]尉 芹,马希汉,景谦平.杜仲叶中绿原酸的提取工艺件研究[J].林产化学与产业,2001,21(4):27-32.
[6] Hai-Tao Lu.Application of preparative high-speed counter-counter chromatography for separation of chlorogenic acid from Flos Loncease [ J ].J Chromatogr A,2004,1026(1/2):185-190.
[7] 史秀玲,高银辉.绿原酸对小鼠急性肝损伤的保护作用[J].中国实验方剂学杂志,2011,17(19):199-202.
[8] 王丽萍,郭 栋,王 果,等.中药绿原酸的研究进展[J].时珍国医国药,2011,22(4):961-963.
[9] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔTmethod[J].Methods,2001,25(4):402-408.
[10]Sudo H,Kodama H,Amagai Y,et al.In vitro differentiation and calcification in a new clone osteogenic cell line derived from newborn mouse calvaria [J].J Cell Biol,1983,96(1):191-198.
[11] Effenberger K E ,Johnsen S A ,Monroe D G,et al.Regulation of osteoblastic phenotype and gene expression by hop-derived phytoestrogens[J].J Steroid Biochem Mol Biol ,2005,96(5):387-399.
[12] Ducy P,Starbuck M,Priemel M,et a1.A Cbfal-dependent genetic pathway controls bone formation beyond embryonic development [J].Genes Dev,1999,13(8):1025-1036.
[13] Ohyama Y,Nifuji A,Maeda Y,et al.Spacioternporal association and bone morphogenetic protein regulation of sclerostin and osterix expression during embryonic osteogenesis[J].Endocrinology,2004,145(10): 4685-4692.
[14] Raisz L G .Fall P M Gabbitas B Y ,et al .Effects of prostaglandinE2 on bone formation in cultured fetal rat calvariae: roleofinsulin-like growth factor-I[J].Endocrinology,1993,133(4):1504-1510.
[15] 郭 勇,张西正,赵云山,等.碱性成纤维细胞生长因子对成骨细胞生长与c-fos表达的影响[J].生物医学工程学杂志,2004,21(1):8-11.
[16] Palcy S,Bolivar I,Goltzman D.Role of activator protein 1 transcriptional activity in the regulation of gene expression by transforming growth factor beta1 and bone morphogenetic protein 2 in ROS17/2.8 osteoblast-like cells[J].J Bone Miner Res,2000,15(12): 2352-2361.
