L-谷氨酸-5-乙酯及其金属配合物的合成、表征和催化活性
2013-12-22金龙飞吴勇飞
金龙飞,毛 骁,吴勇飞,王 龙,杨 明
(中南民族大学 化学与材料科学学院,武汉 430074)
L-谷氨酸为配体的金属配合物与某些蛋白质、酶等生物大分子的活性中心具有相似性,引起了人们广泛关注[1-3].Djordjevic等[4]合成了L-谷氨酸盐与金属钼的配合物,并对其晶体结构进行了研究;Davis等[5]研究了L-谷氨酸脱羧酶磷酸化的模型,更好地了解了脑神经传导的生理意义.
根据谷氨酸与三磷酸腺苷分解酶和辅酶的特征结构残基基团的相似性,本文在L-谷氨酸-5-甲酯及其金属配合物研究的基础上[6],以L-谷氨酸为原料合成了L-谷氨酸-5-乙酯(图1)及其金属配合物,并对三磷酸腺苷分解的催化活性进行了研究.本文扩展了谷氨酸衍生物与相应的金属配合物对三磷酸腺苷分解的催化活性研究,为合成具有三磷酸腺苷分解酶和辅酶活性的模拟化合物提供参考.
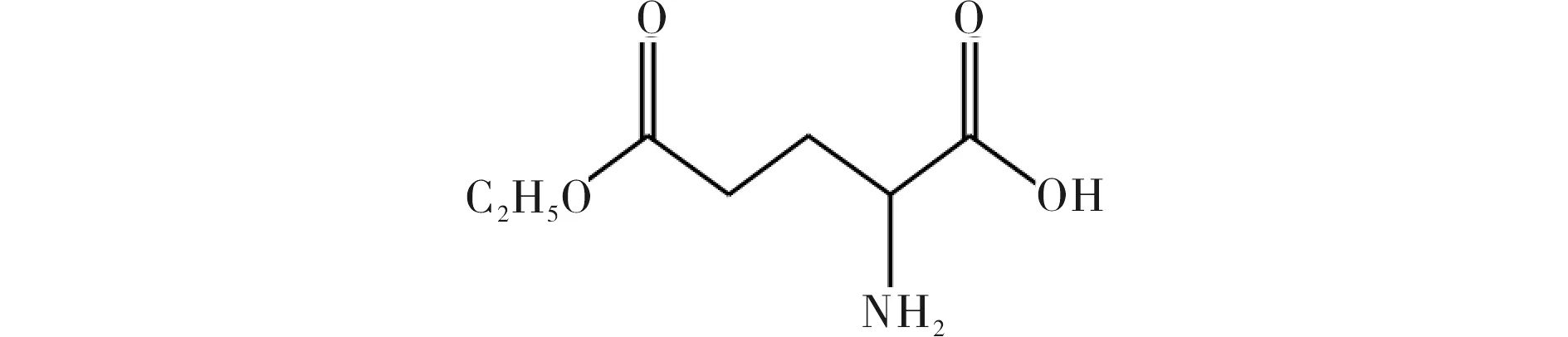
图1 L-谷氨酸-5-乙酯结构
1 实验部分
1.1 仪器和试剂
元素分析仪(Perkin-Elmer 2400CHN 型,德国);高分辨傅立叶红外光谱仪(FT-IR NEXUS智能型,KBr压片,美国Nicolet公司);数字熔点仪(X-4型,25℃,190~700nm,北京泰克仪器有限公司);CCD X-射线单晶衍射仪(Bruker Smart APEX型,德国).
无水甲醇、乙醇、Na2CO3·10H2O、三乙胺、硫酸、MgCl2·6H2O、Ca(OH)2、NaOH均为分析纯;L-谷氨酸、三磷酸腺苷二钠为生物试剂.
1.2 实验方法
1.2.1 L-谷氨酸-5-乙酯合成
L-谷氨酸-5-乙酯参照文献[7]合成.取L-谷氨酸7.50 g (0.05 mol)置于烧瓶中,加入无水乙醇150 mL,边搅拌边加入98% 浓H2SO44 mL,25℃下反应5 ~ 6h.用三乙胺的乙醇溶液(V(醇)︰V(胺)= 2︰1)调节至pH = 8.0,置于冰箱中过夜.次日抽滤,用95%乙醇进行重结晶,用乙醇洗涤.常温下真空干燥至恒重,纯品为白色晶体状固体.产率:91.8%,m.p.167 ~ 168℃.Anal.calcd for C7H13NO4: C 48.04,H 7.49,N 8.00; found C 47.82,H 7.45,N 8.12 .FI-IR (KBr,υ/cm-1: 2987 m,2381 w,1736 s,1613 s,1586 s,1353 m,1082 m.
1.2.2 配合物L-谷氨酸-5-乙酯合镁的合成
将0.35 g (2.00 mmol)L-谷氨酸-5-乙酯溶于20 mL水中,在室温下搅拌使其完全溶解,缓慢滴加溶有0.21 g (1.05 mmol)MgCl2·6H2O的5 mL水溶液,用0.10mol/L Na2CO3溶液缓慢调节溶液的pH=6.0 ~ 7.0,溶液为无色.继续反应30 min,反应完毕后减压蒸馏溶液至粘稠状,加入无水甲醇10 ~ 15mL,出现白色沉淀物,过滤,用无水甲醇洗涤,干燥.产率: 83.2%,m.p.> 300℃.Anal.calcd for C14H24MgN2O8: C 45.12,H 6.49,N7.52; found C 45.02,H6.52,N7.40.FI-IR (KBr,υ/cm-1): 1732 s,1610 s,1558 s,1346 m,1041 m,538 m,465 m.
1.2.3 配合物L-谷氨酸-5-乙酯合钙的合成
将0.35 g (2.00 mmol)L-谷氨酸-5-乙酯溶于20 mL水中,在室温下搅拌使其完全溶解.用Ca(OH)2的水溶液(0.001mol/L)缓慢调节pH=7.0,溶液为无色.继续反应30 min,反应完毕后减压蒸馏溶液至粘稠状,加入无水甲醇10 ~ 15mL,溶液中出现白色沉淀物,过滤,用无水甲醇洗涤后干燥.产率:74.7%,m.p.> 300℃.Anal.calcd for C14H24CaN2O8: C 43.29,H 6.23,N 7.21; found C 43.35,H 6.30,N 7.26.FI-IR (KBr,υ/cm-1): 1726 s,1618 s,1578 s,1322 m,1042 m,556 m,438 m.
1.2.4 L-谷氨酸-5-乙酯结构的测定
取0.50 mm×0.49 mm×0.02 mm单晶放置在X-射线单晶衍射仪上,在273(2)K,采用石墨单色化的MoK射线(λ= 0.71073 Å)作为衍射光源,扫描方式为φ和ω,在2.36≤θ≤26.00收集得到5098个衍射点,其中1927个为独立点,Rint=0.027.所有数据均采用SADABS multi-scan校正程序校正[8,9],其中,对满足I>2σ(I)的1927个点进行结构解析,晶体结构用直接法解得.对所有非氢原子坐标,使用全矩阵最小二乘法进行各项异性温度因子修正[9-11].对与N和C原子键合的H原子,采用骑跨式理论加氢,其中键长分别为0.89 (NH3―H原子)、0.98 (CH―H原子)、0.97 Å (CH2―H原子 )和0.96 Å (CH3―H原子 ),Ueq(H)为1.2Ueq(母体原子)(对于―CH3和―NH3的H原子,为1.5Ueq).最终精修结果为:R1= 0.0598,wR2=0.1751(见表1).

表1 L-谷氨酸-5-乙酯晶体数据和结构精修数据
注:a)R=∑║Fo│-│Fc║∕∑│Fo│;
b)wR=[∑w(│Fo│2-│Fc│2)2]/∑w│Fo│2]1/2.
1.2.5 金属配合物对三磷酸腺苷二钠分解的催化活性测试
金属配合物对三磷酸腺苷二钠催化分解反应的效果(活力大小),可用反应终止后反应液中无机磷的含量衡量.而无机磷可与硫酸钼酸铵反应生成有色化合物,因此无机磷含量可用比色法测定.
具体金属配合物对三磷酸腺苷二钠分解活性的测定,可通过测定混合体系的OD值后,比较无机磷标准曲线得相应的无机磷含量,即可判断出活性影响[12].
无机磷标准曲线的绘制:在均加有0.1 mL 20%三氯酸(TCA)、0.3 mL H2O的7支编号试管中分别加入0.1mL的0,10,20,30,40,50,60mmol/L的Na2HPO3,再于各试管中加入2.5 mL硫酸钼酸铵-硫酸亚铁溶液,摇匀并于波长660 nm处测定吸收值OD.测量5次/样品.以测定的OD值为纵坐标,Pi浓度为横坐标作图,即得无机磷标准曲线(图2).

图2 无机磷标准曲线
金属配合物对三磷酸腺苷二钠分解活性的测定则通过测定混合体系的OD值后,比较无机磷标准曲线得相应的无机磷含量,即可判断出活性影响.具体操作:分别取反应介质0.4 mL 于两支试管中,在其中一支试管中加入0.4 mL配合物的溶液,再加入1.0 mL溶剂;另一支试管中直接加入1.4 mL溶剂(以此混合溶液作为参照液).于室温下反应5min后在两只试管中均加入0.2 mL 20%TCA中止反应。吸取上述反应液各0.5 mL,均加入2.5 mL硫酸钼酸铵-硫酸亚铁溶液.以参照液为对照测定配合物的溶液在660 nm处的OD值.其中,反应溶剂按以下比例配置:
①介质溶液:50 mmol/L三羟基氨基甲烷Tris-HCl(PH=8.80)+5mmol/L三磷酸腺苷二钠+20 mmol·L-1NaCl+100 mmol/L CH3OH;
②10%质量分数的硫酸钼酸铵溶液:10 g钼酸铵+100 mL的(5 mol/L)硫酸;
③硫酸钼酸铵-硫酸亚铁溶液:5 g硫酸亚铁+10 mL 10%硫酸钼酸铵溶液+87.5 mL蒸馏水;
④待测目标配合物溶液配制:将待测目标配体及其配合物配成溶液,浓度约为16 g/L.
2 结果与讨论
2.1 L-谷氨酸-5-乙酯及其配合物结构光谱分析
2.1.1 L-谷氨酸-5-乙酯的组成及红外光谱分析
L-谷氨酸-5-乙酯易溶于水,难溶于甲醇、乙醇、乙醚、DMF等有机溶剂.1.0 mol·L-1的L-谷氨酸-5-乙酯的水溶液的pH约为4.5.元素分析的测量结果与理论计算结果基本相符.

2.1.2 L-谷氨酸-5-乙酯配合物的组成及红外分析

2.1.3 L-谷氨酸-5-乙酯的晶体结构分析

图3 L-谷氨酸-5-乙酯的结构
L-谷氨酸-5-乙酯晶体属单斜晶系,P2(1)空间群,a=9.691(3)Å、b=5.2631(17)Å、c=17.297(6)Å;β=90.752(5)°.其独立单元结构如图3所示,每个结构单元中有两种独立的分子,都是以分子内盐的形式存在,其键长、键角和扭角都在正常范围内(见表2、表3).其扭转角N1-C2-C1-O2(ψ1),N1-C2-C1-O2(ψ2),N2-C9-C8-O5(ψ3)和N2-C9-C8-O6(ψ4)分别是159.9(4)°,-23.4(5)°,157.7(4)° 和26.7(5)°;N1-C2-C3-C4(χ1)= -159.8(4)°,C2-C3-C4-C5(χ2)= 170.5(4)°,N2-C9-C10-C11(χ3)= -57.3(5)°,C9-C10-C11-C12(χ4)= -175.8(5)°,与L-谷氨酸(ψ1= -35°,ψ2=145°,χ1=±60°,χ2=180°)有所改变.
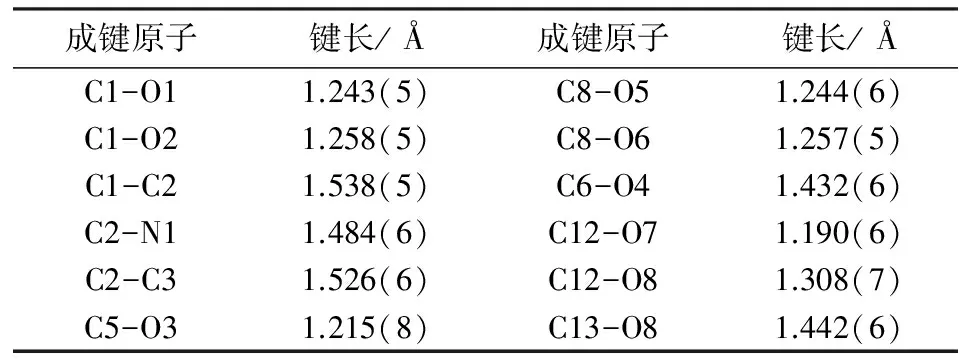
表2 L-谷氨酸-5-乙酯中选择的部分键长(Å)

表3 L-谷氨酸-5-乙酯中选择的部分键角(°)和扭角(°)
L-谷氨酸-5-乙酯晶体的晶胞堆积图见图4.在晶体结构中,分子间存在N-H…O氢键作用(见表4).化合物分子沿ob方向堆积,分子间通过N-H…O 或 O…H-N 构成聚合单元.

图4 L-谷氨酸-5-乙酯的晶胞堆积图

表4 氢键的键长(Å)和键角(°)
对称性代码: (i)x,y-1,z; (ii)x,y+1,z; (iii)-x+2,y+1/2,-z+1; (iv)-x+1,y-3/2,-z+1.
2.2 化合物对三磷酸腺苷二钠分解的催化活性
通过比色法,无机磷标准曲线中配体L-谷氨酸-5-乙酯及其配合物吸光度A对应的无机磷含量见表5.由表5可知,在室温下,对三磷酸腺苷二钠的分解反应,与Mg(II)配合物和Ca(II)配合物相比,L-谷氨酸-5-乙酯的催化活性很弱,基本上可以忽略.而Ca(II)和Mg(II)配合物则对三磷酸腺苷二钠分解具有一定的催化活性,其中L-谷氨酸-5-乙酯合钙的活性略大于L-谷氨酸-5-乙酯合镁.

表5 化合物体系磷含量的测定值
3 结语
以L-谷氨酸为原料,在乙醇溶液中,加入硫酸为催化剂,合成了配体L-谷氨酸-5-乙酯,和相应的Mg(II)和Ca(II)配合物.对L-谷氨酸-5-乙酯的X-单晶衍射测定表明,L-谷氨酸-5-乙酯属于单斜晶系,P2(1)空间群,其中a=9.691(3)Å、b=5.2631(17)Å、c=17.297(6)Å;β=90.752(5)°.对配体L-谷氨酸-5-乙酯及其配合物体系的无机磷含量的比色法测定结果表明,配体L-谷氨酸-5-乙酯对三磷酸腺苷二钠的分解反应基本无催化活性;而配合物L-谷氨酸-5-乙酯合镁和L-谷氨酸-5-乙酯合钙对三磷酸腺苷二钠的分解反应则具有一定的活性.
[1]Miranda C T,Carvalho S,Yamaki R T,et al.Formation and structure in aqueous solution of complexes between vanadium(V)and aminohydroxamic acids that potentiates vanadium′s insulinomimetic activity: L-glutamicγ-hydroxamic and L-aspartic-β-hydroxamic acids[J].Inorg Chim Acta,2010,363(14),3776-3783.
[2]Sundararaju B,Chen H,Shilcutt S,et al.The role of glutamic acid-69 in the activation of Citrobacter freundii tyrosine phenol-lyase by monovalent cations[J].Biochemistry,2000,39 (29): 8546-8555.
[3]Li G,Vaidya A,Viswanathan K,et al.Rapid regioselective oligomerization of L-glutamic acid diethyl ester catalyzed by papain[J].Macromolecules,2006,39 (23): 7915-7921.
[4]Djordjevic C,Vuletic N,Bradley A,et al.Molybdenum(VI)peroxoα-amino acid complexes:synthesis,spectra,and properties of MoO(O2)2(α-aa)(H2O)for α-aa = glycine,alanine,proline,valine,leucine,serine,asparagine,glutamine,and glutamic acid.X-ray crystal structures of the glycine,alanine,and proline compounds[J].Inorg Chem,1997,36(9): 1798-1805.
[5]Wei J,Davis K M,Wu H,et al.Protein phosphorylation of human brain glutamic acid decarboxylase (GAD)65 and GAD67 and its physiological implications[J].Biochemistry,2004,43 (20): 6182-6189.
[6]金龙飞,范 昕,吴勇飞,等.L-谷氨酸-5-甲酯金属铜化合物的合成、表征以及生物活性[J].中南民族大学学报: 自然科学版,2012,31(2): 15-19.
[7]李为明,王小妹.L-谷氨酰胺制备研究[J].化工时刊,1999(9):16-19.
[8]Sheldrick G M.SHELXL97.program for the refinement of crystal structure[M].Göttingen: University of Göttingen,1997.
[9]Sheldrick G M.SADABS [M].Göttingen: University of Göttingen,1996.
[10]Bruker AXS Inc.SMART APEX(Version 5.628),SAINT+(Version 6.45)and SHELXTL-NT(Version 6.12)[M].Madison: Bruker AXS Inc,2001.
[11]Sheldrick G M.SHELXS97 and SHELXL97 [M].Göttingen:University of Göttingen,1997.
[12]金龙飞,沈月松,吴勇飞,等.L-谷氨酸-5-甲酯金属化合物的合成、表征和生物活性的研究[J].中南民族大学学报: 自然科学版,2011,30(1): 17-20.
[13]刘国湘,张新信,胡德荣,等.氨基酸酯化方法的比较及其红外光谱研究[J].氨基酸和生物资源,1995,17 (3): 36-38.
[14]黄德如,汪仁庆.无机和配位化合物的红外和拉曼光谱[M].3版.北京: 化工工业出版社,1986: 235 -239.
[15]乐学义,杨 光,卢其明.[Mn(H2O)(phen)2(PAc)](ClO4)的合成,红外光谱及晶体结构[J].无机化学学报,2002,18 (4): 427 -430.
[16]卢文贯,潘育方,彭翠红.配合物[Cu(HPHAC)2(py)2]的合成和晶体结构[J].无机化学学报,2005,21(5): 721-724.
[17]马卫兴,钱保华,高 健,等.配合物[Zn(tren)(H-SSA)]的合成,晶体结构及表征[J].无机化学学报,2005,21(4): 612 -616.
[18]祝心德,党元林,王成刚,等.2 ,4 -二羟基苯甲酸缩硫脲及其配物的合成与生物活性研究[J].无机化学学报,1997,13(1): 68-70.
