浒苔干粉末提取物对东海原甲藻和中肋骨条藻的克生作用
2013-12-20韩秀荣侯俊妮李鸿妹石晓勇
韩秀荣,高 嵩,侯俊妮,李鸿妹,石晓勇,3,*
(1.中国海洋大学化学化工学院,青岛 266100;2.中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100;3.国家海洋局减灾中心,北京 100194)
在海洋生态系统中,大型藻类对防止水体富营养化,净化水体起着重要的作用[1],是海洋生态系统极其重要的生物调节因子[2]。另外,很多大型藻类都能向海洋分泌释放出多种次级代谢产物,其中包括不饱和脂肪酸、糖苷、硫化物、多酚、以及萜类等化合物[3]。这些化合物在海洋生态系统中承担着十分重要的角色[4-5]。这些大型藻类产生的次级代谢产物通常具有某些特殊的化学结构及生理功能,对海洋生态系统的其他藻类起到一定的克生作用[6-11]。目前针对海洋中大型藻体内克生物质的提取、分离以及鉴定和这些克生物质在实际中的应用已经成为海洋生态环境研究的热点问题之一[4,12-17]。
近年来绿潮灾害在我国多次暴发,给沿海经济的发展及人们的生活造成了很大影响。自2007年在黄海海域首次出现小规模绿潮之后,2008—2012年又连续暴发大规模绿潮[18-21]。作为黄海海域绿潮的主要藻种-浒苔,目前对其次级代谢产物的提取与应用的研究较少。
本研究通过不同极性的溶剂对浒苔干粉末进行萃取,收集提取物。并以东海原甲藻及中肋骨条藻为实验对象,用不同溶剂的浒苔提取物,在不同浓度的添加情况下,分别研究对这两种赤潮藻生长的克生作用。通过在不同条件下对这两种常见赤潮藻生长克生作用的分析,为浒苔藻体内克生物质的分离、鉴定以及利用提供一定的科学基础。
1 材料与方法
1.1 实验材料
1.1.1 浒苔
实验所用的浒苔均采自青岛沿海,浒苔采集后除去杂藻,用经醋酸纤维滤膜(孔径0.45μm)过滤后的灭菌(120℃,20 min)海水反复清洗,以除去藻体中泥沙及其它杂物。将其培养于已灭菌(120℃,20 min)的锥形瓶中,用灭菌海水配置的f/2培养液进行培养。培养温度为(20±1)℃;光照强度为4000 lx;光照周期为L∶D=12 h∶12 h。每天定时晃动培养瓶,每隔3d更换新的培养液。
培养若干天后从培养瓶中挑选生长良好的浒苔藻体,用灭菌海水冲洗4—5次,然后用灭菌滤纸吸干藻体表面的水分,在常温下干燥5d左右(期间对藻体进行多次称量,以确定干燥完全至恒重,干湿比约为1∶4.4),然后用玛瑙研钵研磨成粉末,过筛(粒径小于0.2 mm)待用。
1.1.2 赤潮藻
实验用的东海原甲藻和中肋骨条藻均取自中国海洋大学海洋污染生态化学重点实验室藻种室,培养介质与培养条件与1.1.1中浒苔藻体一致。
1.2 浒苔干粉末提取物的制备
1.2.1 蒸馏水提取物
称取10.0 g上述浒苔干粉末放置于500 mL锥形瓶中,加入100 mL蒸馏水,摇晃均匀。常温下用超声波法提取2 h,静置12 h。常温下再用超声波法提取2 h,然后用离心机分离(7500 r/min,15 min),收集上层的提取液。下层粉末残渣再按上述方法提取1次,合并两次上层提取液。将收集的提取液用旋转蒸发仪减压蒸干,获得淡绿色膏状物质,加入蒸馏水后定容至25.00 mL,此时浓度以400 g/L表示(即400 g浒苔干粉末组织提取物溶于1 L蒸馏水中),最后置于冰箱冷藏(4℃)备用。
1.2.2 有机溶剂提取物的制备
选用3种极性不同的有机溶剂:甲醇、乙酸乙酯、正己烷(极性由高至低),分别对5.0 g浒苔干粉末进行提取,得到相应的提取物。提取方法及条件与1.2.1中蒸馏水提取一致。然后分别将所得提取物用二甲基亚砜Dimethy lsulfoxide(DMSO)定容至10 mL,浓度以500 g/L表示(即500 g浒苔干粉末组织提取物溶于1 L有机溶剂中),置于冰箱冷藏(4℃)备用。
1.3 实验方法
实验在室内的光照培养箱内进行,培养条件同1.1.1中浒苔培养条件一致。每天定时晃动培养瓶两次,防止赤潮藻贴壁生长。为降低光照条件对实验的影响,每两天将培养瓶进行位置互换。
1.3.1 溶剂检验实验
将梯度为 0,1,5,10,20,25,50,100,200 μL 的 DMSO 分别加入到 100 mL 锥形瓶中,然后加入 f/2 培养液以及两种赤潮藻的藻液,混合液的总体积为 20 mL,浓度梯度分别为 0,0.05,0.25,0.50,1.00,1.25,2.50,5.00,10.00 g/L。其中东海原甲藻和中肋骨条藻的接种密度均为5.5×104个/mL。各实验均平行进行3组,实验周期为9 d。
1.3.2 蒸馏水提取物对两种赤潮藻生长的影响
将预先制备好的浒苔干粉末的蒸馏水提取物(浓度 400 g/L)以梯度为 0,0.06,0.12,0.25,0.50,1.00 mL分别加入到100 mL锥形瓶中,然后加入f/2培养液以及两种赤潮藻的藻液,混合液的总体积为20 mL。混合液中浒苔干粉末的蒸馏水提取物的浓度梯度分别为 0,1.25,2.50,5.00,10.00,20.00 g/L。东海原甲藻和中肋骨条藻的接种密度均为5.5×104个/mL。各实验均平行进行3组,实验周期为9 d。
1.3.3 有机溶剂提取物对两种赤潮藻生长的影响
将预先制备好的浒苔干粉末的有机溶剂提取物(浓度500 g/L)以梯度为 0,1,5,10,20,25,50,100 μL分别加入到100 mL锥形瓶中,然后加入f/2培养液以及两种赤潮藻的藻液,混合液的总体积为20 mL。混合液中浒苔干粉末的有机溶剂提取物的浓度梯度分别为 0,0.03,0.13,0.25,0.5,0.63,1.25,2.50 g/L。东海原甲藻和中肋骨条藻的接种密度也均为5.5×104个/mL。各实验均平行进行3组,实验周期为9 d。
1.4 数据处理及统计分析
1.4.1 赤潮藻的日平均生长率、抑制率P'与半效应浓度EC50
每天的固定时间用光学显微镜,采用浮游生物计数框的计数方法得出赤潮藻的细胞密度。赤潮藻的日平均生长率(υs,%/d)的计算公式如下:

式中,N0和Nt分别是实验开始和实验进行到第t天时的赤潮藻的细胞密度。
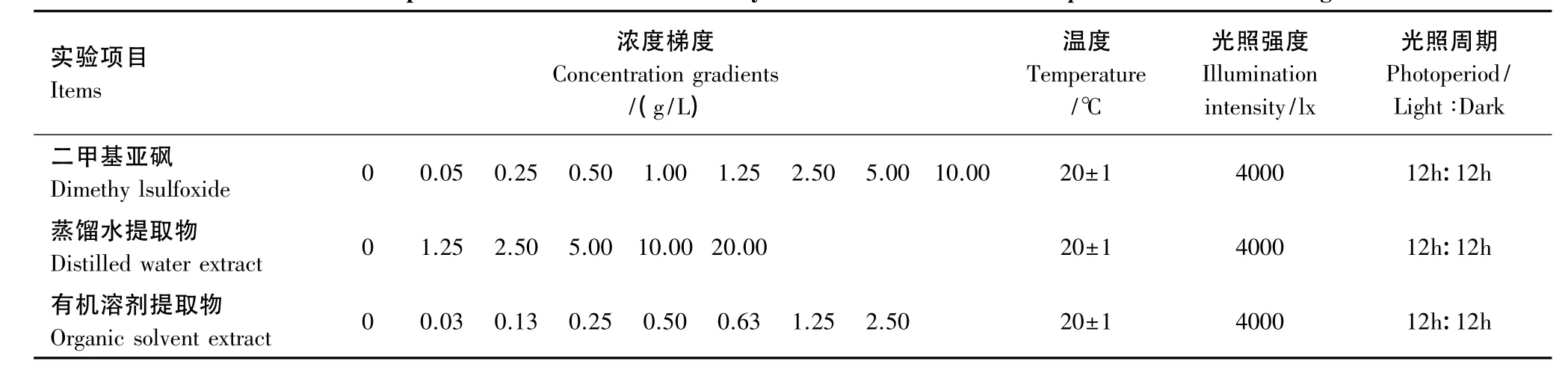
表1 浒苔对赤潮藻克生作用实验中所设置的实验条件Table 1 The experimental conditions in the assays for the effects of Enteromorpha on red-tide microalgae
抑制率P'(%)的计算公式如下:

式中,B0-control为对照组赤潮藻的起始藻种密度;Bt-control为对照组的赤潮藻t时刻的藻种密度。Bt为实验组的赤潮藻t时刻的藻种密度。
EC50是指在一定时间内(如72 h,96 h等),浮游植物的相对生长率减少50%时毒性物质的浓度。EC50的值越小,说明毒性越大。EC50能够简单、明确的表示物质对浮游植物的生物毒性,因此在生物毒性学中是一个重要的参数,并得到了广泛应用。本研究半效应浓度EC50值采用内插直线法计算,为72 h的EC50值。
1.4.2 数据统计分析
采用SPSS16.0软件对实验数据进行独立样本检验统计分析,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果与讨论
2.1 溶剂DMSO检验结果
不同的DMSO添加对东海原甲藻和中肋骨条藻两种赤潮藻生长的影响如图1所示。从图中可以明显看出,不同梯度添加DMSO的实验组中的这两种赤潮藻的生长曲线均与对照组(0 g/L DMSO添加量)呈现出相似的增长趋势。由图中可知中肋骨条藻的增长较东海原甲藻速度快,藻种密度平均高一个数量级。用软件SPSS16.0对两种赤潮藻实验组和对照组的细胞密度进行t-test检验和F检验,结果表明这两种赤潮藻的实验组和对照组之间均没有显著性差异(P>0.05)。说明溶剂DMSO对这两种赤潮藻的生长不产生影响,以下实验可以用该试剂进行实验。
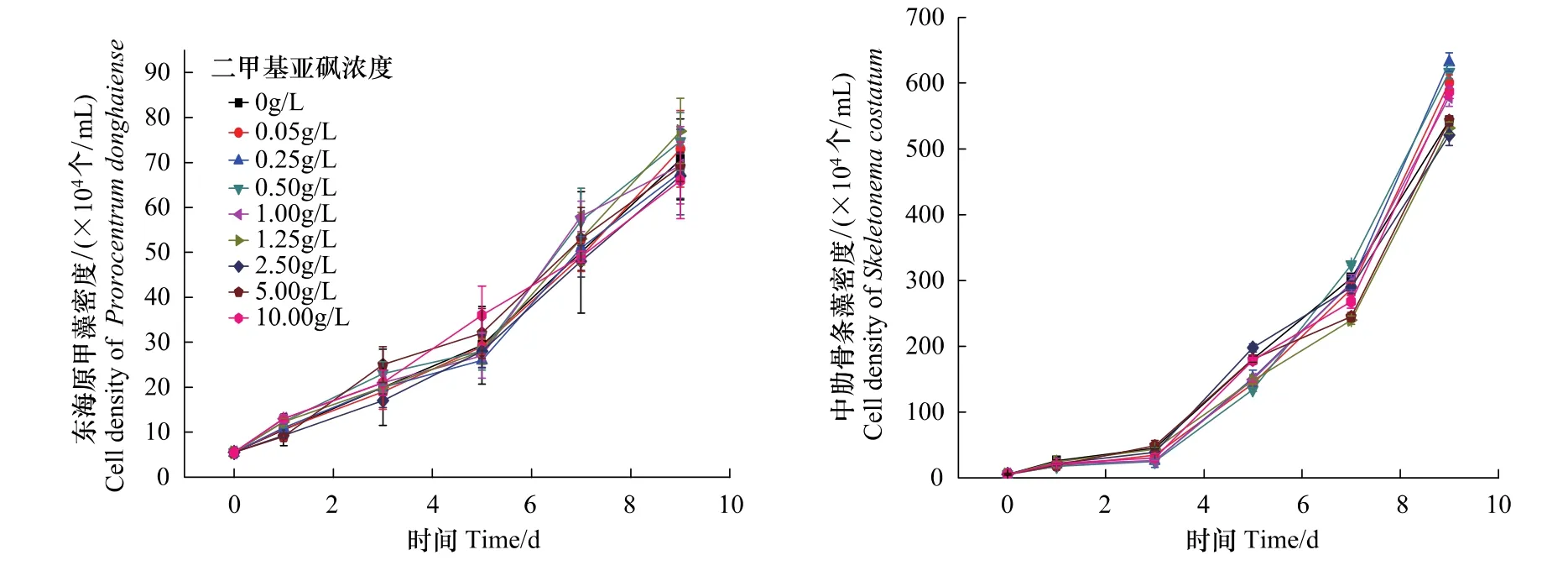
图1 二甲基亚砜对东海原甲藻和中肋骨条藻生长的影响Fig.1 The effect of Dimethy lsulfoxide(DMSO)on Prorocentrum donghaiense and Skeletonema costatum
2.2 浒苔干粉末提取物对东海原甲藻生长的影响
浒苔干粉末的蒸馏水提取物对东海原甲藻生长的影响如图2及表2所示。由图2可知,与对照组(0 g/L添加)相比,较低浓度(1.25 g/L添加)的浒苔干粉末蒸馏水提取物对东海原甲藻的生长有促进作用。较高浓度(>1.25 g/L的添加)的浒苔干粉末蒸馏水提取物对东海原甲藻的生长有抑制作用。也证实了对克生作用(Allelopathy)的定义:有利或有害的相互作用。其中由于克生物质浓度的不同,产生的作用也可能会不同,抑制或者促进生长。
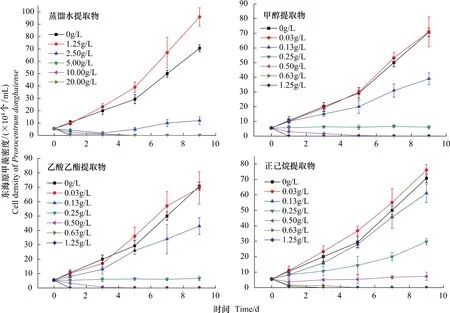
图2 添加了不同浓度浒苔干粉末提取物的东海原甲藻的生长曲线Fig.2 The growth of Prorocentrum donghaiense in the presence of different concentrations of extracts
由图2可知,浓度为1.25 g/L的浒苔干粉末蒸馏水提取物的添加组中东海原甲藻较快的进入指数增长期,并且比对照组的生长更快。浓度为2.50 g/L的蒸馏水提取物的添加对东海原甲藻的生长有着明显的抑制作用,在实验过程中东海原甲藻的增长缓慢,始终没有进入明显的指数生长期。说明开始出现对东海原甲藻产生抑制作用的浓度在1.25 g/L与2.50 g/L之间,此外,蒸馏水提取物对东海原甲藻的72 h EC50值为1.79 g/L。推测浒苔干粉末蒸馏水提取物对东海原甲藻开始出现抑制作用的阈值浓度为1.50 g/L。浓度≥5.00 g/L的浒苔干粉末蒸馏水提取物对东海原甲藻有着极其显著的抑制效应,东海原甲藻的藻体在3 d内全部死亡,具有短期致死效应。5.00、10.00、20.00 g/L的蒸馏水提取物物组的东海原甲藻的生长表现一致,说明5.00 g/L的蒸馏水提取物是影响东海原甲藻生长的致死作用阈值浓度,大于等于该值时对藻体表现为短期致死的效应。从表2中的抑制率可以得到同样结果。
浒苔甲醇提取物对东海原甲藻生长的效应如图2与表2所示。较低浓度(0.03 g/L)的浒苔甲醇提取物的添加与对照组相比,东海原甲藻的生长曲线基本一致,几乎对藻体没有影响。由表2所示,随着提取物添加浓度的增大,东海原甲藻的生长受到的抑制作用逐渐显著,抑制率逐渐增大,日平均生长率依次降低,实验末东海原甲藻的藻密度减少。当添加浓度增至0.13 g/L时即表现出了对藻体相对明显的抑制作用,藻体的指数增长期极不明显。此外,浒苔甲醇提取物对东海原甲藻的72 h EC50值为0.16 g/L。由此推测浒苔甲醇蒸馏水提取物对东海原甲藻开始出现抑制作用的阈值浓度约为0.10 g/L。由图2所示,当添加浓度为0.25 g/L时则对东海原甲藻的生长表现出了极其强的抑制作用,由表2得出此时藻体的日平均生长率仅为1%。当添加浓度≥0.50 g/L时则对东海原甲藻的生长产生强烈的致死效应,3 d内致使东海原甲藻藻体全部死亡。说明0.50 g/L的甲醇提取物添加是影响东海原甲藻生长的致死作用阈值浓度,大于等于该值时对藻体表现为短期致死的效应,从表2中的抑制率也可以得到同样结果。
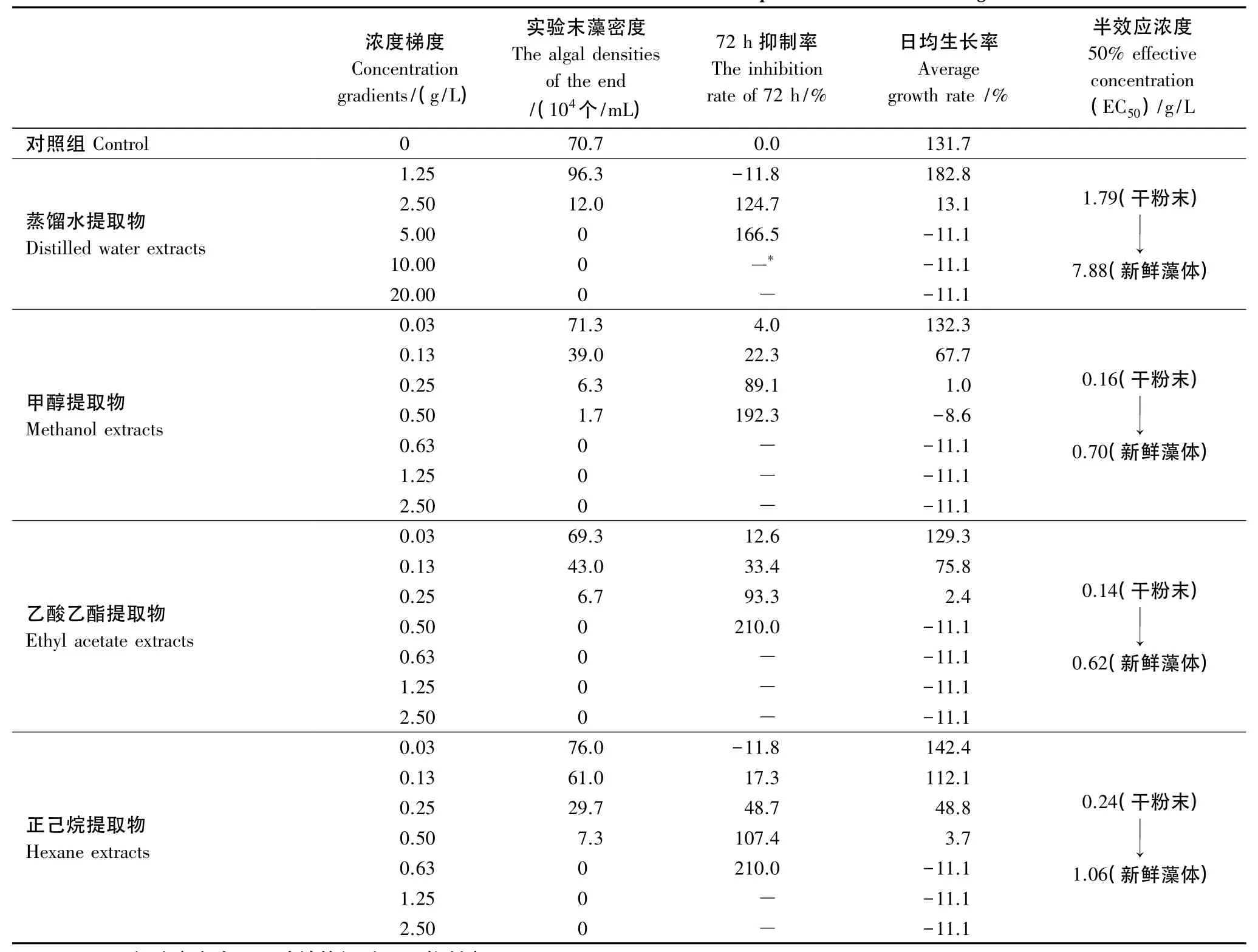
表2 浒苔干粉末不同溶剂提取物对东海原甲藻生长影响的比较Table 2 The effection of different solvent extracts of Enteromorpha on Prorocentrum donghaiense
浒苔乙酸乙酯提取物对东海原甲藻生长的效应如图2所示。与浒苔甲醇提取物添加实验中东海原甲藻生长曲线比较相似,同样表现为较低浓度(0.03 g/L)时对东海原甲藻生长的影响不显著。由表2所示藻体的日平均生长率以及实验末的藻密度均与对照组基本相同。较高浓度添加时也与甲醇提取物添加实验中东海原甲藻生长曲线比较相似。此外,浒苔乙酸乙酯提取物对东海原甲藻的72 h EC50值为0.14 g/L。由此推测浒苔乙酸乙酯提取物对东海原甲藻开始出现抑制作用的阈值浓度约为0.10 g/L。这与浒苔甲醇提取物对东海原甲藻的起始抑制浓度相近,此外,浒苔干粉末乙酸乙酯提取物添加影响东海原甲藻生长的致死作用阈值浓度与甲醇提取物相似,也为0.50 g/L。
浒苔正己烷提取物对东海原甲藻生长的效应如图2所示。从图中东海原甲藻的生长曲线可以看出,浓度为0.03 g/L的正己烷提取物添加和0.13 g/L的正己烷提取物添加对东海原甲藻的生长的影响作用较小。其中浓度为0.03 g/L的正己烷提取物添加对东海原甲藻的生长表现为较小的促进作用,浓度为0.13 g/L的正己烷提取物添加可对东海原甲藻产生则表现为不太显著的抑制作用。浓度增至为0.25 g/L的正己烷提取物添加时,对东海原甲藻生长表现出较显著的抑制作用。由表2所示,此时东海原甲藻的日平均生长率为48.8%,远低于对照组东海原甲藻日平均生长率(131.7%),但又远远超过0.25 g/L的甲醇或乙酸乙酯提取物添加的东海原甲藻的日平均生长率(1.0%和2.4%)。此外,浒苔正己烷提取物对东海原甲藻的72 h EC50值为0.24 g/L。综上推测浒苔正己烷提取物对东海原甲藻开始出现抑制作用的阈值浓度约为0.15 g/L。当浓度为0.50 g/L浒苔正己烷提取物添加时,则对东海原甲藻的生长表现为强烈的抑制作用,生长极其缓慢。由表2得出此时藻体的日平均生长率仅为3.7%。当浓度为≥0.63 g/L的正己烷提取物添加时,则对东海原甲藻的生长产生强烈的致死效应,3 d内致使东海原甲藻藻体全部死亡,浓度高时则2 d内使藻体致死。说明0.63 g/L的正己烷提取物是影响东海原甲藻生长的致死作用阈值浓度。
综上,并且由表2中所列不同极性溶剂的浒苔提取物添加时,东海原甲藻日均生长率及对其的抑制率等参数所示,可以看出各溶剂浒苔提取物对东海原甲藻生长作用有着明显的差异。其中,蒸馏水的提取物需要较高的添加浓度才会对东海原甲藻的生长产生影响,说明蒸馏水的提取效果比有机溶剂差。浓度为0.03 g/L(约需新鲜浒苔藻体0.11 g湿重/L)有机溶剂提取物添加时东海原甲藻的生长有着轻微差异,其中甲醇和乙酸乙酯提取物对东海原甲藻的生长影响较小,与对照组相比有着极小的抑制作用;而此浓度正己烷提取物对东海原甲藻则表现为一定的促进作用。浓度较高的提取物添加则对东海原甲藻均表现为不同程度的抑制作用。蒸馏水、甲醇、乙酸乙酯、正己烷浒苔提取物影响东海原甲藻生长的致死作用阈值浓度分别为5.00、0.50、0.50、0.63 g/L(相当于浒苔新鲜藻体浓度为 22.00、2.20、2.20、2.75 g 湿重/L)。说明甲醇、乙酸乙酯的对浒苔干粉末的提取液对东海原甲藻的克生作用最为明显,其次是正己烷,最差的是蒸馏水提取液。此外,由浒苔各个溶剂提取物对东海原甲藻的72 h EC50值能得出相同的结论。
2.3 浒苔干粉末提取物对中肋骨条藻生长的影响
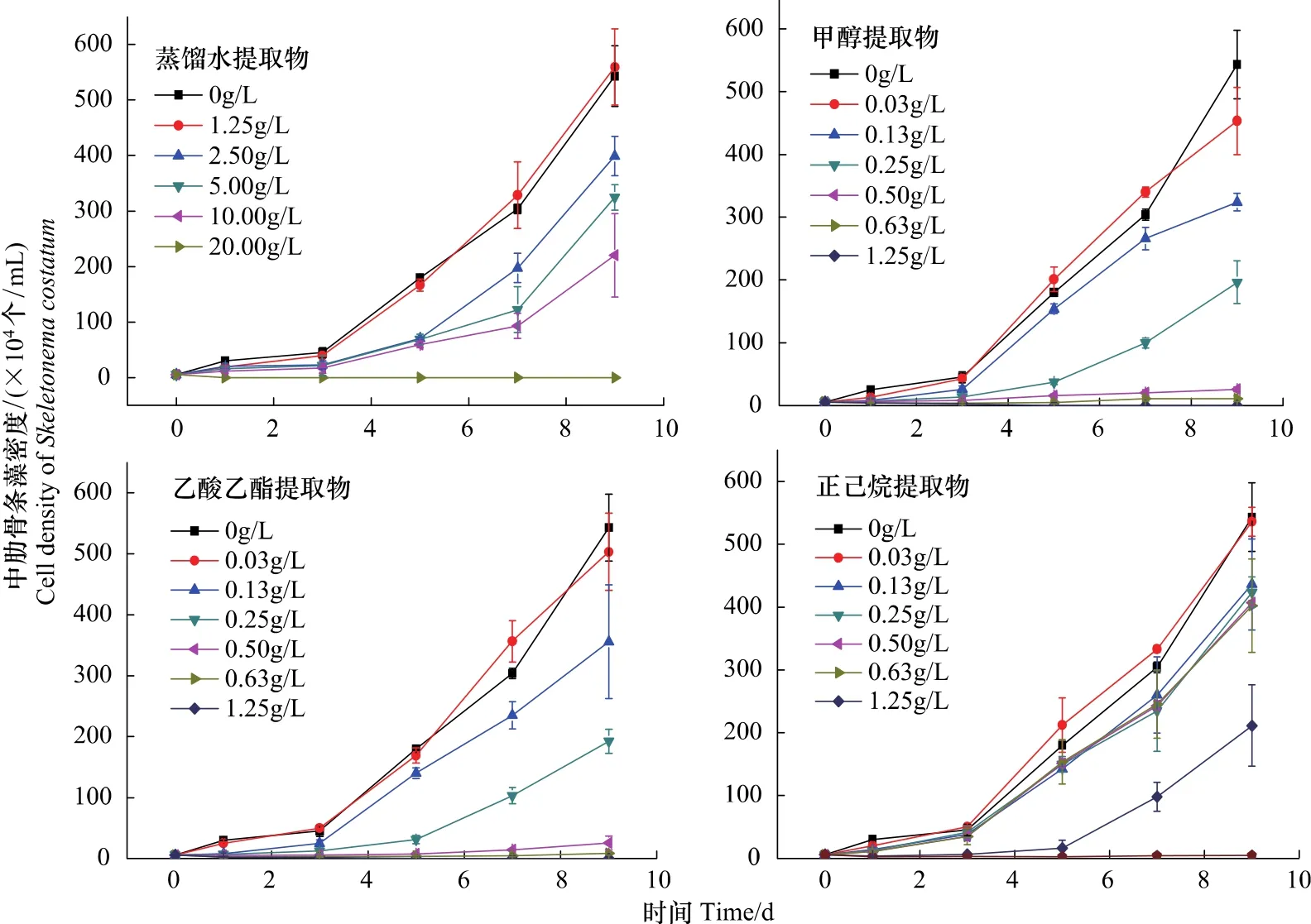
图3 添加了不同浓度浒苔干粉末提取物的中肋骨条藻的生长曲线Fig.3 The growth of Skeletonema costatum in the presence of different concentrations of extracts
浒苔干粉末的蒸馏水提取物对中肋骨条藻生长的影响如图3及表3所示。从图3的中肋骨条藻的生长曲线可以看出,与对照组(0 g/L添加)相比,较低浓度(1.25 g/L添加)的浒苔干粉末蒸馏水提取物对中肋骨条藻的生长几乎没有影响,两条生长曲线基本一致。随着提取物添加浓度的增加,可以看出中肋骨条藻的生长受到的抑制效应逐渐增大,并且梯度十分明显。初步由表3可以看出日平均生长率降低,中肋骨条藻的日平均生长率由2.50 g/L添加浓度的795.0%降至10.00 g/L添加浓度的433.9%。由图推测浒苔蒸馏水提取物对中肋骨条藻开始出现抑制作用的阈值浓度约为1.50 g/L。此外,由表3可知,浒苔蒸馏水提取物对中肋骨条藻的72 h EC50值为11.74 g/L。当浓度为20.00 g/L的蒸馏水提取物添加时,中肋骨条藻藻体在实验1 d就被全部杀死。说明20.00 g/L的蒸馏水提取物添加是影响中肋骨条藻生长的致死作用阈值浓度,大于等于该值时对藻体表现为短期致死的效应。从表3中的抑制率可以得到同样结果。
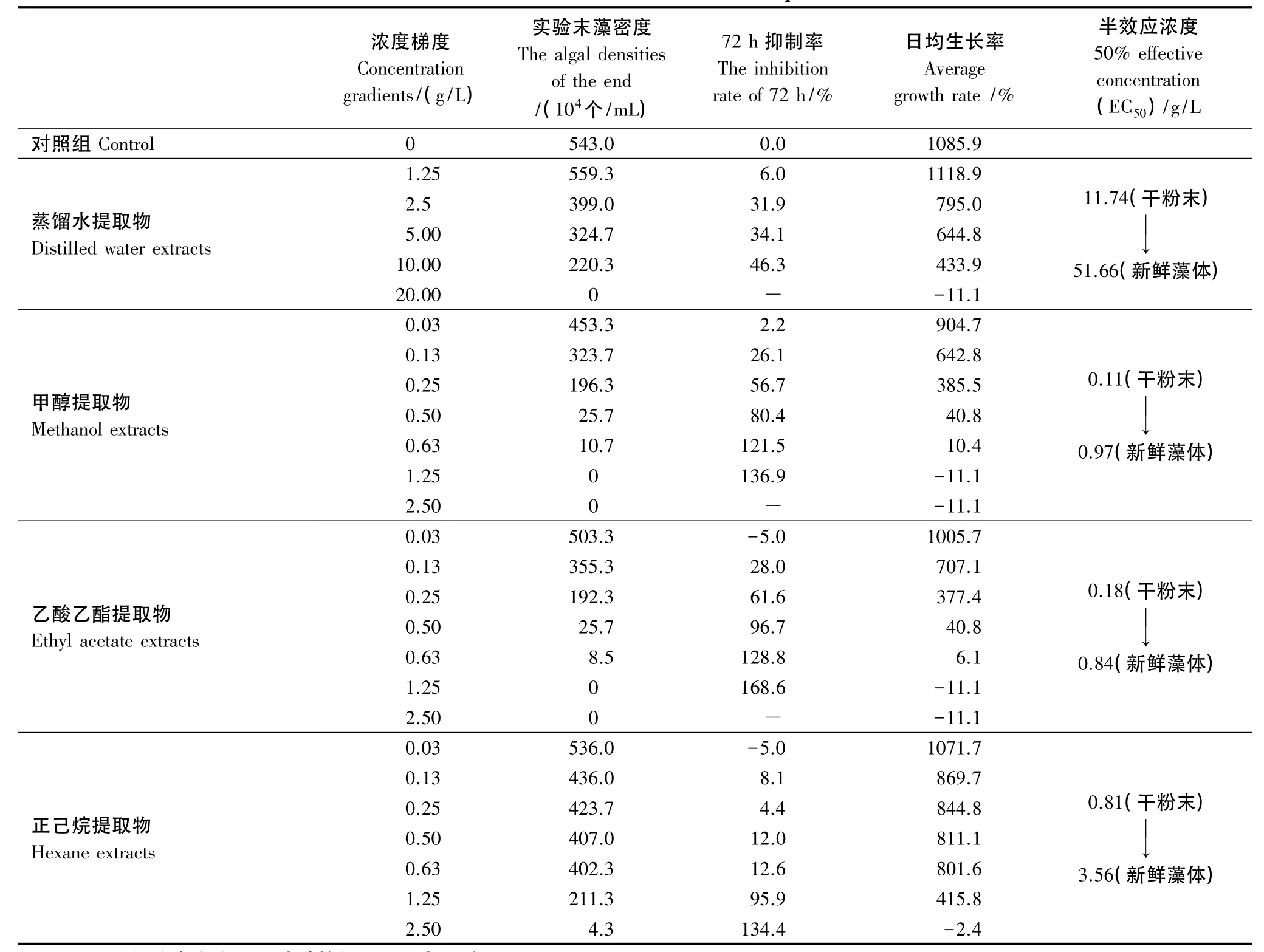
表3 浒苔干粉末不同溶剂提取物对中肋骨条藻生长影响的比较Table 3 The effection of different solvent extracts of Enteromorpha on Skeletonema costatum
浒苔甲醇提取物对中肋骨条藻生长的效应如图3与表3所示。较低浓度(0.03 g/L)的浒苔甲醇提取物的添加与对照组相比,中肋骨条藻的生长曲线基本一致,此添加浓度对藻体生长的影响不显著(P>0.05)。由表3所示,随着提取物添加浓度的增大,中肋骨条藻的生长受到的抑制作用逐渐显著,且抑制率逐渐增大,日平均生长率依次降低。当添加浓度增至0.13 g/L时即表现出了对藻体有着不太明显的抑制作用,藻体进入指数增长期不太明显。由图3推测浒苔蒸馏水提取物对中肋骨条藻开始出现抑制作用的阈值浓度约为0.10 g/L。此外,浒苔甲醇提取物对中肋骨条藻的72 h EC50值为0.22 g/L。由图3可以看出,当浓度为0.25 g/L浒苔甲醇提取物的添加时则对中肋骨条藻的生长表现出了极其强的抑制作用,由表3得出此时中肋骨条藻藻体的日平均生长率仅为385.5%。远小于对照组的1085.9%。为浓度0.50 g/L与0.63 g/L浒苔甲醇提取物的添加时则对中肋骨条藻的生长产生强烈的抑制效应,生长极其缓慢,藻体的日平均增长率分别为40.8%和10.4%。当添加浓度≥1.25 g/L时则对中肋骨条藻的生长产生强烈的致死效应,2 d内致使东海原甲藻藻体全部死亡。说明1.25 g/L的甲醇提取物添加是影响中肋骨条藻生长的致死作用阈值浓度,大于等于该值时对藻体表现为短期致死的效应。从表3中的抑制率也可以得到同样结果。
浒苔乙酸乙酯提取物对中肋骨条藻生长的效应如图3与表3所示。低浓度添加浓度(0.03 g/L)时与甲醇提取物对中肋骨条藻生长的影响程度相似,对中肋骨条藻生长的影响作用不明显。浓度为0.13 g/L的浒苔的乙酸乙酯提取物对中肋骨条藻的生长有较明显的抑制作用,从生长曲线可以看出进入指数增长期不是很明显。由图3推测浒苔乙酸乙酯提取物对中肋骨条藻开始出现抑制作用的阈值浓度也约为0.10 g/L。此外,浒苔乙酸乙酯提取物对中肋骨条藻的72 h EC50值为0.19 g/L。在0.25 g/L的浓度添加时抑制效果更加明显,当增至0.50 g/L与0.63 g/L浓度的浒苔乙酸乙酯提取物添加时,对中肋骨条藻的生长产生极其强烈的抑制作用,使其无法正常自然生长,中肋骨条藻的日平均生长率分别为40.8%和6.1%。当浓度达1.25 g/L时,短期内即可使中肋骨条藻全部死亡。说明1.25 g/L的乙酸乙酯提取物添加是影响中肋骨条藻生长的致死作用阈值浓度,大于等于该值时对藻体表现为短期致死的效应。
浒苔正己烷提取物对中肋骨条藻生长的效应如图3所示。从图中中肋骨条藻的生长曲线可以看出,浓度为0.03 g/L的正己烷提取物添加对东海原甲藻的生长的影响作用较小,表现为较小的促进作用。浓度为0.13、0.25、0.50、0.63 g/L的浒苔正己烷提取物添加时东海原甲藻的生长曲线极其相似。表现为极小的抑制作用,从表3可得此时东海原甲藻的日均生长率分别为869.7%、844.8%、811.1%、801.6%,也对照组(0 g/L添加)的日均生长率1085.9%相差很小。由图3推测浒苔正己烷提取物对中肋骨条藻开始出现抑制作用的阈值浓度约为0.15 g/L。此外,浒苔正己烷提取物对中肋骨条藻的72 h EC50值为0.81 g/L。浓度增至为1.25 g/L的正己烷提取物添加时,对中肋骨条藻生长表现出较显著的抑制作用。由表3所示,此时中肋骨条藻的日平均生长率为415.8%,远低于对照组中肋骨条藻的日平均生长率1085.9%。但与此浓度的甲醇或乙酸乙酯提取物添加对中肋骨条藻有短期致死的现象相比,浒苔正己烷提取物添加时中肋骨条藻的生长相对还是相对较快的。当浓度为2.50 g/L的正己烷提取物添加时,则对中肋骨条藻的生长产生强烈的致死效应,3 d内致使中肋骨条藻藻体全部死亡,浓度高时则2 d内致死。说明2.50 g/L的正己烷提取物添加是影响中肋骨条藻生长的致死作用阈值浓度。
综上,并且由表3中所列不同溶剂的浒苔提取物添加时,中肋骨条藻日均生长率及对其的抑制率等参数所示,可以看出各溶剂浒苔提取物对中肋骨条藻生长作用有着明显的差异。蒸馏水的提取物需要较高的添加浓度才会对中肋骨条藻的生长产生影响,说明蒸馏水的提取效果比有机溶剂差。这和东海原甲藻的实验得出结果一致。浓度为0.03 g/L(约需浒苔的新鲜藻体0.11 g湿重/L干燥得到)有机溶剂提取物添加时中肋骨条藻的生长有着轻微差异,其中甲醇提取物对中肋骨条藻的生长影响较小,与对照组相比有着极小的抑制作用;而此浓度乙酸乙酯与正己烷提取物对中肋骨条藻则表现为一定的促进作用。此浓度时乙酸乙酯提取物对藻体的作用与东海原甲藻实验表现有一定差异,甲醇与正己烷一致。浓度较高的提取物添加则对中肋骨条藻均表现为不同程度的抑制作用。蒸馏水、甲醇、乙酸乙酯、正己烷浒苔提取物影响中肋骨条藻生长的致死作用阈值浓度分别为 20.00、1.25、1.25、2.50 g/L(相当于浒苔新鲜藻体浓度为 88.00、5.50、5.50、11.00 g 湿重/L)。说明甲醇、乙酸乙酯的对浒苔干粉末的提取液对中肋骨条藻的克生作用最为明显,其次是正己烷,最差的是蒸馏水提取液。与东海原甲藻实验相对比,各种溶剂提取物对中肋骨条藻的致死作用阈值浓度较大。此外,由浒苔各个溶剂提取物对中肋骨条藻的72 h EC50值的对比能得出相同的结论。
2.4 不同溶剂提取物对两种赤潮藻克生作用的比较
不同溶剂提取物在不同浓度添加时对两种赤潮藻72 h抑制率的比较如图4所示。从整体上可以明显看出相同条件的提取物添加时,对东海原甲藻的72 h抑制率远大于对中肋骨条藻的抑制率。并且高浓度(≥0.63 g/L)的有机溶剂提取物添加时,东海原甲藻3 d内均已死亡,无法算出72 h抑制率。
浒苔蒸馏水提取物对东海原甲藻与中肋骨条藻的克生作用差异较大。浓度为1.25 g/L的浒苔蒸馏水提取物添加对东海原甲藻的72 h抑制率为负值(-11.1%),表现为较小的促进作用。而此浓度的蒸馏水提取物添加对中肋骨条藻的72 h抑制率为正值(6.0%),表现为较小的抑制作用。浓度为2.50 g/L和2.50 g/L蒸馏水提取物提取物对这两种赤潮藻的72 h抑制率均为正值且差异较大,对东海原甲藻的72 h抑制率约为中肋骨条藻的5倍。说明蒸馏水提取物对东海原甲藻的克生作用高于对中肋骨条藻的克生作用,主要表现为抑制作用。此外,由表3中的浒苔蒸馏水提取物对东海原甲藻与中肋骨条藻的72 h EC50值分别为1.79 g/L与11.74 g/L可得出一致的结论。
浒苔甲醇提取物对东海原甲藻与中肋骨条藻的抑制率如图4所示。低浓度(0.03 g/L与0.13 g/L)浒苔甲醇提取物对东海原甲藻与中肋骨条藻的72 h抑制率相近。高浓度(≥0.25 g/L)浒苔甲醇提取物对东海原甲藻与中肋骨条藻的抑制率的差异较大,随着添加浓度的增大,对东海原甲藻的抑制率迅速增大,而对中肋骨条藻抑制率增大的趋势相对缓和些。此外,由表3中的浒苔甲醇提取物对东海原甲藻与中肋骨条藻的72 h EC50值分别为0.16 g/L与0.22 g/L也可得浒苔甲醇提取物对东海原甲藻的抑制作用更显著些。
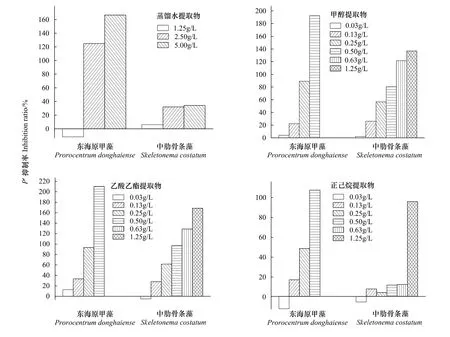
图4 不同溶剂提取物对两种赤潮藻的72 h抑制率比较Fig.4 The inhibition of different solvent extracts of Enteromorpha on the two red tide microalgae
浒苔乙酸乙酯提取物对东海原甲藻与中肋骨条藻的克生作用在低浓度添加时表现为相反的现象。0.03 g/L浓度的浒苔乙酸乙酯提取物添加对东海原甲藻表现为较小的抑制作用,而对中肋骨条藻则表现为较小的促进作用。较高浓度的浒苔乙酸乙酯提取物,均随着浓度的增加对两种藻体的抑制率均随着增大。同条件下的浒苔乙酸乙酯提取物对东海原甲藻的72 h抑制率比对中肋骨条藻的72 h抑制率要高。浓度为0.50 g/L的浒苔乙酸乙酯提取物对东海原甲藻的72 h抑制率迅速升高,说明已临近藻种的致死作用阈值浓度。大于此浓度的浒苔乙酸乙酯提取物添加使东海原甲藻藻体迅速死亡,计算不出其72 h抑制率。说明浒苔乙酸乙酯提取物添加对东海原甲藻的克生作用远大于对中肋骨条藻的克生作用,这与浒苔甲醇提取物的实验结论一致。此外,由表3中的浒苔乙酸乙酯提取物对东海原甲藻与中肋骨条藻的72 h EC50值分别为0.14 g/L与0.19 g/L也可得浒苔乙酸乙酯提取物对东海原甲藻的抑制作用更显著些。
浒苔正己烷提取物对东海原甲藻与中肋骨条藻的抑制率如图4所示。低浓度(0.03 g/L)的浒苔正己烷提取物添加对东海原甲藻与中肋骨条藻的克生作用均表现为促进作用,对东海原甲藻的促进作用更为明显。当浒苔正己烷提取物添加浓度的增加,对东海原甲藻的72 h抑制率迅速增加,浓度大于0.50 g/L时3 d内藻体全部死亡。而随着浒苔正己烷提取物添加浓度的增加中肋骨条藻的72 h抑制率相对变化较小。其中,在添加浓度为0.13 g/L至0.63 g/L时72 h抑制率相对变化极小。当浒苔正己烷提取物添加浓度为1.25 g/L时中肋骨条藻的72 h抑制率迅速增大,说明此时已临近其致死作用阈值浓度。从整体上分析,浒苔正己烷提取物添加对东海原甲藻的克生作用远大于对中肋骨条藻的克生作用,这与浒苔甲醇提取物以及乙酸乙酯提取物的实验结论相一致。此外,由表3中的浒苔正己烷提取物对东海原甲藻与中肋骨条藻的72 h EC50值分别为0.81 g/L与0.24 g/L也可得浒苔正己烷提取物对东海原甲藻的抑制作用更显著些。
综上所述,浒苔组织中确实含有能抑制或者促进两种赤潮藻生长的克生物质,这与国外内的一些关于大型藻类的研究相一致。Jeong等[22]研究发现多种大型海藻的组织提取物对赤潮藻具有杀藻活性,发现一些绿藻、褐藻和红藻组织的甲醇及蒸馏水提取物对一些典型的赤潮藻具有强烈的杀藻作用。大型海藻Myriophyllum spicatum能够持续向海洋系统中分泌不稳定的化合物对蓝藻生长具有一定的抑制作用[2]。霍元子[23]等研究也发现浒苔新鲜组织内存在能抑制米氏凯伦藻的克生物质。贾睿[24]等人研究发现浒苔组织对赤潮异弯藻的生长具有一定的克生作用,浒苔干粉末与赤潮异弯藻的共生系统,干粉末浓度为1.6 g/L时对赤潮异弯藻产生明显的抑制作用,可以初步推测共培养系统比浒苔提取物对赤潮藻的抑制效果更好,贾睿[24]等人还发现克生物质具有较高的极性,这与本研究的结论一致。此外,浒苔对赤潮异弯藻的致死作用阈值浓度比中肋骨条藻和东海原甲藻要低些。证明了浒苔对各种微藻生长的抑制作用各有差异,但起抑制作用的物质普遍均有较高的极性。
从抑制率数值上来看东海原甲藻与中肋骨条藻对各种溶剂提取物的敏感程度不同。总体来看,低浓度时,东海原甲藻与中肋骨条藻敏感程度相近;浓度稍高,东海原甲藻较中肋骨条藻敏感。这可能是由于东海原甲藻和中肋骨条藻细胞结构不同所致。由表3浒苔提取物对东海原甲藻与中肋骨条藻的72 h EC50值来看,不同溶剂的浒苔提取物对东海原甲藻的抑制作用比中肋骨条藻要显著些。另外,从图4中可以很直观的看出对这两种藻克生作用的浓度效应,即浓度越大对其抑制作用越强,某些溶剂的提取物在低浓度情况下可以对藻体产生促进作用。王悠[6,25]等也报道了一些大型藻类对微藻的克生作用具有低促高抑的特点,并且有作用种属的特异性。这也说明了浒苔对赤潮藻的抑制作用的特点都极其相似。
此外,克生物质的分离与提取研究相对较少。别聪聪等[26]人发现包括肠浒苔在内的大型藻对中肋骨条藻的抑制物质,主要包括9-十八炔、邻苯二甲酸二异丁酯、17-烯十八醛等。具体哪种物质具有的抑制效果更显著需进一步验证。孙颖颖等[27]人研究分析克生物质是通过影响细胞蛋白质以及多糖的合成来抑制微藻的生长。
3 结论
本文探索和讨论了4种不同溶剂(包括蒸馏水和甲醇、乙酸乙酯、正己烷3种有机溶剂)的浒苔干粉末提取物对东海原甲藻和中肋骨条藻生长的克生作用。实验结果表明,浒苔提取物中确实含有可以影响这两种赤潮藻类生长的克生物质,克生作用具有较明显的浓度效应,浓度低时(0.03 g/L)可能会表现为一定的促进生长的作用,在较高的浓度时表现为抑制作用,随着添加浓度增加,抑制作用变强,即表现出“低促高抑”的特点,这与浒苔对其他微藻生长的作用[24-27]相似。
蒸馏水提取物对两种赤潮藻的克生作用小于有机溶剂提取物,在有机溶剂中,甲醇和乙酸乙酯提取物对藻体的克生效果最好,正己烷相对较差。根据相似相溶原则,可以初步断定该类克生物质中最有效的成分应为具有相对较高极性的有机物。
两种赤潮藻对克生物质的敏感程度不同,东海原甲藻对克生物质的敏感性高于中肋骨条藻。
[1]Ahn O,Petrell R J,Harrison P J.Ammoniumand nitrate uptake by Laminaria saccharina and Nereocystis leuetkeana originating from a Salmon sea cage farm.Journal of Applied Phycology,1998,10(4):333-340.
[2]Nakai S,Inoue Y,Hosomi M,Murakami A.Growth inhibition of blue-green algae by allelopathic effects of macrophytes.Water Science and Technology,1999,39(8):47-53.
[3]Rice E L.Allelopathy 2nd ed.Orlando:Academic Press,1984:139-233.
[4]Gross E M.Allelopathy of aquatic autotrophs.Critical Reviews in Plant Sciences,2003,22(3/4):313-339.
[5]Legrand C,Rengefors K.,Fistarol G O,Granéli E.Allelopathy in phytoplankton-biochemical,ecological and evolutionary aspects.Phycologia,2003,42(4):406-419.
[6]Wang Y,Yu Z M,Song X X,Zhang S D.Effects of macroalgae on growth of 2 species of bloom microalgae and interactions,between these microalgae in laboratory culture.Environmental Science,2006,27(2):274-280.
[7]Nan C R,Dong SL.Progress on the competition between macroalgae and microalgae.Marine Sciences,2004,28(11):64-66.
[8]Qiu J,Dong SL.Comparative studies on the allelopathic effects of two different strains of Ulva pertusa on Heterosigma akashiwo and Alexandrium tamarense.Journal of Experimental Marine Biology and Ecology,2003,293(1):41-55.
[9]Liu T T,Yang Z F,Ye C P,Wang C H.Inhibitory effects of seaweed Gracilaria lemaneiform is on the growth of two red tide microalgal species.Journal of Jinan University:Natural Science,2006,27(5):754-759.
[10]Zhang SD,Song X X,Wang Y,Yu Z M.Competition on nutrients between gacilaria lemaneiformis and scrippsiella trochoidea(stein)loeblichⅢ.Oceanologia et Limnologia Sinica,2005,36(6):556-561.
[11]Liu JS,Xie J,Yang WD.Studies on haemolytic toxins action in allelopathy of Alexandrium tamarense.Journal of Jinan University:Natural Science and Medicine Edition,2007,28(1):105-107.
[12]Nan C R,Zhang H Z,Dong S L.Growth inhibition of queous extracts of Ulva pertusa on three species of microalgae in red tide.Acta Scientiae Circumstantiae,2004,24(4):702-706.
[13]Wang L G,Xu SN,He W H,He P M.Studies on the antagonistic relationship between seaweed Enteromorpha clathrata and marine microalgae Phaeodactylum tricornutum.Marine Fisheries,2007,29(2):103-108.
[14]Xu Y,Dong SL,Jin Q.Study on Inhibitory Effects of Nine Macroalgae on the Growth of Heterosigma akashiwo.Periodical of Ocean University of China,2005,35(3):475-477.
[15]Yang W D,Li L X,Liu J S,Zhang J J.Allelopathy of marine benthic dinoflagellate-Prorocentrum lima on three red tide algae.Acta Scientiae Circumstantiae,2008,28(8):1631-1637.
[16]Zhang SD,Yu Z M,Song X X,Song F,Wang Y.Competition about nutrients between Gracilaria lemaneiformis and Prorocentrum donghaiense.Acta Ecologica Sinica,2005,25(10):2676-2680.
[17]Hou JN.The Preliminary Study of the Allelopathic Substances of Enteromorpha on Three HABs[D].Qingdao:Ocean University of China,2011.
[18]Gao S,Shi X Y,Wang T.Variation of nutrient concentrations at the inshore coastal area of northern Jiangsu province and the occurrence of green tide caused by Enteromorpha prolifera.Environmental Science ,2012,33(7):2204-2209.
[19]Wang T,Shi X Y,Zhang C S,Wen T T.Variations in nutrient concentration and distribution for green tide of Enteromorpha prolifera occurrence areas of the Yellow Sea in 2008.Marine Science Bulletin,2011,30(5):578-582.
[20]Xia B,Ma SS,Cui Y,Chen B J,Chen JF,Song Y L,Mao Y Z,Jiang Z J.Distribution of temperature,salinity,dissolved oxygen,nutrients and their relationships with green tide in Enteromorpha prolifera outbreak area of the Yellow Sea.Progress in Fishery Sciences,2009,30(5):96-101.
[21]Wang T.The Preliminary Study on the Influence of Enteromorpha on Water-Quality of the Northern Jiangsu Nearshore Sea Area[D].Qingdao:Ocean University of China,2011.
[22]Jeong J H,Jin H J,Sohn C H,Suh K H,Hong Y.Algicidal activity of the seaweed Corallina pilulifera against red tide microalgae.Journal of Applied Phycology.2000,12(1):37-43.
[23]Huo Y Z,Tian Q T,Xu S N,Wang Y Y,Feng Z H,Fang Y,He P M.Allelopathic effects of Ulva prolifera on growth of Karenia mikimotoi.Marine Environmental Science,2010,29(4):497-499,508-508.
[24]Jia R,Wu M,Cai CE,Huo Y Z,He P M.Allelopathic effects of Ulva prolifera on Heterosigma akashiwo.Journal of Fisheries of China,2012,36(4):562-567.
[25]Wang Y,Yu Z M,Song X X,Zhang S D.Effects of Ulva pertusa and Gracilaria lemaneiformis on growth of Heterosigma akashiwo(Raphidophyceae)in co-culture.Environmental Science,2006,27(2):246-252.
[26]Bie C C,Li F M,Li Y Y,Zhao Y H,Wang Z Y.Inhibitory effects of 6 macroalgae extracts on Skeletonema costatum and isolation of allelochemicals.Periodical of Ocean University of China,2011,41(7/8):107-112.
[27]Sun Y Y,Liu X X,Wang C H.Growth inhibition of the four species of red tide microalgae by extracts from Enteromorpha prolifera extracted with the five solvents.Environmental Science,2006,27(2):1662-1669.
参考文献:
[6]王悠,俞志明,宋秀贤,张善东.大型海藻与赤潮微藻以及赤潮微藻之间的相互作用研究.环境科学,2006,27(2):274-280.
[7]南春容,董双林.大型海藻与海洋微藻间竞争研究进展.海洋科学,2004,28(11):64-66.
[9]刘婷婷,杨字峰,叶长鹏,王朝晖.大型海藻龙须菜对两种海洋赤潮藻的生长抑制效应.暨南大学学报:自然科学版,2006,27(5):754-759.
[10]张善东,宋秀贤,王悠,俞志明.大型海藻龙须菜与锥状斯氏藻间的营养竞争研究.海洋与湖沼,2005,36(6):556-561.
[11]刘洁生,谢瑾,杨维东.塔玛亚历山大藻溶血毒素对东海原甲藻的化感作用.暨南大学学报:自然科学与医学版,2007,28(1):105-107.
[12]南春容,张海智,董双林.孔石莼水溶性抽提液抑制3种海洋赤潮藻的生长.环境科学学报,2004,24(4):702-706.
[13]王兰刚,徐姗楠,何文辉,何培民.海洋大型绿藻条浒苔与微藻三角褐指藻相生相克作用的研究.海洋渔业,2007,29(2):103-108.
[14]许妍,董双林,金秋.几种大型海藻对赤潮异弯藻生长抑制效应的初步研究.中国海洋大学学报:自然科学版,2005,35(3):475-477.
[15]杨维东,李丽璇,刘洁生,张剑军.海洋底栖甲藻-利玛原甲藻(Prorocentrum lima)对三种赤潮藻的化感作用.环境科学学报,2008,28(8):1631-1637.
[16]张善东,俞志明,宋秀贤,宋飞,王悠.大型海藻龙须菜与东海原甲藻间的营养竞争.生态学报,2005,25(10):2676-2680.
[17]侯俊妮.浒苔对三种赤潮藻的克生作用初探[D].青岛:中国海洋大学,2011.
[18]高嵩,石晓勇,王婷.浒苔绿潮与苏北近岸海域营养盐浓度的关系研究.环境科学,2012,33(7):2204-2209.
[19]王婷,石晓勇,张传松,温婷婷.2008年黄海浒苔绿潮爆发区营养盐浓度变化及分布特征.海洋通报,2011,30(5):578-582.
[20]夏斌,马绍赛,崔毅,陈碧鹃,陈聚法,宋云利,毛玉泽,蒋增杰.黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系.渔业科学进展,2009,30(5):96-101.
[21]王婷.浒苔对苏北近岸海域水质影响的初步研究[D].青岛:中国海洋大学,2011.
[23]霍元子,田千桃,徐珊楠,王阳阳,冯子慧,房毅,何培民.浒苔对米氏凯伦藻生长的克生作用.海洋环境科学,2010,29(4):497-499,508-508.
[24]贾睿,吴敏,蔡春尔,霍元子,何培民.浒苔对赤潮异湾藻的克生作用.水产学报,2012,36(4):562-567.
[25]王悠,愈志明,宋秀贤,张善东.共培养体系中石莼和江蓠对赤潮异弯藻生长的影响.环境科学,2006,27(2):246-252.
[26]别聪聪,李锋民,李媛媛,赵雅菡,王震宇.六种大型藻浸提液对中肋骨条藻的抑制及活性成分分离.中国海洋大学学报:自然科学版,2011,41(7-8):107-112.
[27]孙颖颖,刘筱潇,王长海.浒苔提取物对4种赤潮微藻生长的抑制作用.环境科学,2006,27(2):1662-1669.
