土壤盐分对三角叶滨藜抗旱性能的影响
2013-12-20谭永芹柏新富侯玉平张振华
谭永芹,柏新富,* ,侯玉平,张振华
(1.鲁东大学生命科学学院,烟台 264025;2.鲁东大学地理与规划学院,烟台 264025)
干旱和盐胁迫是影响植物生长发育、引起农作物减产的主要非生物胁迫因子,干旱通过导致植物水分平衡失调,进而引起代谢紊乱[1];盐分胁迫则会导致渗透胁迫、离子毒害等作用,扰乱植物的营养元素平衡[2-3],并诱发氧化胁迫等次生胁迫作用[4-5],从而影响植物正常生长。虽然Na+是造成植物盐分胁迫的主要因子,然而已有实验证明Na+对许多植物的生长发育或产量、品质都有良好的作用[6-7];Slama等[8]研究还显示Na+可以提高渗透胁迫下盐生植物的光合能力。一些荒漠旱生植物更是把地上部积累Na+作为适应干旱环境的有效策略之一[9-10]。在土壤中较多NaCl存在的条件下,植物细胞质膜内负外正的膜电势和胞外Na+浓度升高建立起的Na+电化学势梯度,有利于Na+从外界环境到植物细胞内的被动运输[11-12],因此,干旱条件将诱使更多Na+被植物体吸收和积累。但是,目前有关植物抗旱性的研究多集中在光合作用、水分利用效率、渗透调节、抗氧化酶活性、抗旱性综合指标等方面,对干旱盐渍环境导致的植物积Na+及其在植物适应干旱中的作用仅有少量相关报道[13-15],本试验以耐盐植物三角叶滨藜(Atriplex triangularis Willd)为材料,研究NaCl对干旱胁迫下三角叶滨藜生长、光合作用、抗氧化活性、水分吸收的调节,探讨NaCl改善植物对干旱胁迫适应的机制,以丰富人们对植物适应干旱盐渍环境机制的了解。
1 材料与方法
1.1 实验材料与处理
实验于2012年3—5月在鲁东大学生命科学学院温室内进行,供试材料为三角叶滨藜(Atriplex triangularis)。将种子播种于装有混合土壤(园土∶细沙=1∶1)的直径45cm的花盆中,适时浇水,确保土壤湿润,出苗后间苗,每盆留7株小苗。待植株长出6片真叶(高约15cm)时将材料分成A、B、C、D、E五组(每组3盆)。A、B两组浇水,C、D、E三组分别浇浓度为0.1、0.2、0.4mol/L的NaCl溶液,浇水或处理液的量为每盆12L,确保盆土中溶液被替换为相应浓度的处理液。随后B、C、D、E组停止浇灌,进行自然干旱处理;处理A则保持见干浇水,即A为没有进行干旱处理的对照(CK)、B为干旱处理(Dry)、C为干旱加0.1mol/L的NaCl(Dry+0.1mol/L NaCl)、D为干旱加0.2 mol/L的NaCl(Dry+0.2 mol/L NaCl)、E为干旱加0.4 mol/L的NaCl(Dry+0.4mol/L NaCl)。在处理期间每5d取成熟叶片进行相关指标测定。
1.2 测定方法
1.2.1 植株生长状况测定
株高增加值以处理前子叶至顶端的高度与实验结束时(处理后的第20天)子叶至顶端的高度的差值计算,每处理重复测定7株。
1.2.2 光合参数测定
利用便携式光合作用测定系统(TPS-1型,PP System,英国)对不同处理下的三角叶滨藜光合参数进行测定(测定光强为960—980μmol·m-2·s-1,开路测定)。该系统能同步获得活体叶片的净光合速率(Pn)、空气CO2浓度(Ca)、细胞间隙CO2浓度(Ci)等生理生态参数,气孔限制值(Ls)用Berry和Downtow[16]的方法计算:。每种处理均取上数第1个成熟叶为测定对象,各处理均重复测定5株植物的5个叶片。
1.2.3 抗氧化酶活性和丙二醛(malondialdehyde,MDA)含量测定
超氧化物歧化酶(superoxide dismutase,SOD)活性和过氧化物酶(peroxidase,POD)活性测定参照孙群等[17]的方法;过氧化氢酶(catalase,CAT)活性测定采用郝建军等[18]的方法;丙二醛含量参照赵世杰[19]的方法测定。
1.2.4 土壤、叶片相对含水量(RWC)测定
用烘干称重法

1.2.5 植株水势、渗透势和细胞膨压的测定
植株水势用压力室法测定;叶片渗透势采用露点微伏压计(HR-33T,美国)测定,叶片先在-18℃冰箱冷冻12h以上,取出解冻至室温后挤压出组织液测定;细胞膨压由“水势-渗透势”计算得出。
1.2.6 叶片Na+含量测定
叶片Na+的提取参照王宝山等[20]的方法,提取液中Na+含量用原子吸收分光光度计(GBC-932B型,澳大利亚)测定。
1.3 数据处理
测定结果以平均值±标准差计。用Origin软件作图、SPSS统计软件进行数据处理和差异性分析。
2 结果与分析
2.1 土壤盐分对三角叶滨藜生长的调节
很多研究表明植物的生长对水分胁迫最为敏感[21]。通过对各处理的植株在处理期间生长状况的测定发现,虽然干旱抑制了植株生长,使植株株高增加量显著低于对照(CK),但干旱加NaCl处理(Dry+0.1—Dry+0.4mol/L NaCl)的植株生长情况明显优于干旱处理(Dry)(图1)。经方差分析和多重比较显示,植株株高增加量在处理D、E之间以及处理C、D之间差异不显著(P>0.05),但处理C、D、E都显著高于处理B(P<0.05)。说明在土壤加入0.1—0.4 mol/L NaCl可明显缓解干旱胁迫对植株生长的抑制作用。
2.2 土壤盐分对三角叶滨藜叶片光合作用的调节
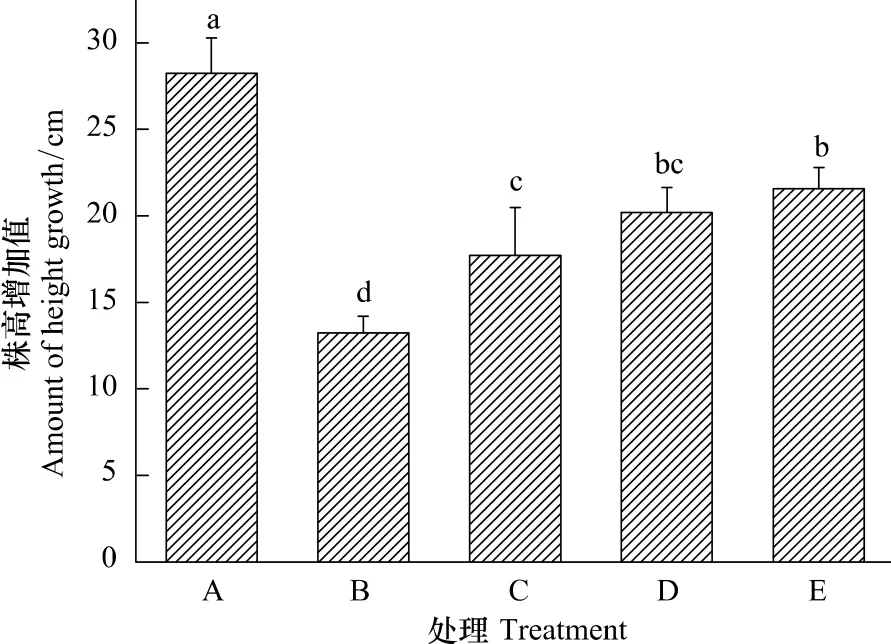
图1 各处理三角叶滨藜植株株高在处理期间的增长量Fig.1 The amount of height growth in arrowleaf saltbush during the period of treatment
对各处理叶片光合速率的测定结果表明,干旱胁迫导致三角叶滨藜叶片的光合速率显著降低(图2),其中处理B(Dry)在处理后第5天光合速率开始大幅下降,至处理后第20天降至近0;而处理C、D、E(Dry+0.1—Dry+0.4mol/L NaCl)的光合速率下降幅度明显小于处理B。进一步分析各处理的细胞间隙CO2浓度和气孔限制值的变化发现,处理B植株在处理后的前10 d叶片细胞间隙CO2浓度下降、气孔限制值升高,10 d后细胞间隙CO2浓度快速升高、气孔限制值则大幅下降;而处理C、D、E的细胞间隙CO2浓度和气孔限制值均无大幅度的下降和升高的变化(图2)。依据高辉远等[22]的观点,可以认为处理B在处理后的前10 d光合速率下降的原因是气孔关闭或部分关闭导致的CO2供应不足,10 d后光合速率下降的主要原因则是光合机构受损导致的叶肉细胞光合活性的降低;而处理C、D、E在测定期限内,光合速率下降的原因主要是气孔因素,并没有引起光合机构的明显受损。可见,在土壤中适量NaCl的存在可缓解干旱对叶片光合作用的影响。
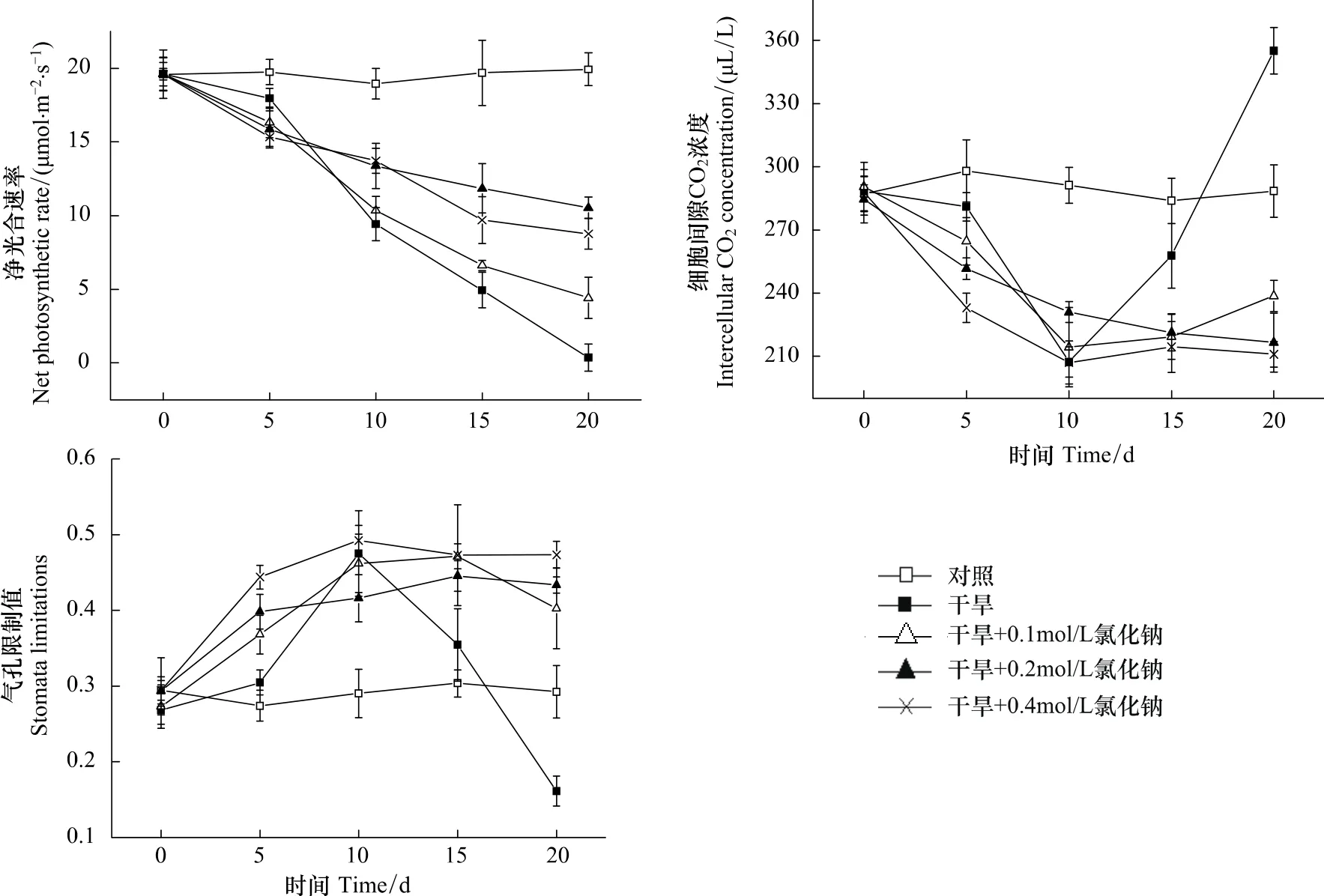
图2 叶片净光合速率、细胞间隙CO2浓度和气孔限制值随干旱时间的变化Fig.2 Changes in net photosynthesis,intercellular CO 2 concentration and stomata limitations in arrowleaf saltbush upon treatment time
2.3 土壤盐分对三角叶滨藜叶片抗氧化活性的调节
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物抗氧化系统中重要的抗氧化酶,分别清除超氧阴离子自由基[23]、羟基自由基和过氧化氢[24],是植物体内消除活性氧伤害的重要防线。从图3中可看出,处理A(CK)植株叶片3种酶活性相对稳定,干旱处理的植株叶片3种酶的活性则显著升高,且处理B(Dry)的3种酶活性的升高幅度明显高于处理C、D、E(Dry+0.1—Dry+0.4mol/L NaCl),并在处理15d后又出现SOD和CAT活性的急剧下降。
MDA是脂质过氧化的产物,其含量表明植物体受活性氧破坏的程度。MDA积累越多,表明植物细胞受伤害程度越大[25-26]。图3显示,三角叶滨藜叶片中MDA含量随干旱时间的延长均呈增加趋势,但处理B的植株叶片MAD含量显著高于处理C、D、E,在干旱处理后20d其MAD含量约为的后三者的1.5—2倍。
2.4 各处理土壤和植株水分状况及组织Na+含量的比较
为了进一步探明土壤盐分在三角叶滨藜耐旱中的作用,本实验对不同处理的土壤和植株水分状况以及组织Na+含量进行了测定,结果见图4和表1。图4显示土壤RWC除对照组因浇水而保持较高外,各处理均随干旱时间的延长而持续下降,但处理C、D、E的土壤RWC下降幅度明显小于处理B;叶片RWC的变化只是在干旱处理的前5d,因土壤水分较充足,各处理的叶片RWC变化均较小,随后变化趋势与土壤相似。这一结果说明土壤盐分的增加既可使土壤维持相对较高的含水量,也有利于保持植株水分。对植株水势、渗透势等的测定结果(表1)进一步证实,虽然处理C、D、E的植株水势与处理B的差异不明显,但由于组织内积累了较多的Na+,降低了渗透势,从而维持了相对较高的细胞膨压和叶片姿态。
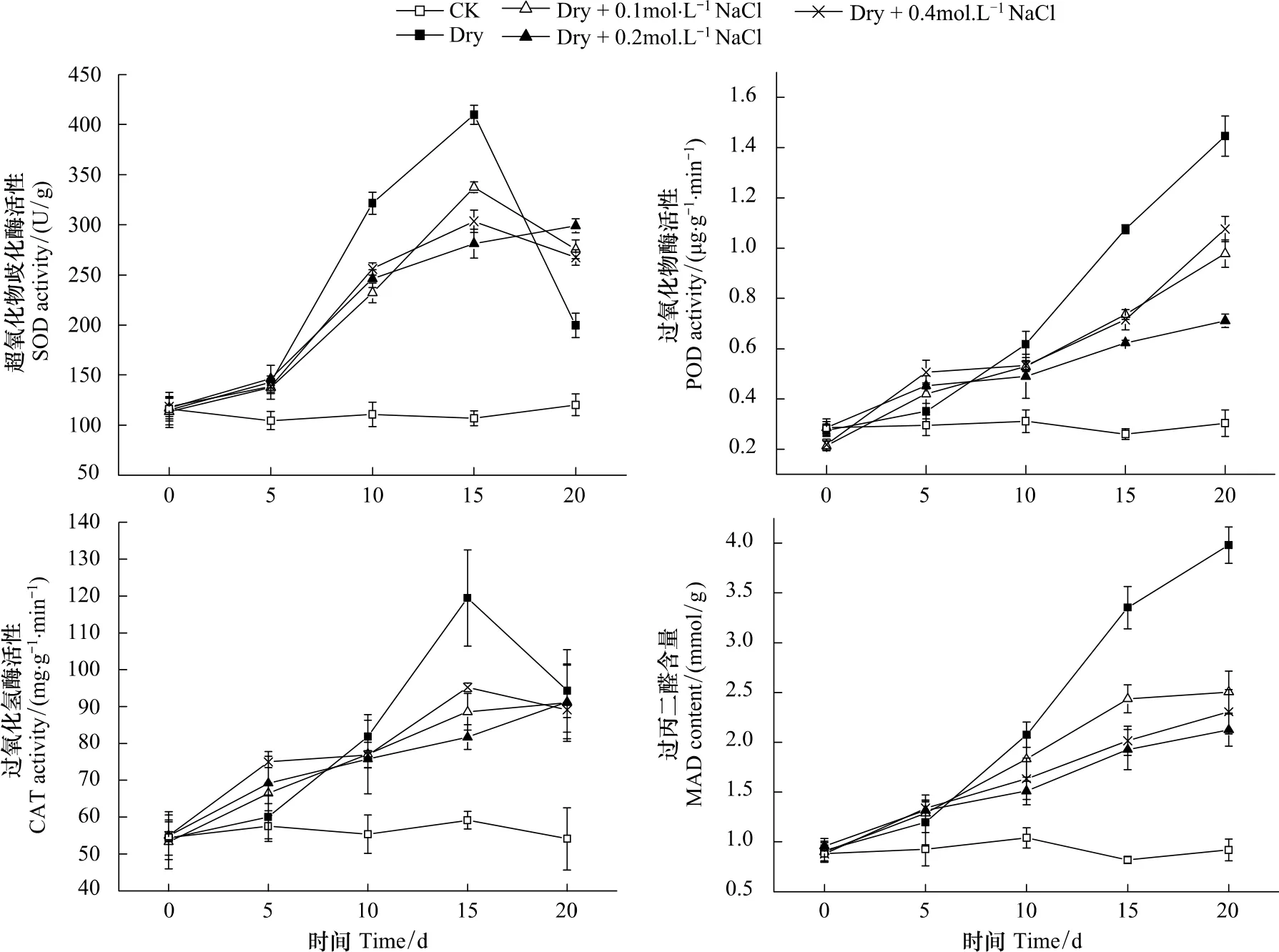
图3 不同土壤盐分下三角叶滨藜叶片抗氧化酶活性和丙二醛含量随干旱持续时间的变化Fig.3 Changes in antioxidant enzyme activity and MAD content in arrowleaf saltbush upon drought duration under different soil salinity
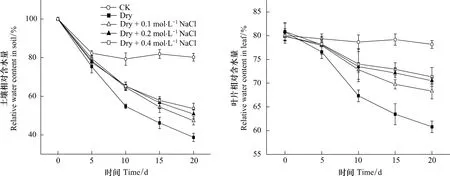
图4 土壤和叶片相对含水量随干旱处理时间的变化Fig.4 Variations of RWC in soil and leaves upon drought duration under different soil salinity
3 讨论
干旱胁迫导致植物细胞供水不足,进而影响植物代谢和生长发育的各个方面,包括光合速率下降、膜脂过氧化加剧、生长受抑制等。植物则通过渗透调节降低其渗透势和水势,增强从外界介质吸水的动力,以维持细胞膨压和植株的代谢、生长[27]。有研究显示,Na+可以改善渗透胁迫下盐生植物的渗透势,增加组织的含水量,且盐分的摄入使植物能够在较低能耗的前提下积累Na+,比合成、积累有机物进行渗透调节更为经济有效[8,28]。本试验结果表明,处理C、D、E(盆土用0.1—0.4 mol/L NaCl溶液浇灌后进行干旱处理)与处理B(盆土直接用水浇灌后进行干旱处理)相比,随着干旱持续时间的延长,不仅土壤和植株均能维持相对较高的含水量,而且由于组织内积累了较多的Na+,使渗透势显著降低,增强了植株吸水力和保水力,使叶片能够维持相对较高的细胞膨压,进而有利于植株代谢的维持和保持生长。
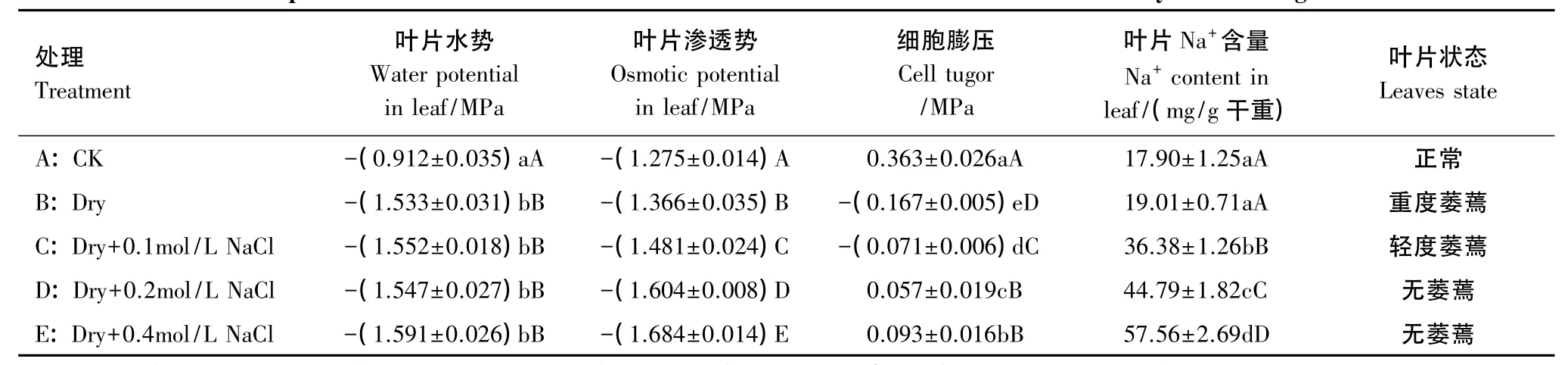
表1 干旱处理后第20天植株叶片水分状况和Na+含量的比较Table 1 Comparison of the water status and Na+content in arrowleaf saltbush leaves in 20 days after drought treatment
干旱胁迫下细胞内产生过剩的活性氧自由基,造成细胞膜系统损伤,影响植物的光合作用等一系列代谢活动[29];同时,活性氧也可作为第二信使介导逆境胁迫下植物体内的信号转导,调节抗氧化酶等相关基因表达及酶活性的上升,从而提高植物的耐逆性[24,30]。SOD、POD和CAT是植物体内重要的抗氧化酶,已有大量研究证明植物的抗旱能力和受伤害程度与这3种酶的活性密切相关,总体表现为SOD、POD、CAT活性随干旱胁迫强度的增大而升高,当胁迫强度超出植物能够承受的程度后,SOD、CAT活性出现降低,POD活性则因植物种类不同而表现出差异[31-34]。本试验对各处理植株光合指标和抗氧化酶活性的测定结果显示,处理B在干旱处理后的前10 d光合速率下降的原因是气孔关闭或部分关闭导致的CO2供应不足;10 d后光合速率下降的主要原因则是光合机构受损导致的叶肉细胞光合活性的降低;而处理C、D、E在测定期限内光合速率下降的原因主要是气孔因素,并没有引起光合机构的明显受损。对抗氧化酶活性测定结果则表明,处理B的三角叶滨藜叶片SOD、POD、CAT活性显著增加,在干旱处理后第15天后,SOD和CAT活性又大幅度下降;而处理C、D、E的SOD、POD、CAT活性变化幅度均明显小于处理B。根据前人的研究与分析,可以推测,处理B干旱期间SOD、POD、CAT活性的大幅升高是干旱胁迫导致的大量活性氧自由基产生所诱导的植株保护性反应,后期SOD和CAT活性的大幅度降低则是活性氧自由基产生的超出了植株清理能力所能承受的范围而导致细胞伤害的结果;而处理C、D、E在干旱期间3种酶活性的变化幅度较小,说明NaCl溶液浇灌土壤减弱了干旱胁迫诱导的活性氧自由基的产生,本试验中对MDA含量的测定结果也证明了这一点。可见,在土壤中适量NaCl的存在可减少活性氧自由基的产生,缓解活性氧自由基诱导的膜脂过氧化作用,降低了干旱胁迫对叶片光合系统的损伤。
可见,土壤中适量盐分存在能够增加三角叶滨藜对Na+的吸收和积累、降低组织渗透势、维持较强的吸水和保水力,从而减弱因干旱脱水导致的过量活性氧自由基产生对细胞膜系统的损伤和对光合机构的破坏,有利于维持相对较高的物质生产能力和细胞的持续生长,最终表现为耐旱性能的增强。
[1]Lu C M,Zhang Q D,Kuang T Y,Wang Z,Gao Y Z.The mechanism for the inhibition of photosynthesis in rice by water stress.Acta Agronomica Sinica,1994,20(5):601-606.
[2]Akita S,Cabuslay G S.Physiological basis of differential response to salinity in rice cultivars//Bassam N E,Dambroth M,Loughman B C,eds.Genetic Aspects of Plant Mineral Nutrition(Vol 42).London:Kluwer Academic Publishers,1990:431-448.
[3]Stępień P,Kłbus G.Water relations and photosynthesis in Cucumissativus L.leaves under salt stress.Biologia Plantarum,2006,50(4):610-616.
[4]Zhang Z G,Shang Q M,Wang L H,Mao SL,Zhang B X.The characteristics of active oxygen metabolism in pepper leaf cells under suboptimal temperature,weak light and salt stress.Acta Horticulturae Sinica,2009,36(11):1603-1610.
[5]Han B,Sun J,Guo SR,Jin C Y.Effects of calcium on antioxidant enzymes activities of cucumber seedlings under salt stress.Acta Horticulturae Sinica,2010,37(12):1937-1943.
[6]Harmer P M,Benne E J.Sodium as a crop nutrient.Soil science,1945,60(2):137-148.
[7]Truog E,Berger K C,Attoe O J.Response of nine economic plants to fertilization with sodium.Soil Science,1953,76(1):41-50.
[8]Slama I,Ghnaya T,Messedi D,Hessini K,Labidi N,Savoure A,Abdelly C.Effect of sodium chloride on the response of the halophyte species Sesuvium portulacastrum grown in mannitol-induced water stress.Journal of Plant Research,2007,120(2):291-299.
[9]Wang SM,Wan C G,Wang Y R,Chen H,Zhou ZY,Fu H,Sosebee R E.The characteristics of Na+,K+and free proline distribution in several drought-resistant plants of the Alxa Desert,China.Journal of Arid Environments,2004,56(3):525-539.
[10]Yang X G,Fu H,Niu D C.Response of physiology of Zygophyllum xanthoxylum seedlings under drought stress.Acta Prataculturae Sinica,2007,16(5):107-112.
[11]Chen M,Li P H,Wang B S.Na+transporters and plant salt tolerance.Plant Physiology Communications,2007,43(4):617-622.
[12]Niu X,Bressan R A,Hasegawa P M,Pardo J M.Ion homeostasis in NaCl stress environments.Plant Physiology,1995,109(3):735-742.
[13]Huang W,Li Z G,Qiao H L,Li C Z,Liu X J.Interactive effect of sodium chloride and drought on growth and osmotica of Suaeda salsa.Chinese Journal of Eco-Agriculture,2008,16(1):173-178.
[14]Liu J P,Gao B,Li X,Song J,Fan H,Wang B S,Zhao K F.The effects of salinity and drought interaction on seed germination and seedling growth of Suaeda salsa L.from different habitats.Acta Ecologica Sinica,2010,30(20):5485-5490.
[15]Bai X F,Zhu JJ,Wang Z L,Tan Y Q,Liu L D.Relationship between the Salt accumulation and the drought resistance in several woody plants in arid zone.Scientia Silvae Sinicae,2012,48(7):45-49.
[16]Berry J A,Downton W J S.Environmental regulation of photosynthesis.//Govind J,ed.Photosynthesis(VolⅡ).New York:Academic Press,1982:263-343.
[17]Sun Q,Hu J J.Research Technology of Plant Physiology.Yangling:Northwest A & F University Press,2006:165-177.
[18]Hao J J,Kang Z L,Yu Y.Experimental Techniques of Plant Physiology.Beijing:Chemical Industry Press,2007:102-103.
[19]Zhao SJ,Liu H S,Dong X C.The Experimental Guide for Plant Physiology.Beijing:China Agricultural Science & Technology Press,1998:161-165.
[20]Wang B S,Zhao K F.Comparison of extractive methods of Na and K in wheat leaves.Plant Physiology Communications,1995,31(1):50-52.
[21]Shan L.Plant drought resistance and semi-dryland farming.Agricultural Research in the Arid Areas,2007,25(1):1-5.
[22]Gao H Y,Zou Q,Cheng B S.Study on the stomatal and nonstomatal limitation during the diurnal course of photosynthesis in soybean leaves.Acta Botanica Boreali-Occidentalia Sinica,1993,13(2):96-102.
[23]Asada K.Production and scavenging of reactive oxygen species in chloroplasts and their functions.Plant Physiology,2006,141(2):391-396.
[24]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction.Annual Review of Plant Biology,2004,55(1):373-399.
[25]Jiang M Y,Guo SC.Iron-catalysed lipid peroxidation in rice seedlings under osmotic stress.Acta Physiologica Sinica,1996,22(1):6-12.
[26]Yu Z Q,Sun M G,Wei H X,Kong Y J,Kong H L.Effect of salt and drought intercross stress on lipid peroxidation and activity of cell defense enzymes in leaves of Gleditsia sinensis seedlings.Journal of Northwest Forestry University,2007,22(3):47-50.
[27]Chen H,Jiang J G.Osmotic adjustment and plant adaptation to environmental changes related to drought and salinity.Environmental Reviews,2010,18(NA):309-319.
[28]Chen CS,Xie Z X,Liu X J.Interactive effects of drought and salt stresses on winter wheat seedlings growth and physiological characteristics of stress-resistance.Chinese Journal of Applied Ecology,2009,20(4),811-816.
[29]Elstner E F.Oxygen activation and oxygen toxicity.Annual Review of Plant Physiology,1982,33(1):73-96.
[30]Mano J.Early events in environmental stresses in plants-induction mechanisms of oxidative stress//Inze D,Montago MV,eds.Oxidative Stress in Plants.New York:Taylor and Francis Publishers,2002:217-245.
[31]Yan X F,Li J,Zu Y G.Effect of drought stress on activity of cell defense enzymes and lipid peroxidation in korean pine seedlings.Acta Ecologica Sinica,1999,19(6):850-854.
[32]Peng L X,Wu D,Li H,Yan G R.Effects of water stress on activities of antioxidant enzymes of Elaeagnus angustifolia L.seedlings.Journal of Tianjin Agricultural University,2007,14(1):1-5.
[33]Zhou H B,Wang Y C,Shi SL,Zhou JH.Response of antioxidant system in leaves of Tetraena mongolica and Zygophyllum xanthoxylon seedlings to drought stress.Acta Botanica Boreali-Occidentalia Sinica,2011,31(6):1188-1194.
[34]Wang SC,Liang D,Li C,Hao Y L,Ma F W,Shu H R.Influence of drought stress on the cellular ultrastructure and antioxidant system in leaves of drought-tolerant and drought-sensitive apple rootstocks.Plant Physiology and Biochemistry,2012,51:81-89.
参考文献:
[1]卢从明,张其德,匡廷云,王忠,高煜珠.水分胁迫抑制水稻光合作用的机理.作物学报,1994,20(5):601-606.
[4]张志刚,尚庆茂,王立浩,毛胜利,张宝玺.亚适温、弱光照及盐胁迫下辣椒叶片活性氧代谢特征.园艺学报,2009,36(11):1603-1610.
[5]韩冰,孙锦,郭世荣,金春燕.钙对盐胁迫下黄瓜幼苗抗氧化系统的影响.园艺学报,2010,37(12):1937-1943.
[10]杨鑫光,傅华,牛得草.干旱胁迫下幼苗期霸王的生理响应.草业学报,2007,16(5):107-112.
[11]陈敏,李平华,王宝山.Na+转运体与植物的耐盐性.植物生理学通讯,2007,43(4):617-622.
[13]黄玮,李志刚,乔海龙,李存桢,刘小京.旱盐互作对盐地碱蓬生长及其渗透调节物质的影响.中国生态农业学报,2008,16(1):173-178.
[14]刘金萍,高奔,李欣,宋杰,范海,王宝山,赵可夫.盐旱互作对不同生境盐地碱蓬种子萌发和幼苗生长的影响.生态学报,2010,30(20):5485-5490.
[15]柏新富,朱建军,王仲礼,谭永芹,刘林德.干旱区木本植物盐分积累与其耐旱性的关系.林业科学,2012,48(7):45-49.
[17]孙群,胡景江.植物生理学研究技术.杨凌:西北农林科技大学出版社,2006:165-177.
[18]郝建军,康宗利,于洋.植物生理学实验技术.北京:化学工业出版社,2007:102-103.
[19]赵世杰,刘华山,董新纯.植物生理学实验指导.北京:中国农业科技出版社,1998:161-165.
[20]王宝山,赵可夫.小麦叶片中Na、K提取方法的比较.植物生理学通讯,1995,31(1):50-52.
[21]山仑.植物抗旱生理研究与发展半旱地农业.干旱地区农业研究,2007,25(1):1-5.
[22]高辉远,邹琦,程炳嵩.大豆光合日变化过程中气孔限制和非气孔限制的研究.西北植物学报,1993,13(2):96-102.
[25]蒋明义,郭绍川.渗透胁迫下稻苗中铁催化的膜脂过氧化作用.植物生理学报,1996,22(1):6-12.
[26]于振群,孙明高,魏海霞,孔艳菊,孔红岭.干旱和盐分交叉胁迫对皂角幼苗膜脂过氧化及保护酶活性的影响.西北林学院学报,2007,22(3):47-50.
[28]陈成升,谢志霞,刘小京.旱盐互作对冬小麦幼苗生长及其抗逆生理特性的影响.应用生态学报,2009,20(4):811-816.
[31]阎秀峰,李晶,祖元刚.干旱胁迫对红松幼苗保护酶活性及脂质过氧化作用的影响.生态学报,1999,19(6):850-854.
[32]彭立新,吴迪,李慧,阎国荣.水分胁迫对沙枣幼苗抗氧化酶活性的影响.天津农学院学报,2007,14(1):1-5.
[33]周红兵,王迎春,石松利,周健华.四合木和霸王幼苗抗氧化系统对干旱胁迫的响应差异.西北植物学报,2011,31(6):1188-1194.
