渍水对油菜苗期生长及生理特性的影响
2013-12-20张树杰胡小加谢立华余常兵李银水廖祥生
张树杰,廖 星,胡小加,谢立华,余常兵,李银水,车 志,廖祥生
(中国农业科学院油料作物研究所农业部油料作物生物学与遗传育种重点实验室,武汉 430062)
渍害是许多国家农业生产所共同面临的重大自然灾害[1-3]。油菜是我国最主要的油料作物[4-5],多数研究发现其抗(耐)渍能力相对较弱[2,6-7]。近年来,长江流域春、秋两季渍害日益严重,给油菜生产带来了十分不利的影响[8-9]。田间渍水引起土壤严重缺氧,不仅使作物根系有氧呼吸减弱、无氧呼吸增加、根系活力降低,还会使作物细胞产生大量的活性氧自由基,导致根系吸收能力减弱、植株光合作用下降,进而引起生长受阻、产量大幅降低[1-2,6,10]。目前有关渍害对作物生长及生理过程影响的研究报道很多,但多数是以渍水胁迫过程为重点,而对渍水胁迫后作物生长恢复方面的研究却相对较少。本研究以甘蓝型油菜(Brassica napus L.)中双11号为材料,通过盆栽模拟试验研究苗期渍水和渍水后油菜生长及生理代谢的响应,以期揭示苗期渍害对油菜生长的影响及作用机制,旨在为提高油菜抗(耐)渍能力、促进渍害后油菜生长恢复提供一定的理论依据。
1 材料与方法
1.1 试验地点及材料
试验于2011年10月至12月在中国农业科学院油料作物研究所网室(湖北武汉,东经114°20',北纬30°37')进行。试验地10、11和12月平均气温分别为16.0℃、9.7℃和4.2℃。供试土壤为黄棕壤,采自湖北省武汉市新洲区阳逻镇(东经 114°54',北纬 30°37')农田耕层(0—20 cm),pH 6.71(H2O 测定,土水比 1∶5),可溶性有机碳 104.1 mg/kg,总氮(N)1.28 g/kg,硝态氮(NO3-N)5.4 mg/kg,铵态氮(NH4-N)4.4 mg/kg,速效磷(P)36.2 mg/kg,速效钾(K)63.9 mg/kg。土壤风干后,过 2 mm 筛、装盆(每盆 5.0 kg),土壤水分用去离子水调整至田间持水量的70%。供试油菜为长江流域广泛种植的双低甘蓝型油菜中双11号,由中国农业科学院油料作物研究所生物技术育种课题组提供。
1.2 试验设计
播种前将挑选过的油菜种子用1%次氯酸钠溶液浸泡10 min,去离子水冲洗干净,室内晾干。播种前每盆施入尿素1.25 g、氯化钾0.75 g、过磷酸钙1.0 g和硼砂0.15 g。10月1日播种,每天用去离子水维持土壤水分为田间持水量的70%(称重法)。四叶期定苗,每盆均匀保留2株。五叶期进行处理,试验包括渍水3 d(Ⅰ)、6 d(Ⅱ)、9 d(Ⅲ)和正常供水对照(CK)4个处理。渍水处理是将整盆放置于塑料水箱内,始终保持水面高于土壤表面1 cm,对照每天浇蒸馏水使土壤含水量保持在田间持水量的70%,土壤水分含量用土壤水分速测仪检测控制(Delta-T Devices Ltd,Moisture Meter type HH2,UK)。分别在试验的0、3、6、9、12、15 d 和 18 d 进行破坏性采样,每处理4个重复(每重复2盆,共计176盆)。每重复中的1株幼苗105℃杀青30 min,70℃烘干48 h至恒重测定生物量,其余植株沿出土线分为地上部和根系,去离子水冲洗干净,4℃保存用于生理指标测定。
1.3 测定项目与方法
根系酶活性测定主要选用靠近根尖的须根部分。叶片酶活性和叶绿素含量测定选用新叶下第3个叶片,叶绿体含量测定选用其余叶片。
1.3.1 光合色素含量测定
取鲜叶0.2 g放置于研钵中,加入少量碳酸钙粉末及2—3 mL 95%乙醇匀浆。然后将匀浆液过滤到25 mL棕色容量瓶中,冲洗研钵和滤纸多次,最后用95%乙醇定容。叶绿素提取液在分光光度计上分别测定645、649 nm和460 nm波长吸光值,计算光合色素含量。为了防止叶绿素的见光分解,所有过程均在4℃、暗光条件下进行[11]。
1.3.2 叶绿体含量测定
取 1.0 g 鲜叶置于 5.0 mL 充分预冷的提取液(pH 8.0,内含 300 mmol/L 山梨醇,50 mmol/L Tris-HCl,5 mmol/L EDTA和0.1% β-巯基乙醇)中匀浆,匀浆液用4层纱布过滤。滤液于4℃、700 r/min离心10 min,弃去细胞核沉淀。上清液再于4℃、2000 r/min离心10 min,所得沉淀即为叶绿体提取液[12],冷冻干燥后称重。
1.3.3 抗氧化酶活性测定
酶液的提取:称取0.5 g鲜样剪碎,加0.05 mol/L,pH 值7.8的磷酸缓冲液(内含1%的 PVP)5.0 mL及少量石英砂,于冰浴中研磨提取,15000 r/min,4℃离心15 min,上清液即为酶提取液,用于SOD、POD和CAT活性的测定。SOD活性采用氮蓝四唑(NBT)光还原法,以抑制光化还原的50%为一个酶活性单位;POD活性采用愈创木酚法,以每分钟内A470变化0.01为一个酶活性单位;CAT采用过氧化氢法,以每分钟内A240变化0.01为一个酶活性单位。抗氧化酶活性单位表示为U/g鲜重,U为一个酶活性单位[13-14]。
1.3.4 叶片硝酸还原酶活性测定
取鲜样 0.5 g 放置于预冷的研钵中,加入 4.0 mL 0.025 mol/L 磷酸缓冲液(pH 8.7,内含 12.11 mg/L 半胱氨酸和3.72 mg/LEDTA)在冰浴中研磨匀浆。匀浆液在4℃、4000 r/min条件下离心15 min。取上清液0.4 mL,加入1.2 mL 0.1 mol/L KOH 缓冲液和0.4 mL 2.0 mg/mL NADH,混匀在 25 ℃水浴中保温30 min。然后加入1.0 mL 1%磺胺溶液终止反应,再加入1.0 mL 0.02%萘基乙烯胺溶液显色15 min,取上清液在540 nm波长下测定吸光值,对照标准曲线计算硝酸还原酶活性。硝酸还原酶活性单位表示为 μg NO2-N·g-1·h-1鲜重[11,15]。
1.4 数据分析
所有数据均为4个重复的平均值±标准误 (±SE),SPSS(16.0)软件进行单因素方差(ANOVA)统计分析,Duncan法多重比较和t检验,差异显著性定义为P<0.05,Excel 10制作相应图表。
2 结果与分析
2.1 苗期渍水处理对油菜生长的影响
整个试验期内,正常供水对照(CK)中双11号油菜干重随时间显著升高(图1)。渍水期间,油菜地上部干重6 d内与CK没有显著差异,但9 d时较CK显著降低;而根系干重3 d时较CK显著升高,此后随时间延后显著降低。18 d时,渍水3 d(Ⅰ)处理地上部和根系干重分别较CK升高了2.2%和18.2%;渍水6 d(Ⅱ)处理地上部和根系干重分别较CK降低了3.2%和12.8%;渍水9 d(Ⅲ)处理地上部和根系干重分别较CK降低了8.8%和24.4%。渍水结束后,处理I干重尽管随时间显著升高,但始终显著低于CK,特别是地上部;处理Ⅱ干重9 d时显著降低,而后虽随时间显著升高;处理Ⅲ干重却随时间显著降低。18 d时,处理Ⅰ、Ⅱ和Ⅲ地上部干重分别较 CK 降低了39.3%,57.5%和 73.7%,根系干重分别较 CK 降低了 25.5%,35.3%和79.8%。
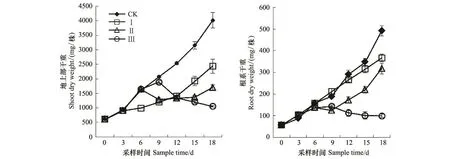
图1 渍水处理对油菜地上部和根系干重的影响Fig.1 Effects of waterlogging on juvenile winter oilseed rape shoot and root dry weight
2.2 苗期渍水处理对油菜叶片光合色素及叶绿体含量的影响
在CK处理中,油菜叶片叶绿素(包括叶绿素a和叶绿素b)含量在0 d至9 d内呈升高趋势,但仅9 d时达到显著性差异,此后没有显著变化(图2)。渍水期间,叶片叶绿素a和叶绿素b含量均随渍水持续时间显著降低,因此叶绿素总量也显著降低。渍水结束时,处理Ⅰ、Ⅱ和Ⅲ叶绿素总量分别较CK降低了17.0%、34.2%和50.7%。渍水结束后3 d,处理Ⅰ、Ⅱ和Ⅲ叶绿素(包括叶绿素a和叶绿素b)含量仍然显著降低,之后随时间显著升高。18 d时,处理Ⅰ、Ⅱ和Ⅲ叶片叶绿素总量分别较CK降低了20.9%、34.0%和44.4%。
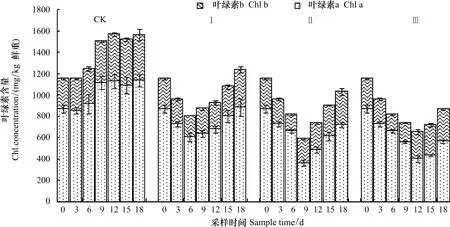
图2 不同渍水时间下苗期油菜叶绿素含量的变化Fig.2 Chlorophyll contents of winter oilseed rape leaves under different period of waterlogging lasted
在CK处理中,油菜叶片类胡萝卜素含量在0 d至9 d内呈显著升高趋势,9 d以后没有显著变化;而叶绿体含量在整个试验期间内没有显著变化(图3)。渍水期间,叶片类胡萝卜素含量随渍水持续时间显著降低;而叶绿体含量却在3 d时轻微升高,3 d至6 d时显著降低,9 d时没有显著变化。渍水结束时,处理Ⅰ、Ⅱ和Ⅲ类胡萝卜素含量分别较CK降低了6.2%、24.3%和36.7%;处理I叶绿体含量较CK升高了1.5%,而处理Ⅱ和Ⅲ叶绿体含量分别较CK降低了50.3%和53.8%。渍水结束后6 d内,处理Ⅰ和Ⅱ类胡萝卜素含量仍然表现为显著降低趋势,6 d后随时间显著升高;而处理Ⅲ类胡萝卜素含量渍水结束后没有显著变化。处理Ⅰ叶绿体含量在渍水结束后6 d内随时间显著降低,之后显著升高,18 d时接近CK水平;处理Ⅱ叶绿体含量渍水结束后6 d内没有显著变化,之后显著升高;处理Ⅲ叶绿体含量没有显著变化。18 d时,处理Ⅰ、Ⅱ和Ⅲ叶片类胡萝卜素含量分别较 CK降低了16.6%、22.2%和33.2%,叶绿体含量分别较 CK降低了5.9%、26.6%和46.8%。

图3 渍水对苗期油菜叶片类胡萝卜素和叶绿体含量的影响Fig.3 Effects of waterlogging on the carotenoid and chloroplast content of juvenile winter oilseed rape leaves
2.3 渍水处理对苗期油菜叶片硝酸还原酶活性的影响
整个试验期内,CK处理叶片硝酸还原酶(NR)活性没有显著变化(图4)。渍水期间,油菜叶片硝酸还原酶活性随时间显著降低。渍水结束时,处理Ⅰ、Ⅱ和Ⅲ叶片硝酸还原酶活性分别比CK降低了10.0%、55.8%和72.6%。渍水结束后3 d内,叶片硝酸还原酶活性3 d内仍然表现为显著降低趋势,3 d后显著升高。18 d时,处理Ⅰ、Ⅱ和Ⅲ叶片硝酸还原酶活性分别比CK降低了22.9%、26.5%和49.5%。
2.4 渍水处理对苗期油菜抗氧化酶活性的影响
整个试验期间,CK叶片和根系中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均没有显著变化(图5)。渍水期间,叶片和根系SOD活性在3 d时显著降低,6 d时显著升高,6 d至9 d时没有明显变化均显著高于CK;叶片POD活性随时间显著升高,而根系POD活性随时间显著降低;叶片CAT活性在3 d时显著降低,6 d时虽较3 d时显著升高但仍然低于CK,9 d时又显著降低,而根系CAT活性随时间显著降低。渍水结束后,处理Ⅰ叶片和根系SOD活性均显著升高,6 d达到最大值而后显著降低,18 d时显著低于CK;处理Ⅱ叶片和根系SOD活性显著降低,9 d达到最小值而后显著升高,18 d时显著低于CK;处理Ⅲ叶片和根系SOD活性降低3 d(仅根系达到显著性差异)后显著升高,18 d时显著高于CK。处理Ⅰ叶片POD活性随时间显著降低,9 d恢复至CK水平,而根系POD活性随时间显著升高,15 d时恢复至CK水平;处理Ⅱ叶片POD活性随时间显著升高,15 d时开始显著降低,18 d时显著高于CK,而根系POD活性随时间显著升高;处理Ⅲ叶片POD活性随时间显著升高,12 d时开始降低,而根系POD活性显著降低,12 d时达到最小值而后显著升高,18 d时显著低于CK。处理Ⅰ叶片和根系CAT活性随时间显著升高,18 d时,叶片CAT活性显著高于CK,而根系CAT活性恢复至CK水平;处理Ⅱ叶片和根系CAT活性均随时间显著升高,18 d时均显著高于CK;处理Ⅲ叶片CAT活性随时间显著升高,18 d时显著高于CK,而根系CAT活性先降低后显著升高,18 d时显著低于CK。
3 讨论
大量研究证实,渍害抑制作物生长、降低作物产量,如小麦[10,16-17]、玉米[18]、大豆[19]和棉花[20]等均有相关报到。渍害对油菜生长影响的研究也很多,例如,Leul等[7]研究发现,苗期渍水使油菜花期干重较对照降低16.0%。宋丰萍等[6]研究也发现,苗期渍水10 d,油菜地上部和根系干重分别较对照降低16.6%和23.1%;蕾苔期渍水10 d,油菜地上部和根系干重分别较对照降低19.1%和21.4%;花期渍水10 d,油菜地上部和根系干重分别较对照降低16.9%和20.5%。本试验也得出类似的结果,即渍水超过3 d就会显著降低中双11号油菜生长(图1)。此外,渍水3 d(Ⅰ)处理干重在渍水结束后虽随时间显著升高,但其生长率显著低于对照CK;渍水6 d(Ⅱ)处理干重在渍水结束后3 d内仍然显著降低,而后虽随时间显著升高,但其生长率也显著低于CK;而渍水9 d(Ⅲ)处理干重在渍水结束后一直处于显著降低的趋势(图1)。这些研究结果说明,渍水对苗期油菜生长的影响不仅在于渍水期间,还在于渍水后的恢复期长短,随着渍水持续时间的延长危害显著增加,所需的恢复时间也显著延长。
叶绿体是绿色植物光合作用的场所,光合色素是光合作用系统的中心成分,其含量变化的最直接结果是改变植物的光合作用[11,13]。渍水引起作物,如小麦[21]、玉米[22]和油菜[2]叶绿素含量和光合作用降低的报道很多。在本试验中,油菜叶片光合色素(包括叶绿素a、叶绿素b和类胡萝卜素)含量随渍水持续时间显著降低(图2,图3),叶绿体含量也在渍水持续时间超过3 d后显著降低(图3)。因此,降低叶绿体及叶绿素含量,进而引起光合作用降低可能是渍水抑制作物生长的主要原因之一。本试验还发现,渍水结束时,油菜叶片类胡萝卜素含量降低幅度显著高于相同处理叶绿素含量降低幅度;而且渍水处理叶绿素含量在渍水结束3 d后开始随时间显著升高,而类胡萝卜素含量只有处理Ⅰ和Ⅱ在渍水结束6 d后才开始显著升高(图2,图3)。这些研究结果说明,渍水对苗期油菜叶片类胡萝卜素含量的影响要大于对叶绿素含量的影响。
硝酸还原酶(NR)是植物氮(N)素代谢过程中的起始酶和限速酶,是催化NO-3转化为NO-2的关键酶,而叶片是作物NO-3利用的主要场所,因此叶片硝酸还原酶活性往往被作为植物N素同化利用能力的评价指标[11,15]。本试验中,油菜叶片硝酸还原酶活性随渍水持续时间显著降低(图4),这与Shambhoo等[22]研究发现玉米叶片硝酸还原酶活性随渍水时间显著降低的结果一致,表明渍水处理显著降低了苗期油菜氮素的吸收和利用。此外,油菜叶片硝酸还原酶活性在渍水结束3 d后才开始显著升高,到试验结束时仍然显著低于CK(图4),说明渍水对油菜苗期吸收和利用N素的影响也存在一定的滞后性。因此,降低N素的吸收利用,可能也是苗期渍水降低了油菜生长的原因之一。
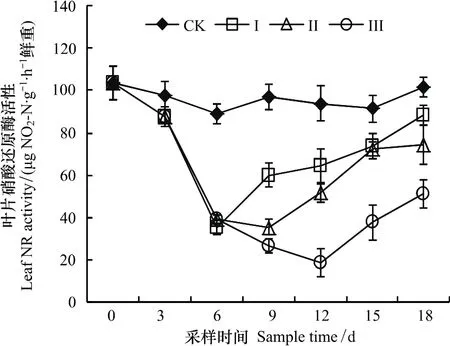
图4 渍水处理对苗期油菜叶片硝酸还原酶活性的影响Fig.4 Effects of waterlogging on the leaf nitrate reductase activity of winter oilseed rape

图5 渍水处理对苗期油菜叶片和根系抗氧化酶活性的影响Fig.5 Effects of waterlogging on the antioxidant enzyme activities of winter oilseed rape leaf and root
大量研究表明,渍水诱使植物体内活性氧自由基大量形成,导致细胞膜脂过氧化加剧,从而使油菜叶片叶绿体和光合色素含量显著降低[1,2,18]。因为光合作用时会不可避免的产生活性氧自由基,正常生理代谢条件下,叶绿体活性氧产生和清除是平衡的;但在胁迫条件下,这种平衡将被打破,过量的活性氧自由基会引起叶绿体膜脂双层分子结构发生变化,导致叶绿体被膜膨胀和断裂、最终解体[23]。因此,渍水引起过氧化胁迫是导致叶绿体和光合色素含量下降(图2,图3),进而引起光合作用降低的主要原因。
另一方面,植物体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的协调作用能有效清除活性氧自由基,减轻植物受到的过氧化损害[2,13-14,20]。但不同作物抗氧化酶活性对渍水的响应却不一致,如渍水条件下,小麦叶片SOD和CAT活性显著降低[24];大麦叶片SOD活性显著降低,而CAT和POD活性显著升高[25];棉花叶片SOD和CAT活性降低,而POD活性却显著升高[20]。油菜方面,Leul等[26]研究发现,渍水条件下,油菜幼苗SOD、POD和CAT活性显著降低,而采用烯硝唑处理后,SOD、POD、CAT活性和油菜耐湿性均显著提高。李玲等[2]研究发现,短期渍水油菜叶片SOD和CAT活性随时间显著升高,而长期渍水油菜叶片SOD和CAT活性随时间显著降低,时间转折点为13 d。这些研究结果与本试验并不完全一致,渍水期间,油菜叶片SOD和CAT活性表现为先降低后升高趋势,而POD活性则表现为随渍水持续时间显著升高;油菜根系SOD活性表现为先降低后升高趋势,而POD和CAT则表现为随渍水持续时间显著降低(图5)。这种差异可能是因为作物种类、供试品种、处理时间或试验条件不同所致。渍水结束后,虽然这三个酶的活性都在趋于CK水平,但在试验结束时,处理Ⅰ最接近CK,处理Ⅱ次之,处理Ⅲ偏离最远(图5)。这些结果表明,渍水后油菜抗氧化酶活性恢复也存在滞后现象,滞后期随渍水持续时间的延长而延长。
4 结论
综上所述,渍水持续时间超过3 d显著抑制苗期油菜的生长,这与渍水降低油菜叶绿体及光合色素含量、N素吸收利用以及引起过氧化胁迫有关;渍水对苗期油菜生长的影响主要在于渍水后的生理恢复,无论是叶绿体和光合色素含量,还是硝酸还原酶及抗氧化酶活性,他们的恢复均表现出滞后性,渍水时间越长滞后期也就越长;在苗期油菜叶片光合色素中,渍水对类胡萝卜素的影响要大于对叶绿素的影响。
[1]Irfan M,Hayat S,Hayat Q,Afroz S,Ahmad A.Physiological and biochemical changes in plants under waterlogging.Protoplasma,2010,241:3-17.
[2]Li L,Zhang CL,Zhang SJ,Li GM.Effects of waterlogging on growth and physiological changes of winter rapeseed seedling(Brassica napus L.).Chinese Journal of Oil Crop Sciences,2011,33(3):247-252.
[3]Shabala S.Physiological and cellular aspects of phytotoxicity tolerance in plants:the role of membrane transporters and implications for crop breeding for waterlogging tolerance.New Phytologist,2011,190:289-298.
[4]Zhang SJ,Zhang C L.Effects of inoculating earthworm on the seed yield and its oil content of winter oilseed rape.Chinese Journal of Applied Ecology,2011,22(6):1499-1503.
[5]Zhang SJ,Wang Q,Li GM,Zhang CL.Dynamics of essential metal elements contents in winter oilseed rape during cold acclimation.Agricultural Science& Technology,2011,12(8):1156-1160.
[6]Song F P,Hu L Y,Zhou G S,Wu JS,Fu T D.Effect of waterlogging time on rapeseed(Brassica napus L.)growth and yield.Acta Agronomic Sinica,2010,36(1):170-176.
[7]Leul M,Zhou W J.Alleviation of waterlogging damage in winter rape by application of uniconazole:Effects on morphological characteristics,hormones and photosynthesis.Field Crops Research,1998,59:121-127.
[8]Zhang SJ,Zhang C L.Influences of climate changes on oilseed rape production in China.Journal of Agro-Environment Science,2011,30(9):1749-1754.
[9]Zhang SJ,Wang H Z.Policies and strategies analyses of rapeseed production response to climate change in China.Chinese Journal of Oil Crop Sciences,2012,34(1):114-122.
[10]Li JC,Wei F Z,Wang C Y,Yin J.Effects of waterlogging on senescence of root system at booting stage in winter wheat.Acta Agronomic Sinica,2006,32(9):1355-1360.
[11]Zhang SJ,Zhang CL,Li L,Yu L P.Effects of nitrogen forms on winter oilseed rape(Brassica napus L.)seedling growth.Chinese Journal of Oil Crop Sciences,2011,33(6):567-573.
[12]Zhang N H.The optimized method of source density gradient centrifugation to isolate intact chloroplasts.Experimental Technology and Management,2010,27(7):44-46.
[13]Zhang SJ,Li L,Zhang CL,Li GM.Influences of cadmium on the growth and micro-elements contents of oilseed rape seedlings.Journal of Agro-Environment Science,2011,30(5):836-842.
[14]Zhang S J,Hu F,Li H X,Li X Q.Influence of earthworm mucus and amino acids on tomato seedling growth and cadmium accumulation.Environmental Pollution,2009,157:2737-2742.
[15]Zhang SJ,Chao Y,Zhang C L,Cheng J,Li J,Ma N.Earthworms enhanced winter oilseed rape(Brassica napus L.)growth and nitrogen uptake.Agriculture,Ecosystems & Environment,2010,139:463-468.
[16]Li C Y,Cai J,Jiang D,Dai T B,Cao W X.Effects of hardening by pre-anthesis waterlogging on grain yield and quality of post-anthesis waterlogged wheat(Triticum aestivum L.cv.Yangmai 9).Acta Ecologica Sinica,2011,31(7):1904-1910.
[17]Jiang D,Fan X M,Dai T B,Cao W X.Nitrogen fertilizer rate and post-anthesis waterlogging effects on carbohydrate and nitrogen dynamics in wheat.Plant and Soil,2008,304:301-314.
[18]Tang B,Xu SZ,Zou X L,Zheng Y L,Qiu F Z.Changes of antioxidative enzymes and lipid peroxidation in leaves and roots of waterloggingtolerant and waterlogging-sensitive maize genotypes at seedling stage.Agricultural Sciences in China,2010,9:651-661.
[19]Rhine M D,Stevens G,Shannon G,Wrather A,Sleper D.Yield and nutritional responses to waterlogging of soybean cultivars.Irrigation Science,2010,28:135-142.
[20]Guo W Q,Chen B L,Liu R X,Zhou Z G.Effects of nitrogen application rate on cotton leaf antioxidant enzyme activities and endogenous hormone contents under short-term waterlogging at flowering and boll-forming stage.Chinese Journal of Applied Ecology,2010,21(1):53-60.
[21]Collaku A,Harrison SA.Loses in wheat due to waterlogging.Crop Science,2002,42:444-450.
[22]Shambhoo P,Ram P C,Uma S.Effect of waterlogging duration on chlorophyll content,nitrate reductase activity,soluble sugar and grain yield of maize.Annals of Plant physiology,2004,18:1-5.
[23]Yu H,Liu Z L,Hu H L,Guan Q W,Wan F X.Effect of drought stress on the ultramicrostructures of chloroplasts and mitochondria of five plants.Bulletin of Botanical Research,2011,31(2):152-158.
[24]Jiang D,Tao Q N,Zhang G P.Effect of waterlogging on senescence of flag leaf and root of wheat Yangmai 5.Chinese Journal of Applied Ecology,2002,13(11):1519-1521.
[25]Yordanova R Y,Christov K N,Petrova L P.Antioxidative enzymes in barley plants subjected to soil flooding.Environmental and Experimental Botany,2004,51:93-101.
[26]Leul M,Zhou W J.Alleviation of waterlogging damage in winter rape by uniconazole application:Effects on enzyme activity,lipid peroxidation and membrane integrity.Journal of Plant Growth Regulation,1999,18:9-14.
参考文献:
[2]李玲,张春雷,张树杰,李光明.渍水对冬油菜苗期生长及生理的影响.中国油料作物学报,2011,33(3):247-252.
[4]张树杰,张春雷.接种蚯蚓对油菜籽粒产量和含油率的影响.应用生态学报,2011,22(6):1499-1503.
[6]宋丰萍,胡立勇,周广生,吴江生,傅廷栋.渍水时间对油菜生长及产量的影响.作物学报,2010,36(1):170-176.
[8]张树杰,张春雷.气候变化对我国油菜生产的影响.农业环境科学学报,2011,30(9):1749-1754.
[9]张树杰,王汉中.我国油菜生产应对气候变化的对策和措施分析.中国油料作物学报,2012,34(1):114-122.
[10]李金才,魏凤珍,王成雨,尹钧.孕穗期土壤渍水逆境对冬小麦根系衰老的影响.作物学报,2006,32(9):1355-1360.
[11]张树杰,张春雷,李玲,余利平.氮素形态对冬油菜幼苗生长的影响.中国油料作物学报,2011,33(6):567-573.
[12]张年辉.优化的蔗糖密度梯度离心法分离完整叶绿体.实验技术与管理,2010,27(7):44-46.
[13]张树杰,李玲,张春雷,李光明.镉对油菜幼苗生长及微量元素含量的影响.农业环境科学学报,2011,30(5):836-842.
[16]李诚永,蔡剑,姜东,戴廷波,曹卫星.花前渍水预处理对花后渍水逆境下扬麦9号籽粒产量和品质的影响.生态学报,2011,31(7):1904-1910.
[20]郭文琦,陈兵林,刘瑞显,周治国.施氮量对花铃期短期渍水棉花叶片抗氧化酶活性和内源激素含量的影响.应用生态学报,2010,21(1):53-60.
[23]郁慧,刘中亮,胡宏亮,关庆伟,万福绪.干旱胁迫对5种植物叶绿体和线粒体超微结构的影响.植物研究,2011,31(2):152-158.
[24]江东,陶勤南,张国平.渍水对小麦扬麦5号旗叶和根系衰老的影响.应用生态学报,2002,13(11):1519-1521.
