小牛血清去蛋白肠灌注用于治疗放射性肠炎的临床观察
2013-12-20陈炬辉潘丁龙王春梅
陈炬辉 潘丁龙 王春梅
福建省肿瘤医院放疗科,福建福州 350014
盆腔、腹腔、腹膜后肿瘤,尤其是妇科肿瘤及前列腺肿瘤是最常见的恶性肿瘤,放射治疗已经成为恶性肿瘤综合治疗过程中一个不可缺少的重要环节。但放疗中常常出现累及小肠、结肠和直肠的放射性肠炎(radiation enteritis,RE)。据流行病学不完全统计,目前我国放射性肠炎发生率高达7%~21%[1],常表现为腹痛、腹泻、大便次数增多、便脓、便血,严重者可出现肠粘连、肠狭窄、肠梗阻。放射性肠炎不仅给患者带来不便和痛苦,同时还会导致放疗计划不能顺利进行进而影响治疗效果[2],因此,如何防治放射性肠炎已经成为医生和患者急需解决的关键问题。小牛血清去蛋白提取物能有效防治放射所致的皮肤黏膜损伤,在放射性口腔黏膜炎防治上已得到广泛的应用[3],然而对于放射性肠炎的临床应用报道较少,本研究采用随机对照研究法来评价小牛血清去蛋白提取物保留灌肠治疗放射性肠炎疗效,同时寻找一种能预测疗效的生化指标。
1 资料与方法
1.1 一般资料
选择2010年12月~2012年12月间我院肿瘤科门诊及住院进行放射治疗的盆腔肿瘤患者108例,所有患者经X线钡剂检查、肠系膜血管造影、内窥镜检查、活组织检查以及病理证实、无远处转移及影响放疗的严重内科疾病、卡氏评分>70,并签署了相关治疗知情同意书。所有患者随机分为观察组和对照组各54例,观察组男15例,女39例,年龄 37~72岁,平均(50.1±13.2)岁,体重 51~82 kg,平均(67.1±18.5)kg;病理类型:宫颈癌 20例、卵巢癌13例、直肠癌10例、膀胱癌7例、前列腺癌4例;采用放射损伤分级标准对放射性肠炎进行分级:Ⅱ度放射性肠炎32例,Ⅲ度放射性肠炎22例。对照组男17例,女 37例,年龄40~75岁,平均(48.0±16.0)岁,体重47~ 78kg,平均(63.3±15.2)kg;病理类型:宫颈癌 18例、直肠癌13例、卵巢癌12例、膀胱癌6例、前列腺癌5例;Ⅱ度放射性肠炎30例,Ⅲ度放射性肠炎24例。所有患者均为术后单纯放射治疗,两组患者在年龄、性别、体重指数、病理类型以及放射性肠炎分级等方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
从放疗疗程开始第1天,观察组应用小牛血清去蛋白提取物(黑龙江省珍宝岛制药有限公司,H20013157),给药方式为:生理盐水50mL+小牛血清去蛋白提取物200mg,保留灌肠,1次/d,5次/周。对照组给药方式为:生理盐水50mL+庆大霉素8mg+地塞米松5mg+维生素B121mg,保留灌肠。一般用药时间在当日放疗结束后1h内给药,至常规放射治疗结束后1周为止。
1.3 观察指标及疗效评价
两组患者于放疗前1天开始抽静脉血送检血清C反应蛋白,之后每放疗5次抽1次静脉血,持续至放疗疗程结束。采用美国BD公司生产的凝血检测专用真空采血管采集者放疗后1h左右的静脉血3mL置于含枸橼酸钠抗凝管中,3000r/min,离心15min,制备的血浆严格按操作规程定量检测CRP,跟踪观察患者病情,对照组采用相同方法采集静脉血3mL。CRP检测采用免疫散射比浊法,采用美国贝克曼库尔特有限公司生产的贝克曼ACL7000全自动血凝仪上进行,采用配套的增强型乳胶免疫分析定量检测试剂盒,定标血浆由美国贝克曼公司提供。
放疗结束后,依据RTOG/EORTC小肠/大肠晚期放射性损伤分级方案[4]:0级,无明显肠道症状;Ⅰ级,轻度腹泻,轻度痉挛,轻度直肠分泌物增多或出血;Ⅱ级,中度腹泻和肠绞痛,大便>5次/日,多量直肠黏液或间断出血;Ⅲ级,梗阻或出血,需手术;Ⅳ级,发生坏死、穿孔、瘘道。
放疗评定标准[5]:治愈(CR):分级下降至0级;部分缓解(PR):分级下降但未达到0级;无效(NC):分级无下降,甚至上升。有效率为CR+PR。
1.4 统计学处理
2 结果
2.1 两组患者C反应蛋白与放疗疗程的关系
由表1可知,随着放疗计划的开展,两组患者的C反应蛋白水平均不断升高,但观察组的C反应蛋白水平增长速度要显著慢于对照组(P<0.05),说明小牛血清去蛋白提取物能有效降低放疗患者C反应蛋白水平。
表1 C反应蛋白水平与放疗疗程的关系(± s,mg/dL)

表1 C反应蛋白水平与放疗疗程的关系(± s,mg/dL)
注:放疗前,与对照组比较,t=0.396,*P>0.05;放疗期内,与对照组比较,t=3.687、3.826、4.021、4.394、4.739,**P 均< 0.05。
C反应蛋白水平观察组(n=54) 对照组(n=54)0 0.27±0.05* 0.29±0.06 5 0.38±0.05** 0.49±0.07 10 0.62±0.07** 0.91±0.12 15 0.87±0.10** 1.26±0.17 20 1.19±0.16** 2.08±0.21**25 1.85±0.222.76±0.28疗程内放疗次数
2.2 两组临床疗效比较
治疗前后两组各级放射性直肠炎的分布见表2,观察组中30例患者分级由Ⅰ级下降到0级,治愈率为55.56%(30/54);14例患者分级由Ⅱ级下降到Ⅰ级,部分缓解率为25.92%(14/54);10例患者分级无下降,无效率为18.52%(10/54);总有效率为81.48%(44/54)。对照组中21例患者分级由Ⅰ级下降到0级,治愈率为38.89%(21/54);11例患者分级由Ⅱ级下降到Ⅰ级,部分缓解率为20.37%(11/54);16例患者分级无下降,6例患者分级下降到Ⅲ级,无效率为40.74%(22/54);总有效率为59.26%(32/54)。总有效率组间比较差异有统计学意义(P<0.05)。
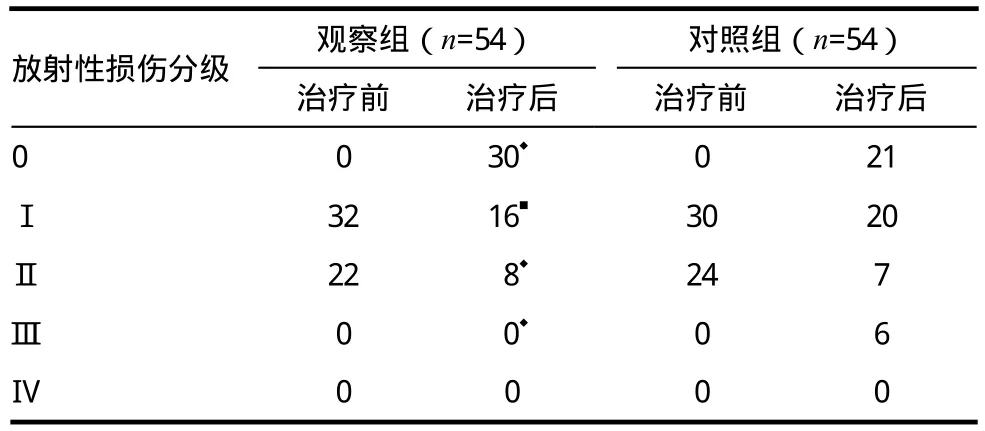
表2 治疗前后两组各级放射性直肠炎的分布
观察组患者首次出现放射性直肠炎时间为(18.0±4.0)d,剂量为(28.0±7.0)Gy;对照组患者首次出现放射性直肠炎时间为(12.0±3.0)d,剂量为(19.0±5.0)Gy,提示观察组推迟了放射性直肠炎发生时间并缩短了临床症状持续时间(t=4.218,P<0.05)。
3 讨论
放射线对诸如盆腔、腹腔、腹膜肿瘤,以及妇科肿瘤及前列腺肿瘤细胞具有确切杀灭作用,放射治疗已成为恶性肿瘤综合治疗不可或缺的手段。然而放射线是把双刃剑,在杀灭肿瘤细胞同时也对正常细胞造成肠道放射性损伤,其损伤程度与下列因素有关[2]:(1)照射的强度和时间。(2)腹腔或盆腔内粘连固定的肠段易受放射性损伤。(3)子宫切除后直肠所受到的辐射量较子宫未切除者高,更易发生放射性直肠炎。(4)不同部位的肠道内辐射耐受量的强弱依次为:直肠>小肠、结肠>胃。病理学研究表明,放射线可直接或间接致细胞损伤,直接损伤主要是由于细胞直接吸收高量辐射能,间接损伤由于放射线与组织细胞内水分子相互作用产生自由基并经由自由基作用引起DNA损伤和复制障碍,但具体机制不是非常清楚。近年来,随着恶性肿瘤远期生存率不断提高,放射性肠炎的发生率亦将增高,其中国外文献报道为5%~15%,国内为7%~21%。放射性肠炎已成为影响盆腹腔肿瘤放疗进程和放疗患者生存质量的重要不利因素,如何防治放射性肠炎已经成为医生和患者急需解决的关键问题。综合国内外相关文献,目前预防放射性肠炎的方法包括[6]:(1)放射线精确定位,放射剂量分割给予;(2)隔离小肠,避免射线照射;(3)肠道局部药物保护肠道正常功能。
小牛血清去蛋白提取物从小牛血清中提取得到的去蛋白血液透析物,其主要成分之一的磷酸肌醇寡糖被认为起着胰岛素受体后第二信使的作用,可促进葡萄糖的摄取和利用,同时能活化细胞功能,促进肉芽组织增生,增加黏膜的血液供应,有修复溃疡的作用[7]。最新研究表明,小牛血清去蛋白提取物推迟了口腔急性放射性黏膜损伤的发生时间,并可降低Ⅲ、Ⅳ级急性放射性黏膜损伤的发生率,疗效肯定,且不良反应少[8]。
本研究显示,C反应蛋白是随着放疗次数的增加而升高,观察组的C反应蛋白的增长速度要显著慢于对照组。提示小牛血清去蛋白提取物能有效地减轻黏膜炎症反应,可考虑用C反应蛋白作为监测小牛血清去蛋白提取物疗效的血清指标[9]。本研究还显示,小牛血去蛋白提取物在盆腔恶性肿瘤放射治疗所致放射性直肠炎治疗中,可以使放射性直肠炎的发生时间明显推迟(6.0±3.0)d,使直肠HTOG急性放射损伤分级程度明显降低,并且放射性直肠炎的治疗总有效率提高22.22%,显著改善了肿瘤患者在放疗期间的生活质量。
此外,饮食调理和营养支持在放射性肠炎治疗中具有重要地位,其主要作用包括:(1)改善患者的营养状况和免疫功能,尤其是需要接受手术治疗的患者,可增强患者对手术的耐受力,减少术后并发症的发生;(2)可减少消化液分泌,缓解腹泻、腹痛等临床症状;(3)促进受损肠黏膜修复。营养支持首选肠内营养,对于不能耐受肠内营养或肠内营养补充不足的部分,可由静脉营养补充。谷氨酰胺是肠黏膜细胞特异性营养物质,对肠黏膜的再生及维护肠屏障功能均具有重要作用。对已排除肿瘤复发放射性肠炎患者,在营养支持的基础上,给予谷氨酰胺和生长激素,行肠康复治疗,已取得较好的疗效。
综上所述,本研究证实予以小牛血清去蛋白提取物保留灌肠能有效减轻放射性肠炎,改善患者的生存质量,为保证患者顺利完成放疗计划提供了有利条件,为临床上急性放射性肠炎的防治提供了一种新思路。
[1] 刘文华,孙兴华,洪月光.中西医结合治疗放射性直肠炎30例的近期临床观察[J].河北中医药学报,2012,27(4):26-27.
[2] Singh AK,Menard C,Guion P,et a1.Intrarectal amifostine suspension may protect against acute proctitis during radiation therapy for prostate cancer:a pilot study[J].Int J Radiat Oncol BiolPhys,2006,65(4):1008-1013.
[3] Ohashi R,Takadiashi K,Miura K,et a1.Prognostic factors in patients with inoperable non-small cell lung cancer:an analysis of long-term survival patients[J].Gan To Kagaku Ryoho,2006,33(11):1595-1602.
[4] 卜俊国,肖明星,吴刚.经静脉应用小牛血去蛋白提取物并西药保留灌肠治疗宫颈癌急性放射性肠炎的疗效[J].实用医学杂志,2012,28(15):2563-2565.
[5] 刘林林,王红勇,杨建征,等.小牛血去蛋白提取物治疗急性放射性直肠炎的近期疗效观察[J].癌症进展杂志,2008,6(3):316-321.
[6] 李荣富,孙涛.放射性肠炎发生机制的研究进展[J].医学综述,2011,17(2):257-262.
[7] 张罗生,何本夫,罗显荣,等.小牛血清去蛋白提取物防治急性放射性直肠炎的临床研究[J].实用医学杂志,2012,28(9):1519-1522.
[8] 张学成,肖锋,魏丽春,等.爱维治防治急性放射性口咽黏膜损伤的临床研究[J].实用口腔医学杂志,2006,12(4):496-498.
[9] 高广周,孙涛.放射性肠炎的非手术治疗进展[J].医学综述,2010,16(18):2767-2771.
